
02 Определение показателя адиабаты воздуха методом адиабатического расширения и изохорического нагрева
.pdfЛабораторная работа №6
ОПРЕДЕЛЕНИЕ СP/СV С ИСПОЛЬЗОВАНИЕМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ И ИЗОХОРИЧЕСКОГО НАГРЕВА
Цель работы: Экспериментально определить показатель адиабаты воздуха методом адиабатического расширения и изохорического нагрева.
Литература:
1.Сивухин Д.В. Общий курс физики: учебное пособ. для студ. физических спец. вузов: в 5 Т. Т. II. Термодинамика и молекулярная физика.– М.: Физматлит, 2005. – 544 с.
2.Иродов И.Е. Физика макросистем. Основные законы: Учеб. пособие для вузов. – М. ; СПб.: Физматлит: Невский Диалект: Лаборатория Базовых Знаний, 2001. – 199 с.
3.Никеров В.А. Физика для вузов: Механика и молекулярная физика / В.А. Никеров. – Москва: Дашков и К°, 2012. – 136 с. Режим доступа:
http://www.studentlibrary.ru/book/ISBN9785394006913.html
4.Введение в технику эксперимента/ Составитель: Беленко И.А. –БелГУ, 2004. – 124 с.
Приборы, оборудование и их характеристики:
1.Стеклянный баллон;
2.U – образный водяной манометр;
3.Резиновая груша;
4.Электронный секундомер «Интеграл ЧС – 01».
Теория метода
Отношение теплоемкостей газа при постоянном давлении и при постоянном объеме CР  CV играет в термодинамике весьма важную роль. В
CV играет в термодинамике весьма важную роль. В
частности, оно входит в уравнение Пуассона, которое описывает адиабатическое расширение газа (процесс, который протекает без обмена теплом между термодинамической системой и окружающей средой)
pV =const. |
(1) |
Поскольку идеальной теплоизоляции не существует, то реальный процесс не может быть строго адиабатическим. Но если термодинамический процесс проходит быстро, то за время протекания процесса сколько-нибудь значительный теплообмен произойти не успевает, и такой процесс можно с достаточной точностью считать адиабатическим. Этот прием используется в одном из самых простых методов определения Cp  CV – методе адиабатиче-
CV – методе адиабатиче-
ского расширения и изохорического нагрева (метод Клемана и Дезорма). Пусть в закрытом стеклянном сосуде находится исследуемый газ при
комнатной температуре Т1 и давлении p1, несколько превышающем атмо-

сферное давление p0.
Откроем кран, сообщающий сосуд с атмосферой. Давление газа начнет сравниваться с атмосферным, а его температура сначала несколько понизится из-за быстрого расширения, а затем снова начнет приближаться к комнатной.
Если теплопроводность стенок сосуда мала (стекло обладает, как известно, низкой теплопроводностью), а отверстие крана достаточно велико, то равновесие по давлению устанавливается значительно быстрее, чем равновесие по температуре, т.е.
t p tT , |
(2) |
где через t p , tT обозначены соответственно времена выравнивания давле-
ния и температуры.
Пусть кран был открыт в течение промежутка времени t такого, что
tT t t p . |
(3) |
В этом случае теплообменом, происходящим за время t |
через стенки |
баллона, можно пренебречь, и процесс расширения оказывается почти адиабатическим.
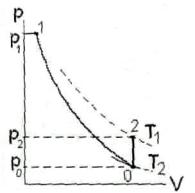
Заметим, что в конце адиабатического расширения давление р2 равно атмосферному давлению р0, а температура Т2 оказывается несколько ниже комнатной температуры Т1, т. е. Т2 <Т1 (температура газа понижается, так как работа расширения совершается за счет внутренней энергии газа)1.
Переходя в (1) с помощью уравнения Менделеева – Клапейрона к переменным р, Т, найдем, что для адиабатического процесса
Т |
|
Т |
|
|
p |
1 |
T |
|
|
|
1 |
|
2 |
или |
|
1 |
|
|
1 |
. |
(4) |
|
|
|||||||||
1 |
|
1 |
|
|
|
|
|
|
|
|
р1 |
|
р0 |
|
|
p0 |
T2 |
|
|
||
После того, как кран вновь отключает сосуд от атмосферы, происходит медленное изохорное нагревание газа со скоростью, определяемой теплопроводностью стеклянных стенок. Вместе с ростом температуры растет и давле-
ние газа. За время
tT
система достигает равновесия, и установившаяся температура газа T становится равной комнатной температуре T1.
Процесс выравнивания температуры при закрытом кране подчиняется закону Гей-Люссака (изохора)
|
p0 |
|
p2 |
, откуда |
Т1 |
|
р2 |
. |
(5) |
|
|
|
|
|
|||||
|
T2 |
|
T1 |
Т 2 |
|
р0 |
|
||
Исключая с помощью (5) отношение температур T1/Т2 |
из (4), найдем |
||||||||
1 Исследование адиабатического расширения газа удобно производить в переменных р, Т, а не р, V, потому что процесс происходит при переменной массе газа, остающегося в баллоне. Изменение массы газа никак не сказывается на вычислениях в переменных р, Т, но крайне неудобно при использовании в качестве независимой переменной объема, занимаемого газом.
|
|
|
|
|
|
|
1 |
|
|
|
|
|
1 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
p2 |
p1 |
p2 |
|
p0 |
|
||||||||||
|
|
||||||||||||||
|
|
|
|
|
или |
|
|
|
|
||||||
|
|
|
|||||||||||||
|
p0 |
|
|
|
|
|
|
|
p0 |
|
|
p1 |
|
||
|
|
|
|
p0 |
|
|
|
|
|
||||||
Разрешим это уравнение относительно . Для этого прологарифмируем это равенство. Получим
|
|
ln |
p2 |
|
|
|
|
ln |
|
p0 |
|
|
|
|
|
||
1 |
|
p |
0 |
|
|
|
|
|
p |
|
|
|
|
||||
|
|
|
|
, откуда |
|
|
|
1 |
|
|
. |
(6) |
|||||
|
|
ln |
p0 |
|
|
|
ln |
p0 |
|
ln |
p2 |
|
|
|
|||
|
|
p1 |
|
|
|
p1 |
p0 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
Таким образом, определение показателя адиабаты по методу КлеманаДезорма требует последовательного проведения с исследуемым газом двух термодинамических процессов – адиабатического (1-0) и изохорного (0-2) (см. рис.1). Показатель адиабаты определяется тремя давлениями – p1 и p0 до и после адиабатического расширения и давлением p2 после изохорного нагревания системы до первоначальной температуры. При этом измерений температуры не требуется.
Рис. 1. Метод Клемана-Дезорма: последовательность термодинамических процессов
Экспериментальная установка
Экспериментальная установка (рис.2) состоит из стеклянного баллона А, снабженного краном К, и U – образного манометра М, измеряющего избыточное, по сравнению с атмосферным, давление газа в баллоне А. U – образный манометр заполнен водой.
Измерения проводятся для воздуха. При измерении для воздуха
избыточное давление в баллоне А создается с помощью резиновой груши Г, подсоединенной к баллону трубкой Д, снабженной краном К1.
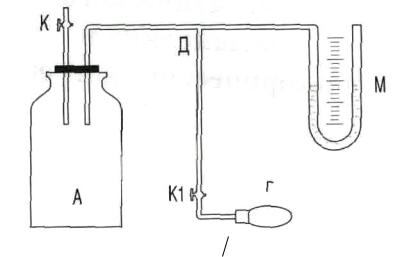
Рис. 2. Установка для определения Cp CV |
методом Клемана и Дезорма |
|||
|
Теория эксперимента |
|
||
В нашем эксперименте давления р1 |
и р2 |
мало отличаются от p0 и фор- |
||
мулу (6) можно существенно упростить. Введем обозначения |
|
|||
|
p1 p0 р1, |
p2 p0 р2 , |
(7) |
|
где р0 – атмосферное давление, а р1 и |
р2 – избыточные давления, которые |
|||
измеряются водяным манометром М. |
|
|
|
|
Избыточные давления, измеряемые U – образным манометром, про- |
||||
порциональны |
разности уровней |
воды |
в коленах |
манометра |
p k h k (hл |
hп ) , где hл – уровень воды в левом, а hп – в правом колене |
|||
манометра, k – коэффициент пропорциональности (в Па/см). Поэтому равенства (7) можно переписать в виде
p1 p0 k h1 , p2 p0 k h2 , (8)
где h1 – показания манометра до адиабатического расширения, а h2 – пока-
зания манометра после изохорного нагревания газа до комнатной температуры.
Подставляя равенства (8) в уравнение (6), и преобразовывая его, полу-
чим
|
|
|
|
ln |
|
p0 |
|
|
|
|
|
|
|
|
|
ln |
|
p1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
p1 |
|
|
|
|
|
|
|
|
p0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
p |
0 |
|
ln |
p |
|
|
|
|
p |
ln |
|
p |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
ln |
|
|
|
|
2 |
|
|
|
ln |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
p1 |
p0 |
|
|
|
|
p0 |
|
p0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
(9) |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
p0 k h1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k h1 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
ln |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
p0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ln 1 |
p0 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
p0 k h1 |
ln |
|
p0 |
k h2 |
|
|
|
|
|
k h |
|
|
|
|
|
k h |
|
|||||||||||||||||||||||
|
ln |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ln 1 |
|
1 |
|
|
ln |
1 |
|
2 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
p0 |
|
|
|
|
|
|
|
|
|
|
p0 |
|
|
|
|
|
|
|
p0 |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p0 |
|||||||||||||||
Разлагая выражения с логарифмами в последнем равенстве в ряд по

малому параметру х h p0 1 и пренебрегая членами второго порядка малости, получим
p0 1 и пренебрегая членами второго порядка малости, получим
|
|
|
|
|
|
k h |
|
|
|
|
|
|
|
|
|||
|
|
|
ln 1 |
|
|
1 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
p0 |
|
|
|
|
h1 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
. |
(10) |
|||||
|
|
k h |
|
|
|
|
|
k h |
|
h h |
|||||||
|
ln 1 |
|
1 |
|
|
ln |
1 |
|
2 |
|
1 |
2 |
|
|
|||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
p0 |
|
|
|
|
|
p0 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
При желании можно вычислить следующий член ряда и оценить, таким образом, величину ошибки, возникающую при использовании формулы (10).
Как следует из (10), для определения Cp  CV необходимо знать из-
CV необходимо знать из-
быточное (над атмосферным) давление в баллоне до адиабатического расширения газа и его избыточное давление после изохорного нагревания.
Следует подчеркнуть, что обе величины должны измеряться в состоянии термодинамического равновесия, т. е. после прекращения теплообмена.
При выводе формулы (6) предполагалось, что в момент, когда кран закрывается, давление в сосуде равно атмосферному. Это не совсем точно, так как истечение воздуха сопровождается колебаниями давления, и в момент отключения от атмосферы давление в сосуде может быть как больше, так и меньше атмосферного. Это приводит к тому, что при малых временах t p
(меньше 1 с) результаты отдельных измерений заметно отличаются друг от друга (случайный разброс). При увеличении времени t p (больше 1 с) коле-
бания давления становятся меньше, но за это время происходит заметный теплообмен. Следствием является уменьшение давления p2 ( h2 ) и заниже-
ние значения . Поэтому окончательный результат мы будем получать экстраполяцией зависимости от t p к значению t p = 0.
Выполнение работы
1. Перед началом работы убедитесь, что краны и места сочленений трубок достаточно герметичны. Для этого наполните баллон с помощью резиновой груши воздухом до давления, превышающего атмосферное на 10–25 см вод. ст., и перекройте кран K1.
Увеличение давления в баллоне сопровождается повышением температуры. Вследствие теплопроводности стенок с течением времени происходит понижение температуры воздуха в баллоне и вместе с тем понижение давления (изохорное охлаждение).
По U-образному манометру проследите за тем, как изменяется давление h1 (разность уровней воды в левом и правом коленах: h1=hл-hп) в баллоне с течением времени t. Результаты измерений запишите в табл.1.
1 ln(1 x) x |
x2 |
|
x3 |
|
x4 |
... |
|
|
|
||||
2 |
3 |
4 |
|
|||

|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1 |
||
t, с |
0 |
30 |
60 |
90 |
120 |
150 |
180 |
210 |
240 |
270 |
300 |
… |
600 |
|
hл, см |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
hп, см |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h1, см |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Если установка достаточно герметична, то по истечении некоторого времени tT , необходимого для установления термодинамического равнове-
сия, давление в баллоне перестанет понижаться. В противном случае необходимо найти и устранить течь.
2. Постройте график h1=f(t).
Из графика определите время установления термодинамического равновесия tT . Все последующие измерения следует проводить после установ-
ления равновесных условий в установке.
После проведения предварительного опыта приступите к основному эксперименту.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 2 |
|||
|
№ |
|
|
Давление |
р1 |
|
|
|
|
|
Давление |
р2 |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
изме- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
hл, |
|
|
hп, |
|
h1, |
|
t p |
, с |
|
hл, |
|
hп, |
|
h2, |
|
|||||||||||
|
рения |
|
см |
|
|
см |
|
см |
|
|
см |
|
см |
|
см |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
1 |
|
|
2 |
|
|
3 |
|
4 |
|
5 |
|
|
|
6 |
|
7 |
|
8 |
|
9 |
10 |
|
11 |
|
|||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Снова наполните баллон с помощью резиновой груши воздухом до давления превышающего атмосферное на 10 – 25 см вод. ст. и перекройте кран K1. Выждите время tT и после установления термодинамического рав-

новесия занесите в таблицу 2 значения уровня жидкости в левом (hл) и в правом (hп) коленах манометра (колонки 2 и 3 таблицы). Рассчитайте и занесите в таблицу избыточное давление воздуха в баллоне h1 = hл – hп (колонка 4).
Затем на очень короткое время ( t p ~ 0,5c ) откройте кран К и снова его закройте. Температура газа сравняется с комнатной через время ~ tT .
Поэтому выждите некоторое время и после установления термодинамического равновесия снова зафиксируйте по U-образному манометру уровень жидкости в левом и правом коленах (колонки 6 и 7 табл. 2). Рассчитайте и запи-
шите в таблицу избыточное давление воздуха в баллоне |
h2 = hл – hп (колонка |
8). |
|
4. Пункт 3 повторите еще 9 раз при t p ~ 0,5c . |
|
5. Проведите по 3 измерения hл, hп, h1 и hл, hп, |
h2 для значений вре- |
мени t p 3, 5, 8 и 10 с. Время открытого крана контролируйте с помощью
секундомера, включая его одновременно с открытием крана К. Результаты запишите в табл.2.
6.После окончания работы обязательно откройте кран К во избежание выдавливания воды из манометра в результате колебаний атмосферного давления.
7.По полученным данным с помощью (10) вычислите и запишите в табл. 2 (колонка 9) значения показателя адиабаты .
8.Найдите и (методом среднего квадратичного) для каждого времени t p (колонки 10 и 11, табл. 2). Постройте график ( t p ).
9.Окончательный результат получается экстраполяцией зависимости от t p к значению t p = 0. Оцените (графически) ошибку окончательного
значения . Сделайте выводы по работе.
Контрольные вопросы
1.Какой процесс называется адиабатическим? Какая зависимость отражает этот процесс? Как его можно осуществить?
2.Почему при наполнении баллона воздух в нем нагревается?
3.Какая из теплоемкостей Сp или CV больше? Почему? Как связаны между собой удельные и молярные теплоемкости при постоянном давлении и постоянном объеме?
4.Каков физический смысл показателя адиабаты? Чему равна величина отношения Сp/CV для разных газов и для воздуха?
5.Опишите последовательность процессов, имеющих место в сосуде на разных этапах выполнения данной работы.
6.Какой процесс называется изохорным? Как связаны давление и температура в изохорном процессе?
7.Почему после того, как перекрывается связь баллона с атмосферой, давление в нем растет?
8. Охарактеризуйте метод Клемана-Дезорма, применяемый в работе для определения показателя адиабаты.
9. Каковы источники ошибок в данной работе?
