
- •Ответы на вопросы к экзамену «Атомная и ядерная физика»
- •Вопрос 1: Масса атомов, атомная единица массы, число Авогадро.
- •Вопрос 2: Строение атома.
- •Вопрос 3: Заряд ядра, масса ядра, размеры ядра, массовое число. Стабильные и радиоактивные ядра.
- •Вопрос 4: Элементарные частицы, состав ядра.
- •Вопрос 5: Дефект масс.
- •Вопрос 8: Явление радиоактивности. Единицы измерения активности.
- •Вопрос 15: Бета – распад ( Электронный)
- •Вопрос 16: Бета – распад ( позитронный)
- •Вопрос 17: к- захват.
- •Вопрос 18: Схемы радиоактивного распада, правила смещения.
- •Вопрос 19: Энергетический спектр альфа-, бета-, гамма-излучения. Идентификация радионуклидов.
- •Вопрос 20: Особенности бета-распада, энергетический спектр бета-частиц.
- •Вопрос 21: Гамма-излучение ядер.
- •Вопрос 26: Взаимодействие бета-излучения с веществом.
- •Вопрос 27: Взаимодействие гамма-излучения с веществом.
- •Вопрос 28: Радиоактивные семейства.
- •Вопрос 31: Определение активности радионуклида относительным методом.
- •Вопрос 37: Стронций-90(схема распада, графическая, период полураспада, причины высокой биологической подвижности)
- •Вопрос 38: Иод – 131( схема распада, период полураспада, причины высокой биологической подвижности)
- •Вопрос 39: Цезий 137( схема распада, период полураспада, причины высокой биологической подвижности)
- •Вопрос 40: Изотопы плутония , схема распада Плутония 239, период полураспада
- •Вопрос 41: Америций 241, схема распада, период полураспада.
Ответы на вопросы к экзамену «Атомная и ядерная физика»
Вопрос 1: Масса атомов, атомная единица массы, число Авогадро.
Атом – это наименьшая частица химического элемента (вещества) способная к самостоятельному существованию и являющаяся носителем его свойств. Каждому химическому элементу соответствует определенный род атомов, обозначаемый химическим символом этого элемента.
М а с с а. Важной характеристикой атома является его масса, которая определяется, в основном, массой его ядра. Масса m отражает инертные и гравитационные свойства частиц. Массой определяется также имеющийся в частице запас энергии. Согласно теории относительности полная энергия тела, движущегося со скоростью v, равна
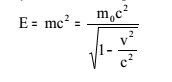
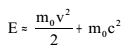
Полная
энергия тела складывается, таким образом,
из кинетической энергии и энергии покоя.
Тело с массой покоя m0
обладает запасом так называемой
собственной энергии Е0, связанной с
массой покоя соотношением Е0 = m0с2.
Масса
отдельного атома чрезвычайно мала и
измерить её с помощью аптечных
весов
невозможно, однако существуют
специальные экспериментальные методы
определения массы не только атома, но
и элементарных частиц. С помощью этих
методов было установлено что, например,
масса атома водорода составляет
1,67·10-27
кг, углерода – 19,94·10-27 кг. Выражать массу
в системных единицах неудобно, так как
массы их сравнимы (~10-28 кг), и с такими
цифрами оперировать очень трудно,
поэтому массу атома выражают в а.е.м.
(атомная единица массы). За 1 атомную
единицу массы (а.е.м.) До 1961 года в физике
за 1 а.е.м. принимали 1/16 массы изотопа
кислорода-16, т.е. 1,65976·10-27кг,
что в настоящее время считается
устаревшим.
В последнее время
используется в качестве единицы массы
1/12 массы изотопа углерода-12 (C-12);
применяется в атомной и ядерной физике
для выражения масс элементарных частиц,
атомов, молекул.
Связь а.е.м. с кг
определяется соотношением:
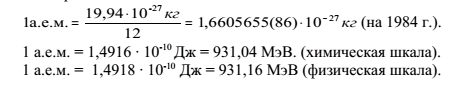
Таким
образом, 1 а.е.м. = 1,66·10-27
кг, что соответствует приблизительно
массе атома
водорода.
Точнее масса
атома водорода m
(Н-1) = 1,008 а.е.м. Для перевода значений
масс, выраженных в а.е.м., в единицу массы
СИ (кг) пользуются формулой:
m(кг)
= m(а.е.м.)
/ NA(моль-1),
где
NA
= 6,02·1023
– число Авогадро (показывает число
молекул в 1 кг-моле).
Чтобы выразить
значение атомной единицы массы в граммах,
надо взять обратную
величину от числа
Авагадро – NA:
![]()
Вопрос 2: Строение атома.
Согласно планетарной модели атома, он состоит из положительно заряженного тяжелого ядра (в нём сосредоточена почти вся масса атома (99,95 %)) и лёгкой оболочки, состоящей из отрицательно заряженных электронов, которые вращаются вокруг ядра. Размеры электронной оболочки существенно (в 10000-100000 раз) больше размеров ядра. Заряд электронов всегда равен положительному заряду ядра, вследствие чего атом является электрически нейтральным. На каждый движущийся электрон действует центростремительная сила.
На электрон действует не только сила притяжения ядра, но и силы отталкивания других электронов, которая ослабляет связь электрон-ядро. Этот эффект называют экранировкой. Чем дальше электронная оболочка от ядра, тем больше экранировка электронов.
У атома бесконечное число электронных оболочек. Небольшая доля оболочек заполнена полностью или частично, а на остальных оболочках электронов нет. Если на атом не действуют внешние силы, то силы электростатического притяжения между электронами и ядром заставляют электроны располагаться как можно ближе к ядру. Поэтому электронами сначала заполняются внутренние оболочки атома, а затем идет заполнение более удаленных
