
2 семестр (+ подготовка к экзу) / Приложения в помощь
.pdf
ПРИЛОЖЕНИЯ
Необходимые таблицы из краткого справочника физико-химических величин под редакцией А.А. Равделя и А.М. Пономаревой (год издания 2003, издание 10) в общем курсе физической химии
№ |
Страница |
Название таблицы |
Комментарии |
|
1 |
9 |
Единицы измерения физических величин |
|
|
2 |
10 |
Основные физические постоянные |
Необходимо помнить эту информацию |
|
4 |
11 |
Соотношения между единицами измерения и значения часто встре- |
без справочника |
|
чающихся величин |
|
|||
|
|
|
||
5 |
11 |
Способы выражения концентрации растворов |
Проще понять общие принципы о перево- |
|
дах концентраций |
||||
|
|
|
||
10 |
16 |
Плотность жидкостей в интервале 0-60°C |
|
|
11 |
18 |
Плотность растворов солей в воде |
|
|
12 |
19 |
Плотность растворов неорганических кислот и оснований в воде при |
|
|
20°C |
Используется для решения задач на ре- |
|||
|
|
|||
13 |
19 |
Плотности растворов органических соединений в воде при 20°C |
альные растворы |
|
20 |
26 |
Парциальные давления компонентов растворов |
|
|
21 |
28 |
Давления насыщенного пара воды, льда и переохлажденной воды при |
|
|
различной температуре |
|
|||
|
|
|
||
24 |
30 |
Температуры возгонки или кипения некоторых веществ при давлении |
Понадобится в разделе «Фазовое равнове- |
|
ниже атмосферного или равном ему |
сие» |
|||
|
|
|||
|
|
|
Приведены различные диаграммы, необ- |
|
28 |
38 |
Равновесия фаз в одно-, двух- и трехкомпонентных системах |
ходимые для решения задач по фазовым |
|
|
|
|
равновесиям |
|
|
|
|
Используется для расчета энтальпии про- |
|
30 |
45 |
Теплоты сгорания некоторых веществ в стандартных условиях |
цесса по второму следствию из закона |
|
|
|
|
Гесса |
|
36 |
51 |
Теплота смешения жидкостей при 25°C |
Может понадобиться в разделе «термоди- |
|
намика растворов» |
||||
|
|
|
||
41 |
63 |
Термодинамические константы равновесия важнейших газовых реак- |
Расчет химического равновесия |
|
ций в зависимости от температуры |
||||
|
|
|
||
44 |
72 |
Термодинамические свойства простых веществ, соединений и ионов |
Самая главная таблица в курсе физиче- |
|
в водном растворе и жидком аммиаке |
ской химии |
|||
|
|
|||
45 |
92 |
Величина Mn для вычисления стандартного изменения энергии Гиб- |
|
|
бса по методу Темкина и Шварцмана |
|
|||
|
|
|
||
49 |
97 |
Логарифмы констант равновесия реакций образования некоторых |
|
|
веществ |
Расчет химического равновесия |
|||
|
|
|||
|
|
Приведенная энергия Гиббса, приращение энтальпии и стандартная |
|
|
50 |
102 |
теплота образования (при T=0 К) некоторых веществ в состоянии |
|
|
|
|
идеального газа |
|
|
53 |
111 |
Вязкость воды в интервале 5-100°C |
Возможно, понадобится для расчетов по |
|
закону Стокса |
||||
|
|
|
||
61 |
119 |
Удельная электрическая проводимость предельно чистой воды, пере- |
|
|
гнанной в вакууме |
|
|||
|
|
|
||
65 |
123 |
Предельная молярная электрическая проводимость ионов в воде в |
|
|
интервале 0-100°C |
|
|||
|
|
|
||
66 |
125 |
Электрическая проводимость растворов слабых кислот и оснований |
|
|
при 25°C |
|
|||
|
|
|
||
67 |
126 |
Ионное произведение воды в интервале 0-100°C |
|
|
72 |
130 |
Средние ионные коэффициенты активности сильных электролитов в |
Используются для решения задач на рас- |
|
водных растворах при 25°C |
||||
|
|
творы электролитов |
||
73 |
133 |
Средние ионные коэффициенты активности сильных электролитов в |
||
|
||||
водных растворах в интервале 0-60°C |
|
|||
|
|
|
||
74 |
135 |
Соотношения между концентрацией, активностью и средним ионным |
|
|
коэффициентом активности электролитов разного типа |
|
|||
|
|
|
||
75 |
136 |
Константы диссоциации слабых кислот и оснований в водных рас- |
|
|
творах при 25°C |
|
|||
|
|
|
||
77 |
139 |
Константы нестойкости комплексных соединений |
|
|
78 |
142 |
Произведение растворимости при 25°C |
|
|
79 |
143 |
Стандартные электродные потенциалы в водных растворах при 25°C |
Используются для решения задач на галь- |
|
81 |
147 |
Температурные коэффициенты электродвижущей силы |
ванические элементы |
|
129 |
206 |
Кинетические диаметры атомов и молекул |
Используется для расчетов в теории ак- |
|
тивных столкновений |
||||
|
|
|
||
|
|
|
Имеются данные об энергиях активации и |
|
131 |
207 |
Кинетические параметры гомогенных реакций |
предэкспоненциальных множителях, не- |
|
|
|
|
обходимых для кинетических расчетов |
|
|
|
|
Приведены «фотохимические» парамет- |
|
145 |
216 |
Квантовый выход фотохимических реакций |
ры, которые могут быть полезны для ре- |
|
|
|
|
шения задач |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Физико-математическое приложение |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
Математическое приложение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Физическое приложение |
||||||||||||||||||||
•d Const 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
•d xy ydx xdy |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
•d |
x |
|
ydx xdy |
|
|
|
|
|
|
|
|
•1 кал 4,184 Дж |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
y |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
y |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0o C 273 К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
x |
n 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
• x |
n |
dx |
|
|
Const, n 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дж |
|
Н |
|
|||||||||||||||||
|
n |
|
|
|
|
|
|
• |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
1 атм 101325 Па |
|
|
|
|
3 |
|
|
2 |
760 мм рт. ст. Торр |
|||||||||||||||||||
• |
dx |
ln x Const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
м |
|
|
|
м |
|
|
|
|||||||||||
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нормальные условия |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
•1 бар 105 |
Па |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
• ln xdx x ln x x Const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
стандартные условия |
|
|
|
|
|
|
|
C T К |
|||||||||||||||||||||||||||||||||
|
b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
•T |
К |
t |
o |
C 273, t |
o |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F x f x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
• f x dx F b F a Area, |
|
•1 м |
3 |
|
10 |
3 |
л |
дм |
3 |
10 |
6 |
|
см |
3 |
|
|
|
|
|
||||||||||||||||||||||||||||
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b |
|
|
|
|
|
|
|
|
|
•1 Å 10 10 |
|
м |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
• |
|
f x dx lim |
|
f x dx |
|
|
|
|
|
|
•1 кг 1000 г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
a |
|
|
|
|
|
|
|
|
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
• y x1 |
x2 x3 |
... xi , y x1 x2 x3 ... xi |
|
нано н |
10 9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
аддитивность |
|
|
мультипликативность |
|
|
|
микро мк |
10 6 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
z |
dx |
z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
•z f x, y , |
dz |
dy |
|
|
|
|
милли м |
10 3 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
y |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x y |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0, с x y |
|
|
x |
|
|
|
• санти с 10 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
dy |
|
Const |
|
|
|
|
|
y |
|
|
|
|
|
|
деци д |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
• |
dx |
|
0, с x |
|
|
|
|
|
|
кило к |
10 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
0, y f x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мега |
|
|
|
|
106 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
М |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
•ln x 2,303lg x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
• моль M , |
моль m, |
|
|
экв |
|
|
|
|
|
|||||||||||||||||||||||||||||
•ex |
exp x |
e 2,718 |
|
|
|
|
|
|
|
|
N |
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
loga a 1 |
|
|
|
|
|
|
|
|
л |
|
|
|
|
|
|
|
|
кг |
|
|
|
|
|
|
л |
|
|
|
|
|
|
|||
•loga b c, ac |
b, |
|
|
|
|
|
|
|
молярность |
|
|
моляльность |
|
|
нормальность |
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
•Кл А с |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
•loga b loga c loga bc |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
• Дж В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
•loga b loga |
|
|
|
|
b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
c loga |
|
|
|
|
|
|
|
Кл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
|
|
|
|
|
|
|
•См Ом |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
•loga bc c loga b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
•Ф |
Кл |
2 |
|
Дж |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
•e x |
|
1 x, ln 1 x x при x |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
N |
|
|
6,02 1023 |
|
моль 1 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
y kx b , k tg tg y |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
число Авогадро |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
уравнение прямой |
|
|
|
|
|
x |
|
|
|
kБ |
1,38 10 23 |
|
Дж К |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
угловой коэффициент |
|
|
|
|
|
|
|
|
|
|
постоянная Больцмана |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
• Метод интерполяции : |
|
|
|
|
|
|
e 1,6 10 |
19 |
|
Кл |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
AC BC , y* y y |
x * x1 |
|
|
|
элементарный заряд |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
ABC ADE, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дж |
|
|
|
|
|
л атм |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
x |
|
R kБ N А |
8,314 |
|
0,082 |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
AE |
DE |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
моль К |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
моль К |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
универсальная газовая постоянная |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
• F eN A 96485 Кл моль |
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
число Фарадея |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h 6,6310 34 Дж с |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
постоянная Планка |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8,85 10 12 |
|
Ф |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
м |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
диэлектрическая |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
проницаемость вакуума |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
с |
310 |
|
м с |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
скорость света |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
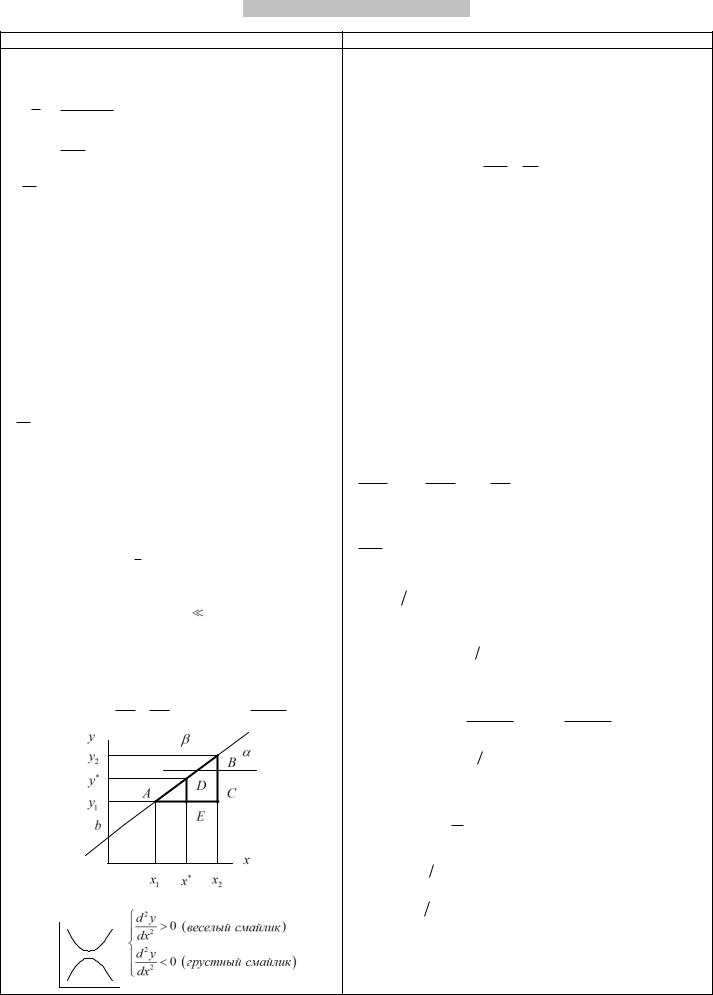
Вид графиков по знаку второй производной: |
|
|
|
|
|
в вакууме |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
y |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
g 9,81 м с |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ускорение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
свободного падения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

В приведенных ниже памятках находятся исходные дифференциальные и конечные интегральные расчетные формы уравнений. Процессы получения интегральных форм, а также обозначения изучите самостоятельно по курсу лекций!
Памятка с необходимыми формулами в разделе: «Законы термодинамики»
1) Уравнение Клапейрона-Менделеева (а также частные законы):
pV Const, при T Const |
|
|||||
|
|
|
|
закон Бойля-Мариотта |
|
|
|
|
p |
|
|
|
|
|
|
|
Const, при V Const |
|
||
|
T |
pV nRT |
||||
|
|
закон Шарля |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
Const, при p Const |
|
|
|
|
|
|
|
|||
|
|
T |
|
|
|
|
|
|
|
закон Гей-Люссака |
|
|
|
|
|
|
|
|
||
2) Расчет изопроцессов:
Q dU W |
|
|
||||||||
Q dH Vdp |
|
|
||||||||
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
W pdV |
|
|
|
|||||||
dU CV dT |
|
|
|
|||||||
|
|
|
||||||||
dH Cp dT |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
dS |
C |
|
dT |
R |
|
|
|
|||
|
V |
|
|
|
|
dV |
|
|||
|
T |
V |
|
|||||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
dS |
|
Cp |
|
dT |
|
R |
|
|
|
|
|
|
|
|
|
|
dp |
|
|||
|
T |
|
|
p |
|
|||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
dA pdV SdT |
|
|
||||||||
dG SdT Vdp |
|
|
||||||||
|
|
|
|
|
|
|
U 0, H 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
p1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q W nRT ln |
|
nRT ln |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
T Const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
p2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
dT 0 |
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
pV Const |
|
|
S nR ln |
|
|
nR ln |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
V |
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
изотермический |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
p2 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
G A nRT ln |
|
|
|
|
nRT ln |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
V1 |
|
|
|
p1 |
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
W 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V Const |
|
Q U nCV T2 T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
dV 0 |
|
|
|
|
Q V p2 p1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Const |
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
T |
|
|
|
S nCV |
ln |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
изохорный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
SdT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q H nCp T2 T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
W p V2 V1 nR T2 T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
Q W |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
p Const |
|
U |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
dp 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
S |
nC |
p |
ln |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
V |
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
Const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
T |
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
изобарный |
|
G SdT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
U W nCV T2 T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
nCp T2 T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pV Сonst |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
Q 0 |
|
TV 1 Сonst |
|
|
Cp |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
адиабатический |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CV |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
T |
p1 Сonst |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
уравнение Пуассона |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
фп H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
фп S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
Tфп |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
p,T Const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
фазовый переход |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
фпG 0 фп A n г RT |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
mixU 0, mix H 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V i |
|
|
|
|
ni |
|
Vi |
|
|
|
||||||
T Const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
xi |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ni |
Vi |
|
|
|
||||||||||||||||||
|
dT 0 |
|
|
|
S |
|
S |
|
R |
|
n ln |
|
|
|
|
|
|
|
|
|
S R |
n ln x |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
mix |
|
|
|
|
i |
|
|
|
|
|
i |
|
|
|
|
V |
|
|
|
|
|
|
mix |
|
i i |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
||||
изотермическое |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Vi |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
смешение |
|
mixG Gi |
|
RT ni |
|
|
|
|
|
|
RT ni |
|
|
|
|
|
||||||||||||||||||||||||||
идеальных газов |
|
|
|
ln |
|
|
|
|
|
|
ln xi T mix S |
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
V |
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
||||
3) |
Изохорная и изобарная теплоемкость идеальных газов. Уравнение Майера: |
|
|||
|
|
одноатомные (Ar, Ne, He) |
двухатомные (H2, O2, N2) и |
|
многоатомные нелинейные |
|
|
многоатомные линейные мо- |
|
(NH3, H2O, CH4) |
|
|
|
(i=3) |
|
||
|
|
лекулы (CO2) (i=3+2=5) |
|
(i=3+3=6) |
|
|
|
|
|
||
|
CV 0, 5iR |
1,5R |
2,5R |
|
3R |
|
|
|
|
|
|
Cp CV R 0,5i 1 R |
2,5R |
3,5R |
|
4R |
|
|
|
|
|
|
|
4) |
Температурная зависимость энтальпии, энтропии, энергии Гиббса и Гельмгольца: |
|
|||
|
|
|
|
|
|
|
|
|
|
Cp Const |
|
T1 |
|
|
|
|
|
|
|
|
|
|
|||
|
H |
|
|
|
|
|
H nCp T2 |
|
|
|
|
|
|
|
|
|
|
||||||||
Cp |
0, с T H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
Cp f T |
|
|
|
|
|
b |
|
2 |
2 |
|
|
c |
3 |
3 |
||||||
|
T p |
|
|
|
|
|
|
H n a T2 |
T1 |
|
T2 |
T1 |
|
|
|
|
T2 |
T1 |
|||||||
|
|
|
|
|
2 |
3 |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Cp Const |
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
S nCp ln |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
Cp |
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
0, с T S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
T |
|
p |
|
T |
|
|
|
C f T |
|
T |
b T2 |
T1 |
c |
T2 |
T1 |
|
||||||||
|
|
|
|
|
|
|
|
S n a ln |
2 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
2 |
2 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
c T2 1 T1 1
c2 T2 2 T1 2
Если спрашивают: «для какого из веществ энтальпия/энтропия изменится в большей/меньшей степени при изменении температуры от T1 до T2» достаточно сравнить величины изобарных теплоемкостей веществ в заданных агрегатных состояниях.
|
A |
|
G |
|
|
|
|
|
S , |
|
S |
|
|||||
|
T V |
|
T p |
|
|
Если спрашивают: «для какого из веществ энергия Гиббса (Гельмгольца) изменится в большей/меньшей степени при изменении температуры от T1 до T2 при изобарных (изохорных) условиях» достаточно сравнить величины абсолютных эн-
тропий веществ в заданных агрегатных состояниях.
|
|
Tпл |
|
|
|
|
|
|
|
|
|
Tкип |
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
H Cpтв dT пл HTпл |
|
Cpж dT исп HTкип |
Cpг dT |
|
|
|
|
||||||||||||||||||||
|
|
T1 |
|
|
|
|
|
II |
|
Tпл |
|
|
|
|
|
IV |
|
Tкип |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
III |
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S o S o |
|
|
|
|
|
p |
dT |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
T |
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S298o и Cp берутся при агрегатном |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
состоянии вещества при T |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
S |
|
S |
|
|
|
T |
Cp |
|
dT |
|
p R |
dp |
|
|
|
|
|
|
|
|
|
|
|
||||
при нестандартных |
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
условиях |
T , p |
|
298 |
|
298 |
T |
|
|
|
|
po p |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в широком |
|
o |
|
|
o |
|
Tпл |
Cpтв |
|
|
|
|
|
|
|
Tкип Cpж |
|
|
|
|
T |
Cpг |
|||||
S |
|
S |
|
|
|
|
|
|
dT |
|
S |
|
|
|
|
dT |
|
S |
|
|
|
dT |
||||||
T |
298 |
|
|
|
|
|
|
|
исп |
|
|
|||||||||||||||||
|
диапазоне температур |
|
|
|
|
T |
|
|
|
|
|
пл Tпл |
|
T |
|
Tкип |
|
T |
||||||||||
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
T |
|
|
|
|
T |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II |
|
пл |
|
|
IV |
|
кип |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
III |
|
|
|
|
|
V |
|||
5) Связь между изобарным и изохорным тепловым эффектом и изменением энергии Гиббса и Гельмгольца:
|
|
|
|
|
0, |
H o U o |
|||
|
|
|
|
|
|
r |
T |
r T |
|
r HTo rUTo г RT г = г,i г ,i |
r HTo rUTo |
||||||||
0, |
|||||||||
Q |
|
Q |
продукты |
реагенты |
|
|
o |
o |
|
|
p |
V |
|
|
0, |
r HT |
rUT |
||
|
|
|
|
|
0, Go |
Ao |
|||
|
|
|
|
|
|
r |
T |
r T |
|
r GTo r ATo г RT г = г,i г ,i |
r GTo |
r ATo |
|||||||
0, |
|||||||||
|
|
|
продукты |
реагенты |
|
|
o |
o |
|
|
|
|
|
|
0, |
r GT |
r AT |
||
Для того чтобы оценить разницу между ними достаточно рассчитать изменение стехиометрического коэффициента для
газообразных веществ!

6) Графический поиск составляющих энтропии по графику Cp/T=f(T):
Графический поиск заключается в том, что каждый кусок графика является определенным интегралом:
T2 C
Area p dT
T1 T
7) Стандартные тепловые эффекты и связи между ними:
Стандартная теплота образования – тепловой эффект реакции образования 1 моль данного вещества из простых веществ, находящихся в стандартном состоянии.
Ca |
C |
1,5O |
CaCO |
, |
f |
H o |
, |
|
f |
H o |
0 |
тв |
графит |
2 г |
3 тв |
|
298 |
|
|
298 |
|
для простого вещества
Стандартная теплота сгорания – тепловой эффект реакции сгорания 1 моль данного вещества до «высших оксидов», когда реагенты и продукты находятся в стандартном состоянии.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C CO2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2 H6 г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
o |
|
|
|
|
|
H H2O ж |
|
|
|
|
|||||
|
|
3,5O2 г 2CO2 г 3H2O ж , c H298 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S SO2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N N2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
во что окисляются элементы, |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
входящие в состав вещества |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
c H Ho |
|
f |
H Ho |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
2 г |
|
|
|
|
|
2 |
|
ж |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c HC |
графит |
f HCO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c H So |
ромб |
f |
H SOo |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
связь теплот образования и сгорания |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
8) Закон Гесса: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r H298o |
i f H298,o |
i i f H298,o |
i i c H298,o |
i i c H298,o |
i |
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
продукты |
|
|
|
|
|
реагенты |
|
|
|
|
|
реагенты |
|
|
|
|
продукты |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
C2 H2 г |
|
2H2 г |
|
C2 H6 г |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
r H298 |
f |
H298,C2H |
|
f H298,C2H2 г |
|
2 f |
H298,H |
2 г |
|
|
|
H o |
|
|
|
2 H o |
|
|
|
|
|
|
||||||||||||
|
|
|
|
c |
|
298,C2H2 |
|
г |
|
|
c 298,H2 |
г |
|
c H298,C2H |
|
|||||||||||||||||||
o |
|
o |
|
|
o |
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
|
|
|
o |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
6 г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
o |
|
|
|
|
6 г |
|||
|
|
|
|
|
первое следствие |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
f H298, H2O ж |
|
|
|
|
|||||
второе следствие
9) Уравнение Кирхгоффа: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
0, с T |
H o |
|
|
|||||
|
|
|
|
|
|
|
d r H |
o |
|
|
|
|
|
|
r |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
r Cp |
0, с T r H o |
|
|||||||||
|
|
|
|
|
|
|
dT |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
o |
f |
T |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
0, r |
|
|
|
|||||
|
r C p Const |
o |
r H |
o |
r Cp T |
298 |
|
|
|
|
|
|
|
|
|
|||||
r HT |
298 |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r Cp f T |
|
|
o |
r H |
o |
a T 298 |
b |
T |
2 |
298 |
2 |
|
|||||||
|
r HT |
298 |
|
|
|
|
||||||||||||||
x i xi i xi |
x a,b,c,c |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
||
|
продукты реагенты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c T 3 2983 c T 1 298 1 3
Для анализа влияния температуры на тепловой эффект необходимо рассчитать изменение теплоемкости, как это делается по закону Гесса. При анализе графических зависимостей принимайте во внимание знак изменения теплоемкости реакции, и как это изменение меняется с температурой.

10) Расчетные уравнения для химических реакций с учетом температурных зависимостей:
базовые уравнения:
|
|
|
|
|
|
|
|
|
|
r S298o |
i S298,o |
i i S298,o |
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
продукты |
|
|
|
реагенты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0, с T |
S o |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
d |
S o |
|
r Cp |
|
|
|
|
|
|
|
|
r |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
r |
|
|
|
|
|
|
|
|
|
|
0, с T r S o |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
dT |
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r S |
o |
f |
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
rC p Const |
o |
|
o |
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
r ST |
r S298 |
r Cp ln |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
c |
T |
|
|
|
|
|
|
c |
T |
|
|
|
|
|||
|
|
rC p f T |
o |
|
o |
|
|
|
|
|
|
|
|
|
b T 298 |
2 |
|
|
|
2 |
2 |
|
2 |
|||||||||||||||||||||
|
r ST |
r S298 |
a ln |
|
|
|
2 |
|
|
298 |
|
2 |
|
|
298 |
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
r G298o |
i f G298,o |
i i f G298,o |
i |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
продукты |
|
|
|
|
|
реагенты |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
r S o 0 |
|
|
|
d r Go |
|
|
|
|
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0, с T r G |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
dT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
d r Go |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
o |
|
r S o 0 |
|
|
|
d r Go |
|
|
|
|
|
|
|
|
|
|
o |
|
|
|
|
|
|
o |
|
|
|
o |
|
|
o |
|
|
||||||||
|
|
|
r S |
|
|
|
|
|
dT |
|
|
0, с T r G |
|
|
r GT |
r G298 |
r ST dT |
|
||||||||||||||||||||||||||
|
|
dT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
298 |
|
|
|
||||||
|
|
|
|
|
|
r S o 0 |
|
|
|
d r Go |
|
|
|
|
|
o |
|
f T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0, r G |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
dT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
o |
|
|
|
|
o |
|
|
|
|
|
|
|
|
r |
Go |
|
H o |
T |
S o |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
г |
|
|
|
|
T |
|
|
r |
|
T |
|
|
r |
|
T |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
r GT r AT |
|
RT |
Ao |
U o |
T S o |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r |
T |
|
|
r |
|
T |
|
|
r |
|
T |
|
|
|
|
|
|
|
|
|
||
метод Темкина-Шварцмана для расчета энергии Гиббса:
o |
o |
o |
T aM0 |
bM1 cM |
|
|
r GT |
r H298 |
T r S298 |
2 c M 2 |
расчет изменения энергии Гиббса через константу равновесия (изотерму Вант-Гоффа):
|
|
Go RT ln K |
a |
|
|
r T |
|
11) Необходимые таблицы из справочника А.А. Равделя: |
|
||
№ |
Страница |
Название таблицы |
|
24 |
30 |
Температуры возгонки или кипения некоторых веществ при давлении ниже атмосферного или равном |
|
ему |
|
||
|
|
|
|
30 |
45 |
Теплоты сгорания некоторых веществ в стандартных условиях |
|
44 |
72 |
Термодинамические свойства простых веществ, соединений и ионов в водном растворе и жидком ам- |
|
миаке |
|
||
|
|
|
|
45 |
92 |
Величина Mn для вычисления стандартного изменения энергии Гиббса по методу Темкина и Шварцмана |
|

Памятка с необходимыми формулами в разделе: «Химическое и фазовое равновесие»
1) Полезные балансовые соотношения и уравнение материального баланса:
|
|
|
n |
|
n |
|
n |
|
1 |
|
|
|
|
|
|
||
|
|
|
A |
A |
A,0 |
A |
|
|
|
|
|||||||
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A A |
B B |
|
A,0 |
|
|
|
|
|
|
|
|
, n n |
|
|
|
||
|
|
|
|
B |
|
|
|
|
|
|
i |
||||||
|
n |
|
|
|
|
|
|
|
|
|
|
i |
i,0 |
i |
|
||
|
n |
|
|
n |
|
|
|
|
|
|
для продуктов |
||||||
|
|
|
|
|
A |
|
|
|
|
|
для реагентов |
||||||
|
B |
|
B,0 |
|
|
|
A,0 |
|
|
|
|||||||
2) Способы выражения констант равновесия и связь между ними: |
|
|
|
|
|
|
|||||||||||
|
|
A A B B |
|
C C D D |
|
|
|
|
|
||||||||
K |
pCC pDD |
, K |
CCC CDD |
, K |
xCC xDD |
, K |
nCC nDD |
, K |
|
p A p B |
C A C B |
x A x B |
n A n B |
|
|||||
p |
|
C |
|
x |
|
n |
|
|
a |
|
A B |
|
A B |
|
A B |
|
A B |
|
|
K p Ka po г K po г KC RT г Kx p г
|
aCC aDD |
, K |
|||
aAA aBB |
|||||
|
|
f |
|||
|
|
|
|
||
|
|
|
p |
г |
|
Kn |
|
|
|
||
|
|
||||
|
|
|
|
|
|
|
|
ni |
|||
fC C fD D f A A fB B
3) Анализ влияния общего давления и добавок инертного газа на различные техно-химические параметры:
Параметр |
Общее давление |
Добавки инертных газов |
|||||
Уравнение |
|
ni |
г |
ni |
ninert |
г |
|
для анализа |
Kn K p |
|
|
Kn K p |
|
|
|
|
|
|
|||||
|
p |
|
|
p |
|
||
|
|
|
|
|
|||
Δνг<0 |
↑Kn, xпродукт, α, реакция смещена вправо |
↓Kn, xпродукт, α, реакция смещена влево |
|||||
Δνг>0 |
↓Kn, xпродукт, α, реакция смещена влево |
↑Kn, xпродукт, α, реакция смещена вправо |
|||||
Δνг=0 |
нет влияния общего давления |
|
нет влияния добавок инертного газа |
||||
4) Изотерма Вант-Гоффа:
|
|
|
ai i |
|
|
|
продукты |
r G RT ln Ka |
RT ln |
|
|
i |
|||
rG |
o |
|
ai |
|
реагенты |
||
|
|
||
in
|
|
ai i |
|
|
|
|
|
продукты |
|
|
|
RT ln |
|
|
ln Ka |
|
|
i |
|||||
|
|
ai |
|
|
|
|
|
реагенты in |
|
|
|
a i
продуктыi
a i
i
реагенты in
Ka , r G 0, реакция смещена вправо |
|
|
, r G 0, реакция смещена влево |
Ka |
|
|
, r G 0, равновесие |
Ka |
|
5) Изобара Вант-Гоффа. Анализ влияния температуры на различные техно-химические параметры:
|
|
|
|
|
|
|
|
|
0, |
d ln Ka |
0, с T K |
, , x |
|
, реакция смещена вправо |
||
|
|
|
|
|
|
|
|
|
|
|
продукт |
|||||
|
|
|
|
|
|
|
|
|
|
dT |
|
a |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ln Ka |
|
r H o |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
o |
|
|
|
d ln Ka |
|
|
|
|
|||||
|
T |
|
|
|
2 |
r H |
|
0, |
|
|
|
0, с T Ka |
, , xпродукт , реакция смещена влево |
|||
|
|
|
|
|
||||||||||||
|
p |
|
RT |
|
|
|
|
|
|
dT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d ln K |
a |
0, Ka f T |
|
|
|
|
|
|
|
|
|
|
|
0, |
|
|
|
|||||
|
|
|
|
|
|
|
|
dT |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6) Расчет среднего и истинного теплового эффекта химической реакции:
Аналитический расчет |
Графический расчет |
|
|
|
|
|
|
|
|
|
|
|
|
Средний тепловой эффект реакции |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
График в координатах lnKa=f(1/T) |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ln K |
|
|
|
H o 1 |
Const |
|
H o tg R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
r |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
T |
|
r |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
K |
a 2 |
|
|
H o |
1 |
|
1 |
|
r H o |
RT T |
K |
a 2 |
|
lnKa |
|
|
|
|
|
|||
ln |
|
r |
|
|
|
|
|
T2 |
1 2 ln |
|
|
|
|
|
|
|
|
|
|||||
|
Ka1 |
|
R |
T2 |
|
T1 |
|
T1 |
Ka1 |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
Истинный тепловой эффект реакции |
|
|
||
|
|
|
|
|
|
|
|
|
|
График в координатах |
График в координатах |
|
|
|
|
|
|
|
|
|
|
|
Ka=f(T) |
|
lnKa=f(T) |
|
|
d ln K |
a |
|
RT |
2 |
o |
r Cp,T |
r H o RT 2 tg |
|
H o RT 2tg |
|
|
|
|
|
|
|
|
|
r |
|
|||
|
|
|
dT |
|
r HT |
rUTo |
Ka |
lnKa |
|
|||
|
2,303 |
|
|
|
|
|
|
|
|
Ka |
|
|
lg Ka ln Ka |
|
|
|
|
|
|
r STo |
|
|
|||
|
|
|
RT |
|
o |
|
|
|
||||
|
|
|
r GT |
|
Ao |
|
|
|
||||
|
|
|
|
|
|
|
|
|
r T |
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
12) Правило фаз Гиббса: |
f K n |
|
|
|
|
|
||||||
13) |
Различные формы уравнения Клапейрона-Клаузиуса и анализ: |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
фп S |
|
фп H |
|
dp |
|
|
|
||
|
|
|
|
||
dT |
V |
T V |
|||
|
|
фп |
|
фп |
2 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
испарение и возгонка : |
|
H 0, V 0, |
dp |
0, с T p |
|
|
|
|
|
|
||||||||
фп |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
фп |
dT |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
А ж |
тв , плV Vж Vтв |
1 |
|
|
1 |
|
0, |
dp |
|
0, с T p |
||||||
|
|
ж |
|
тв |
|
dT |
|
|||||||||||
плавление : пл H 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
1 |
|
|
1 |
|
|
dp |
|
|
|||
|
|
Б ж |
тв , плV Vж Vтв |
|
|
|
0, |
|
0, с T p |
|||||||||
|
|
|
|
|
|
|
dT |
|
||||||||||
|
|
|
|
|
|
|
|
ж |
|
|
тв |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
dp |
|
фп H |
p |
|
d ln p |
|
фп H |
|
dT |
RT 2 |
dT |
RT 2 |
|||||
|
|
|
|
упрощения, которые применимы для процессов испарения и возгонки
dp |
|
p |
|
пл H |
p |
пл H |
T |
dT |
T |
T V |
T V |
||||
|
|
|
|
пл |
|
пл |
|
упрощения, которые применимы для процесса плавления |
|||||||
14) Методика определения координат тройной точки: |
|
||||||
ln p |
|
A |
B |
|
|
|
|
|
|
|
|
|
|||
|
тв |
|
T |
T3 |
p3 |
||
|
|
|
условие тройной точки |
подстановка T3 |
|||
ln p |
|
A B |
ln pтв ln pж |
в любую зависимость |
|||
|
|
|
|
|
|
||
|
ж |
|
|
|
|
|
|
|
|
T |
|
|
|||
|
|
|
|
|
|
||
15) Правило Трутона:
Мольные энтропии испарения различных неполярных, неассоциированных в паровой фазе жидкостей (бензол и его гомологи, сероуглерод, тетрахлорметан, хлорид титана (IV), нафталин) при температуре нормального кипения одинаковы:
|
|
S |
|
исп Hm 88 - 92 |
Дж |
|
исп |
m |
моль К |
||||
|
|
Tнк |
||||
|
|
|
|
16) Расчет среднего и истинного теплового эффекта процессов фазовых превращений:
|
|
|
|
Аналитический расчет |
|
|
|
|
|
Графический расчет |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Процессы испарения и возгонки |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Средний тепловой эффект |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
График в координатах lnp=f(1/T) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ln p |
фп H |
|
1 |
Const |
|
|
H tg R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
T |
фп |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
p |
|
фп H 1 |
|
1 |
|
фп H |
RT T |
p |
|
lnp |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
ln |
2 |
|
|
|
|
|
|
1 2 |
ln |
2 |
|
|
|
|
|
|
|
|
|
|
|||
p1 |
|
|
|
|
|
p1 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
R |
|
T2 |
|
T1 |
|
T2 T1 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Истинный тепловой эффект |
|
|
|
|
|
|
|
|
|
|
|
|
График в координатах |
График в координатах |
|||||
|
|
|
|
|
|
p=f(T) |
|
|
|
lnp=f(T) |
||
|
|
|
|
|
|
фп HT |
RT 2 |
tg |
H RT 2tg |
|||
|
|
|
|
|
|
фпCp,T |
p |
|
|
фп |
T |
|
|
|
|
|
|
|
|
|
|
|
|
||
lg p ln p |
d ln p |
|
2 |
|
|
фпUT |
|
|
lnp |
|
|
|
|
H |
|
|
|
|
|
|
|
||||
2,303 |
|
RT |
|
|
|
p |
|
|
|
|
|
|
|
dT |
|
|
фп |
T |
|
|
|
|
|
|
|
|
|
|
|
|
фп ST |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Процессы плавления |
|
|
|
|
|
|
dp |
|
пл H |
пл H T плV |
dp |
|
dT |
T плV |
dT |
|||
|
|
|
dp |
|
пл H |
|
tg пл H T плVtg |
||||||
|
dT |
T плV |
|||||||||
|
|
|
|
|
|
||||||
ln p |
|
|
A |
B |
|
|
|
||||
|
|
T |
|
|
возг H BR tg R |
||||||
|
|
тв |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
ln p |
|
|
A |
B |
|
исп H B R tg R |
|||||
|
|
|
|
||||||||
|
|
ж |
|
|
|
T |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
пл H возг H исп H
lnp
17) Необходимые таблицы из справочника А.А. Равделя:
№ |
Страница |
Название таблицы |
|
24 |
30 |
Температуры возгонки или кипения некоторых веществ при давлении ниже атмосферного или равном |
|
ему |
|||
|
|
||
28 |
38 |
Равновесия фаз в одно-, двух- и трехкомпонентных системах |
|
41 |
63 |
Термодинамические константы равновесия важнейших газовых реакций в зависимости от температуры |
|
44 |
72 |
Термодинамические свойства простых веществ, соединений и ионов в водном растворе и жидком ам- |
|
миаке |
|||
|
|
||
45 |
92 |
Величина Mn для вычисления стандартного изменения энергии Гиббса по методу Темкина и Шварцмана |
|
49 |
97 |
Логарифмы констант равновесия реакций образования некоторых веществ |
|
50 |
102 |
Приведенная энергия Гиббса, приращение энтальпии и стандартная теплота образования (при T=0 К) |
|
некоторых веществ в состоянии идеального газа |
|||
|
|

Памятка с необходимыми формулами в разделе: «Термодинамика растворов»
Мы будем обозначать компоненты в соответствии с системой «растворитель- растворенное вещество»
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
1) Способы выражения концентрации раствора формулы: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
x2 |
|
n2 |
|
|
2 x2 |
|
|
g2 |
|
|
|
|
m |
1000n2 |
|
1000g2 |
|
|
|
|
C |
n |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
n2 |
|
|
|
|
g2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
n1 |
|
|
g1 |
|
|
|
g1 |
M2 g1 |
|
|
V |
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
x2 |
|
n2 |
|
|
- |
|
|
|
|
|
|
|
2 |
M 2 |
|
|
|
|
|
|
|
mM1 |
|
|
|
|
|
|
|
|
|
CM1 |
|
|
|
|
|
||||||||||||
|
|
n n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C M |
|
|
M |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 M 2 |
1 M1 |
|
|
|
|
mM1 1000 |
|
1 |
2 |
||||||||||||||||||||||||||||||
|
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
2 x2 |
|
|
g2 |
|
|
|
|
x2 M 2 |
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
mM 2 |
|
|
|
|
|
|
|
|
|
CM 2 |
|
|
|
|
||||||||||||
|
|
g1 g2 |
|
|
x1M1 x2 M 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
mM2 1000 |
|
|
|
|
|
|
V |
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
m |
1000n2 |
|
|
1000g2 |
|
|
|
|
1000x2 |
|
|
|
|
|
1000x2 |
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
1000C |
|
|
|
||||||||||||||||
|
|
g1 |
|
|
M2 g1 |
|
|
|
|
x1M1 |
|
|
|
|
|
x1M 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CM2 |
|
|||||||||||||||||
|
|
C |
n |
|
|
|
x2 |
|
|
|
|
2 |
|
|
|
|
|
|
|
1000m |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
x1M1 x2 M 2 |
|
|
|
|
M 2 |
|
|
|
|
|
|
|
mM2 1000 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
2) Свойства растворов: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
парциальная молярная величина (свойство) (ПМВ или ПМС): |
|
|
L |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
L |
|
|
|
; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ni p,T ,n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
j i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
относительная парциальная молярная величина (свойство) (ОПМВ или ОПМС): Li Li Loi ;
функция смешения: mix L n1 L1 n2 L2 .
3) |
|
Первое уравнение Гиббса-Дюгема: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L1n1 L2n2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
4) Функции смешения и различные законы для растворов: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
Идеальные |
|
|
|
|
|
|
|
|
Предельно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реальные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разбавленные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
mixV 0 |
|
|
|
|
o |
o |
|
|
|
|
|
|
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ai |
i xi |
|
|
|
p po a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
V n1V1 |
n2V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
i |
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
o |
|
o |
|
|
|
|
|
p1 p1 x1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
RT ln a |
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
mix H 0 |
H n1H1 |
n2 H2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
p2 K Г x2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
mixG RT n1 ln x1 n2 ln x2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V n V |
n V |
V n V n V |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
закон Генри |
|
|
|
|
|
|
|
|
|
|
|
|
mix |
|
|
1 |
|
|
|
|
1 |
|
|
2 |
|
|
2 |
|
|
|
|
|
|
|
1 |
|
1 |
|
|
2 |
2 |
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
1 |
|
|
2 |
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
S o |
R ln x |
|
|
|
|
R ln x |
|
|
|
|
|
|
|
|
|
V1o |
|
|
|
|
|
|
|
|
|
|
|
|
mix H n1 H |
1 n2 H |
H n1H |
n2 H |
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
S |
i |
|
S |
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
i |
|
|
i |
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
mixG n1 1 n2 2 |
|
RT n1 ln a1 |
n2 ln a2 |
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
R n ln x n ln x |
|
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S1 |
|
R ln x1 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
S n S n S |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
S1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
mix |
|
|
|
1 |
1 |
2 |
|
|
2 |
o |
|
1 |
1 |
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S n |
|
|
n |
|
|
|
|
|
|
G |
|
H T |
S |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
S |
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
RT ln x1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
косвенный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
pi pi xi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
mix |
1 |
|
1 |
|
2 2 |
|
|
|
|
|
путь |
|
|
|
|
|
mix |
|
|
|
|
|
|
mix |
|
|
|
|
|
mix |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
GE |
RT n ln |
|
n ln |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
закон Рауля |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
mix |
1 |
2 |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
5) Коллигативные свойства растворов неэлектролитов: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
po |
|
p |
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
g |
2 |
M |
1 |
po |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
Понижение давления насыщенного пара над раствором: |
|
|
1 |
|
|
|
1 |
|
|
1 x |
|
|
M |
|
|
|
|
|
|
|
|
; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
po |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
po |
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
p g |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Повышение температуры кипения раствора: |
|
T |
|
R |
Tкипo |
,1 2 M1 |
m Em M |
|
|
|
|
|
g 1000E |
|
; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кип |
|
|
1000 исп H1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
g1 кипT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E эбуллиоскопическая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
постоянная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
Понижение температуры отвердевания (замерзания): |
|
|
|
T |
|
R |
Tплo ,1 2 M1 |
|
m Km |
M |
g 1000K |
; |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
отв |
|
|
|
|
|
1000 пл H1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
g1 отвT |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
К криоскопическая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
постоянная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Осмотическое давление: CRT M2 |
|
|
g2 RT |
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
