
Лабораторная работа м-15 Определение отношения удельной теплоемкости газов при постоянном давлении (Ср) к теплоемкости при постоянном объеме (Cv) способом Клемана и Дезорма Теоретическое содержание
Теплоемкостью тела С называется отношение
количества тепла
![]() ,
(отученного системой, к приращению ее
температуры dT)
,
(отученного системой, к приращению ее
температуры dT)
![]() (1)
(1)
Согласно первому закону термодинамики
![]() (2)
(2)
где
![]() Q
- количество тепла, полученное системой.
Q
- количество тепла, полученное системой.
![]() U
- приращение ее внутренней энергии,
U
- приращение ее внутренней энергии,
![]() - величина работы производимой
системой.
- величина работы производимой
системой.
Величина работы производимой системой равна:
![]() (3)
(3)
где р - давление, а V объем системы (газа);
Теплоемкость можно представить как
![]() (4)
(4)
Если газ нагревается при постоянном объеме V, внешняя работа. производимая газом, равна нулю и все, сообщаемое ему извне тепло идет целиком на увеличение его внутренней энергии dU. Обозначим теплоемкость газа при постоянном объеме С, она равна по формуле (4)
![]() (5)
(5)
При нагревании газа при постоянном давлении Р газ расширяется, сообщаемое ему извне тепло идет не только на увеличение запаса его внутренней энергии dU. но и на совершение работы против сил постоянного внешнего давления. Теплоемкость при этом СP больше теплоемкости C, на эту работу .
![]() (6)
(6)
Удельной теплоемкостью называют величину, численно равную количеству тепла, получаемого единицей массы газа, при нагреве его на 1 К. Непосредственное определение теплоемкости довольно затруднено, особенно Ср. При рассмотрении многих процессов входит отношение этих теплоемкостей, которое мы определили.
![]() (7)
(7)
Согласно молекулярно - кинетической теории отношение (7) зависит от числа степеней свободы молекул газа i:
![]() (8)
(8)
Для определения k Клеманом и Дезормом был предложен в 1819 году очень простой метод, основанный на адиабатическом расширении или сжатии газа. Адиабатическим процессом называется такой процесс, при котором газ не вступает в тепловой обмен с окружающим пространством. Можно с достаточным приближением рассматривать всякое быстрое изменение объема, как процесс адиабатический, и чем быстрее этот процесс происходит, тем ближе он к адиабатическому.
Стеклянный баллон 1, служащий для опыта, соединен с открытым манометром 2. Накачиваем в него воздух насосом 3 до тех пор, пока разность уровней жидкости в обоих коленах манометра не станет равной 25-30 см. По прошествии 3-5 минут температура воздуха в балоне становится равной температуре окружающей среды.
Рассмотрим часть газа, например, единицу массы, его удельный объем V1, давление P1, температура Т1 (комнатная) (рис.6). Открываем затем быстро закрываем кран 4 на короткое время, соединяем баллон с окружающим воздухом. В результате этого газ переходит в состояние 2 (процесс 1-2).
Так как кран имеет большое сечение к процесс происходит быстро, то в данном случае можно считать адиабатическим. Удельный объем теперь будет V2. давление P2 (атмосферное) и температура T2 В состоянии 2 кран закрываем. Через 3-5 минут воздух нагревается изохорически до комнатной температуры Т1 и его давление будет P3 (переход 2-3). Для адиабатического перехода из первого состояния второе справедливо уравнение Пуассона, т.е.
![]() (9)
(9)
Сравнивая конечное третье состояние газа с первым состоянием, мы видим, что переход из третьего состояния в первое может быть произведен изотермически. К этому процессу применим закон Бойля - Мариотта, т.е.
![]() (10)
(10)
Из уравнений (9) и (10) можно определить k. Для этого возводим уравнение (10) в k степень и делим его на уравнение (9).
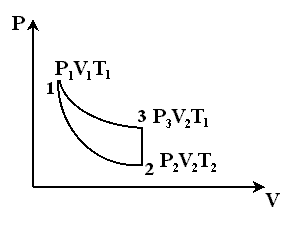
Рис. 6

Рис. 7
 (11)
(11)
или
![]() (12)
(12)
или
 (13)
(13)
Логарифмируя последнее выражение, находим искомый коэффициент
 (14)
(14)
Это есть точная формула для коэффициента k. Однако, те условия, в которых производится опыт Клемана и Дезорма, позволяют получить очень простую приближенную формулу.
Обозначим разность уровень жидкости в манометре в первом состоянии через Н, а в третьем состоянии через h. В таком случае
![]() ;
;
![]() (15)
(15)
где
![]() - есть переводной коэффициент для
перехода от разностей уровней к давлению.
- есть переводной коэффициент для
перехода от разностей уровней к давлению.
В обоих случаях второе слагаемое в
правых частях мало по сравнению с первым
слагаемым. Из (15) получаем
![]()
![]() и подставляем в (14).
и подставляем в (14).

 (16)
(16)
Величина
![]() и
и
![]() много меньше единицы. Для малых значений
x справедливо приближенное
выражение
много меньше единицы. Для малых значений
x справедливо приближенное
выражение
![]() =
=
![]() .
Это равенство получается, если ln
(1 - x) разложить
в ряд и ограничиться первым членом
ряда.)
.
Это равенство получается, если ln
(1 - x) разложить
в ряд и ограничиться первым членом
ряда.)
Тогда:
 (17)
(17)
или
 (18)
(18)
По формуле (17) можно производить вычисления k однако величина. Входящая в нее получена в предположении, что кран 4 закрывается в момент окончания адиабатического процесса 1-2 (рис .6).
(17)
или
(18)
По формуле (17) можно производить вычисления k однако величина h, входящая в нее получена в предположении, что кран 4 закрывается в момент адиабатического процесса 1-2 (рис.6).
Е сли
экран закрыть до завершения процесса
1-2. т.е. в тот момент, когда давление в
баллоне снизятся до некоторой величины
сли
экран закрыть до завершения процесса
1-2. т.е. в тот момент, когда давление в
баллоне снизятся до некоторой величины
![]() но еще не достигнет атмосферного давления
Р2, то как видно из рис. 8 соответствующая
разность давлений после осуществления
процесса адиабатического расширения
и последующего изохорного нагревания
определится разность к ординат 2'
но еще не достигнет атмосферного давления
Р2, то как видно из рис. 8 соответствующая
разность давлений после осуществления
процесса адиабатического расширения
и последующего изохорного нагревания
определится разность к ординат 2'
Рис. 8
-3' вместо разности ординат 2-З. При этом в состоянии 3 разность уровней жидкости в манометре окажется равной значению h', большему h (h1) npoпорционально давлению, соответствующему отрезку 3' 2, так как манометр показывает давление воздуха в баллоне по сравнению с атмосферным Р2). Подготовка в (17-18) завышенного h' вместо h дает завышенное значение величины k по сравнению с действительным.
Е сли
кран 4 закрыть спустя некоторое время
после завершения процесса 1-2, то за это
время температура в баллоне несколько
повысится за счет теплообмена с внешней
средой (изобарный процесс 2-4, происходящий
при давлении, равном атмосферному). В
этом случае разность давлений, определяется
разностью ординат 4-5 окажется заниженной,
а разность уровней жидкости в манометр-
h" в состоянии газа 5
окажется меньше h, что
приведет к заниженному значению k.
сли
кран 4 закрыть спустя некоторое время
после завершения процесса 1-2, то за это
время температура в баллоне несколько
повысится за счет теплообмена с внешней
средой (изобарный процесс 2-4, происходящий
при давлении, равном атмосферному). В
этом случае разность давлений, определяется
разностью ординат 4-5 окажется заниженной,
а разность уровней жидкости в манометр-
h" в состоянии газа 5
окажется меньше h, что
приведет к заниженному значению k.
Рис.9
Для получения правильного результата измерения кран 4 установки следует закрыть в тот момент, когда газ накопится в состоянии 2, что практически невозможно. Ввиду этого отрезок ординаты 2-3 приходится определять косвенным путем.
Рассмотрим с этой целью процесс, происходящий в баллоне после открытия крана, предположив, что газ находится в состоянии I (рис. 8). Открыв кран 4, произведем адиабатическое расширение при этом температура газа понизится относительно комнатной до значения Т2. давление станет равным Р2 (атмосферному) (процесс 1-2).
Если кран оставить открытым в течении
времени
![]() после окончания процесса то, температура
газа в баллоне за это время несколько
повысится за счет теплообмена до величины
Т (изобарный процесс 2-4). Закроем кран и
дождемся, пока температура газа в баллоне
не станет равной температуре окружающей
среды Т1) (изохорный процесс 4-5).
При этом давление газа в сосуде повысится
на величину
после окончания процесса то, температура
газа в баллоне за это время несколько
повысится за счет теплообмена до величины
Т (изобарный процесс 2-4). Закроем кран и
дождемся, пока температура газа в баллоне
не станет равной температуре окружающей
среды Т1) (изохорный процесс 4-5).
При этом давление газа в сосуде повысится
на величину
![]() Р,
которую определим манометром при
соответствующей разности уровней
Р,
которую определим манометром при
соответствующей разности уровней
![]() ,
т.к.
,
т.к.
![]() (индекс у h соответствует
значению разности уровней в манометре,
когда кран открыт в течение времени
(индекс у h соответствует
значению разности уровней в манометре,
когда кран открыт в течение времени
![]() ).
).
Если
уменьшить, то величина
,
как видно из (рис. 8) возрастет, и в пределе,
когда
![]() (т-4 приблизится к т.2), a
к искомому значению h, которое
соответствует моменту закрытия крана
в состоянии 2. Таким образом величина
h, зависит от времени, в
течение которого открыт кран 4 или h =
f(
)
как видно из (рис.8) величина
зависит от
нелинейно. Однако любой нелинейный
процесс с достаточной степенью точности
можно аппроксимировать экспонентной.
Следовательно можно записать
(т-4 приблизится к т.2), a
к искомому значению h, которое
соответствует моменту закрытия крана
в состоянии 2. Таким образом величина
h, зависит от времени, в
течение которого открыт кран 4 или h =
f(
)
как видно из (рис.8) величина
зависит от
нелинейно. Однако любой нелинейный
процесс с достаточной степенью точности
можно аппроксимировать экспонентной.
Следовательно можно записать
=![]() (19)
(19)
(при
![]()
![]() ).
Логарифмируем выражение (19)
).
Логарифмируем выражение (19)
![]() (20)
(20)
Получив на опыте ряд значений ln
при различных длительностях процесса
расширения
,
можно построить зависимость ln
=f(
)
(рис. 9) Полученная прямая отсекает на
оси ординат отрезок, равный ln
h. Потенцируя,
найдем искомое значение h.
Однако величина h зависит от H. поэтому
нужно при построении графика (рис.9)
иметь или Н = const. или
выразить h в долях H,
т.е. взять отношение
![]() тогда:
тогда:
(21)
В этом случае удобнее строить график
![]() а
не
а
не
![]() .
.
