
УИРС_ОЛД_Анемия_+2019
.pdf
ГБОУ ВПО УГМУ
Кафедра общей химии
ИССЛЕДОВАНИЕ ФИЗИКО – ХИМИЧЕСКИХ СВОЙСТВ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ЖЕЛЕЗА
Методические указания для студентов лечебно-профилактического факультета
Екатеринбург
2017 год
ОСНОВНЫЕ СТРУКТУРНЫЕ ЕДИНИЦЫ и ОФОРМЛЕНИЕ УИРС
Результаты УИРС должны быть оформлены в виде отчета и презентации. Обратите внимание на рекомендации по оформлению:
Отчет должен включать:
содержание
литературный обзор по теме или информацию о свойствах и применении конкретного препарата (раздел согласуется индивидуально с преподавателем):
Назначение препарата
Состав, дозировка, противопоказания, производитель
Информация об эффективности действия (публикации с указанием ФИО авторов, журнала, №, год)
цель работы,
объекты исследования, приборы, методы и методики исследования,
полученные экспериментальные данные,
выводы,
ссылки на литературу,
приложения,
Презентация (общие рекомендации):
–не более 10 слайдов: 1 – название, 2,3 – обоснование (актуальность – из литобзора), 3
–цель и методы, 4,5 – теория (сущность методологии – по лекционному материалу), 6,7,8 – экспериментальные данные.
Название файлов (реферат, презентация) включает следующую информацию: группа – фамилия и имя авторов – название работы. Например: «ОЛД 201 Иванов И_ Сорбенты_СК». Если работа выполнена группой, то может быть оформлен один реферат и одна презентация, но обязательно надо указать в содержании реферата разделы, которые выполнял каждый участник работы.
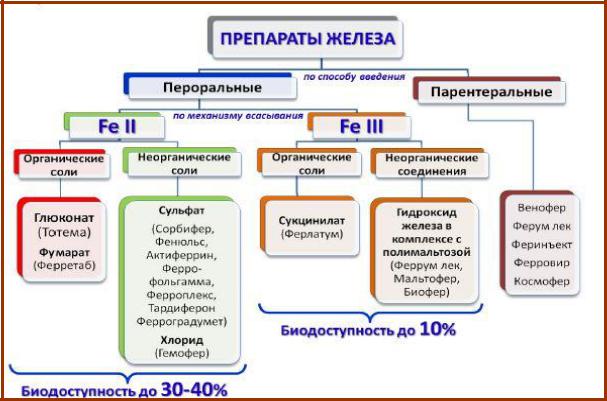
Цель работы: исследование физико-химических свойств препаратов железа (П, Ш)
Объекты исследования (согласуются индивидуально с преподавателем):

Экспериментальная часть
Занятие 1
Приготовление водных растворов железа (П) или (Ш) и определение концентрации трилонометрическим методом
1.1.5 мл контрольного раствора (500 мг/л) отобрать пипеткой Мора и поместить в колбу на 50 мл, довести до метки, перемешать (Раствор 1- Р1(50 мг/л).
1.2.Приготовить 50 мл раствора (Р2) с концентрацией в 2 раза меньшей, чем раствор Р1. 2,5 мл контрольного раствора (500 мг/л) отобрать пипеткой Мора и поместить в колбу на 50 мл, довести до метки, перемешать (Раствор 1- Р2(25 мг/л).
1.3.Определить концентрацию железа в растворах трилонометрическим методом.
Методика определения содержания ионов Fe3+
К 10 мл исследуемого раствора Р1 (или Р2), добавить1-2- капли 0,1 н НС1. Затем внести глицин (0,2 г), и 2,5 мл салициловой кислоты (концентрация 200 мг/л по углероду). Исследуемый раствор приобретает сиреневую окраску. Титровать из бюретки трилоном Б (0,01н) до перехода окраски в бледно желтую. Опыт повторить дважды. По среднему объему трилона Б, пошедшего на титрование, рассчитать содержание ионов Fe3+ в растворе. Данные занесите в табл.1.
Методика определения содержания ионов Fe2+
10 мл исследуемого раствора Р1 (или 20 мл Р2) нагреть до 40-500С, добавить 20 мл ацетатного буфера, несколько кристаллов индикатора криленоловый оранжевый. Титровать из бюретки трилоном Б (0,01н) до перехода окраски сине-фиолетовой в желтую. Опыт повторить дважды. По среднему объему трилона Б, пошедшего на титрование, рассчитать содержание ионов Fe2+ в растворе. Данные занесите в табл.1.
(Fe) = (Cтр*Vтр/Vа)*28*1000 (мг/л) |
|
1.4. Рассчитайте необходимое количество или необходимый объем |
лекарственного |
препарата для приготовления 50 мл раствора с концентрацией равной |
концентрации |
раствора Р2. |
|
Приготовьте раствор РП2 с концентрацией равной концентрации Р2. Определите концентрацию приготовленных растворов трилонометрическим методом. Раствор РП1
необходимо сохранить для занятия №3 |
|
|
|
||||
п. 1.3. |
Если раствор мутный, то его следует профильтровать(фильтр - с.л) |
||||||
Данные занесите в табл.1. |
|
|
|
|
|||
Табл.1 |
|
|
|
|
|
|
|
№пп. |
|
Наименование |
Vа, мл |
Vтрилона, |
Концентрация |
Примечание |
|
|
|
пробы |
|
мл |
железа, мг/л |
|
|
|
|
|
|
|
Теоретич. |
Эксперим.знач. |
|
1 |
|
Р 1 |
|
|
|
|
|
2 |
|
Р 1 |
|
|
|
|
|
3 |
|
Р 2 |
|
|
|
|
|
4 |
|
Р 2 |
|
|
|
|
|
5 |
|
ЛП 1(назв.) |
|
|
|
|
|
6 |
|
ЛП-2(назв.) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Выводы по занятию 1 :
Занятие 2
Приготовление водных растворов железа (II) или (III) и определение физикохимических свойств методами: потенциометрии и спектрофотометрии
2.1 Приготовление растворов
10 мл контрольного (стандартного) раствора отобрать пипеткой Мора и поместить в колбу на 100 мл, довести до метки, перемешать (Раствор 1- Р1).
В колбу на 100 мл поместите по 10 мл раствора Р1. Доведите объем до метки, перемешайте и получите соответственно растворы: Р.2
Приготовьте растворы лекарственных препаратов с концентрациями равными концентрациям растворов Р1 И Р2 – это будут растворы соответственно ЛП 1 и ЛП 2
2.2 Определение величины pH методом потенциометрии.
После прогревания прибора, промойте электроды дистиллированной водой, осушите фильтровальной бумагой и поместили в исследуемый раствор.
Результаты занесите в таблицу 2.1 и 2.2.
Табл.2.1Результаты определения pH в контрольных растворах железа(Ш) и лекарственного препарата
Наименование пробы |
Cэ, моль/л |
pH |
Red/Ox,мВ |
Р.1 |
|
|
|
Р.2 |
|
|
|
Дистиллированная |
|
|
|
вода |
|
|
|
Табл.2.2Результаты определения pH в исследуемый растворах……
Наименование пробы |
Cэ, моль/л |
pH |
Red/Ox,мВ |
ЛП.1(назв.) |
|
|
|
ЛП.2(назв.) |
|
|
|
Дистиллированная |
|
|
|
вода |
|
|
|
Вывод: |
|
||
2.3 Определите оптическую плотность растворов при следующих условиях λ=320 и 400 нм, кювета = 30. Данные измерений надо занести в таблицу 2.3(для конр. р-ров) и 2.4(для исслед.р-ров)
Таблица 1.3 Оптическая плотность при разных длинах волн
Наименование пробы |
Р1 |
Р2 |
ЛП 1(назв.) |
ЛП 2(назв.) |
Примечание |
λ=320 нм |
|
|
|
|
|
λ= 400 нм, |
|
|
|
|
|
Дистиллированная |
|
|
|
|
|
вода |
|
|
|
|
|
Постройте зависимость D=f(C) Вывод:
Общие выводы по занятию 2 :
Занятие 3
Приготовление водных растворов железа (II) или (III) и исследование адсорбционных свойств разными методами (трилонометрия и спектрофотометрия)
3.1. В чистые стаканчики с помощью мерного цилиндра налейте по 20 мл анализируемых растворов и добавьте 0,2 г измельченного полярного адсорбента. Содержимое каждого стакана перемешайте и через 5 минут отфильтруйте с помощью смоченного в дистиллированной воде фильтре на воронке. Определите концентрацию железа в растворе после адсорбции. Результаты опыта занесите в таблицу 3.1.
Табл.3.1
Наименование пробы |
Метод |
Cисх |
Cпосле |
С, мг/л |
Адсорбция,мг/г |
|
анализа |
(до адс.), |
(после адс.), мг/л |
|
|
|
|
мг/л |
|
|
|
РП.2 |
|
|
|
|
|
РП.4 |
|
|
|
|
|
РП.6 |
|
|
|
|
|
РП.8 |
|
|
|
|
|
РП.10 |
|
|
|
|
|
Р |
|
|
|
|
|
Дистиллированная |
|
|
|
|
|
вода |
|
|
|
|
|
3.2. В чистые стаканчики с помощью мерного цилиндра налейте по 20 мл анализируемых растворов и добавьте 0,2 г измельченного неполярного адсорбента. Содержимое каждого стакана перемешайте и через 5 минут отфильтруйте с помощью смоченного в дистиллированной воде фильтре на воронке. Определите концентрацию железа в растворе после адсорбции. Результаты опыта занесите в таблицу 3.2.
Табл3.2
Наименование пробы |
Метод |
Cисх |
Cпосле |
С, мг/л |
Адсорбция,мг/г |
|
анализа |
(до адс.), |
(после адс.), мг/л |
|
|
|
|
мг/л |
|
|
|
РП.2 |
|
|
|
|
|
РП.4 |
|
|
|
|
|
РП.6 |
|
|
|
|
|
РП.8 |
|
|
|
|
|
РП.10 |
|
|
|
|
|
Р |
|
|
|
|
|
Дистиллированная |
|
|
|
|
|
вода |
|
|
|
|
|
Общие выводы по занятию 3 : |
|
|
|
|
|
Занятие 4
Приготовление водных растворов железа (II) или (III) и определение окислительно-
восстановительных свойств (йодометрия, перманганатометрия)
4.1. Определение концентрации йода в контрольных водных растворах
Приготовление КДС йода (основной раствор)
13 г йода + 50 мл воды, содержащей 36 г KJ. Разбавить до 1 л.
0,5 мл КДС иода отобрать пипеткой, поместить в колбу на 100 мл, добавить до метки дистиллированной водой, перемешать. Отобрать мерным цилиндром по 50 мл, добавить 2 капли соляной кислоты(1н), крахмал. Титровать тиосульфатом, 0,01н., до устойчивого исчезновения синего цвета.
4.2.Определение окислительных свойств соединений железа (Ш) в различных водных растворах Отобрать мерным цилиндром 25 или 50 мл пробы, поместить в колбу для титрования.
Добавить 2 капли соляной кислоты(1н), сухой KJ,крахмал. Титровать тиосульфатом, 0,01н., до устойчивого исчезновения синего цвета.
Табл.4.2
№пр. |
Наименование |
Vа, мл |
Vтиосульфата, |
Концентрация |
Концентрация |
Примечание |
|
пробы |
|
мл |
железа |
иода, мг/л |
|
|
|
|
|
теоретич., |
|
|
|
|
|
|
мг/л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.3.Определение окислительных свойств |
водных растворов железа (Ш) в присутствии |
трилона Б |
|
Отобрать мерным цилиндром 25 или 50 |
мл пробы, поместить в колбу для титрования, |
добавитьТрилон Б(1/2 объема, который израсходован на титрование) Добавить 2 капли соляной кислоты(1н), крахмал. Титровать тиосульфатом, 0,01н., до устойчивого исчезновения синего цвета.
Табл.4.3 (с Трилоном Б или другим лигандом)
№пр. |
Наименование |
Vа, мл |
Vтиосульфата, |
Концентрация |
Концентрация Примечание |
|
пробы |
|
мл |
железа |
иода, мг/л |
|
|
|
|
теоретич., |
|
|
|
|
|
мг/л |
|
1 |
25 |
60 |
3 |
50 |
20 |
|
|
|
5 |
25 |
60 |
7 |
50 |
20 |
Общие выводы по занятию 3
Общие выводы по экспериментальной работе:
|
|
ПРИЛОЖЕНИЯ |
||
|
|
|
Приложение 1 |
|
|
|
|
|
|
N |
Состав группы |
|
Препарат, с которым работает группа |
|
1. |
|
|
|
|
2. |
|
|
|
|
3. |
|
|
|
|
|
|
|
|
|
4. |
|
|
|
|
5. |
|
|
|
|
|
|
|
|
|
6. |
|
|
|
|
7. |
|
|
|
|
|
|
|
Приложение 2 |
|
№пп |
|
Тема литературного обзора |
|
Студент (ФИО) |
|
|
Сорбифер или Фенюльс: формула, механизм действия, |
|
|||
1 |
показания, |
противопоказания, |
побочное |
действие, |
|
эффективность применения. Публикации о результатах |
|
||||
|
|
||||
|
использования. |
|
|
|
|
|
Актиферрин, или Ферроплекс: формула, механизм действия, |
|
|||
2 |
показания, |
противопоказания, |
побочное |
действие, |
|
эффективность применения. Публикации о результатах |
|
||||
|
|
||||
|
использования. |
|
|
|
|
|
Тотема (глюконат железа II): формула, механизм действия, |
|
|||
3 |
показания, |
противопоказания, |
побочное |
действие, |
|
эффективность применения. Публикации о результатах |
|
||||
|
|
||||
|
использования. |
|
|
|
|
|
Ферретаб (фурамат железа II): формула, механизм действия, |
|
|||
4 |
показания, |
противопоказания, |
побочное |
действие, |
|
эффективность применения. Публикации о результатах |
|
||||
|
|
||||
|
использования. |
|
|
|
|
|
Мальтофер(препарат железа Ш): формула, механизм действия, |
|
|||
|
показания, противопоказания, побочное действие, |
|
|
||
5 |
эффективность применения. Публикации о результатах |
|
|||
|
использования. |
|
|
|
|
|
|
|
|||
|
Ферлатум(сукцинилат железа II): формула, механизм действия, |
|
|||
6 |
показания, |
противопоказания, |
побочное |
действие, |
|
эффективность применения. Публикации о результатах |
|
||||
|
|
||||
|
использования. |
|
|
|
|
|
Венофер(препарат железа Ш): формула, механизм действия, |
|
|||
7 |
показания, |
противопоказания, |
побочное |
действие, |
|
эффективность применения. Публикации о результатах |
|
||||
|
|
||||
|
использования. |
|
|
|
|
|
Феррум Лек (препарат железа Ш): формула, механизм |
|
|||
8 |
действия, показания, противопоказания, побочное |
действие, |
|
||
эффективность применения. Публикации о результатах |
|
||||
|
|
||||
|
использования. |
|
|
|
|

Приложение 3
РАБОТА С ПРИБОРАМИ
Измерение электропроводимости и рН
Кондуктометрия – физико-химический метод исследования, основанный на измерении электрической проводимости жидких сред. Электрическая проводимость растворов определяется концентрацией свободных ионов: повышение электрической проводимости указывает на увеличение свободных ионов, уменьшение – на то, что их концентрация падает.
Ход определения:
В чистый стакан налейте 20,0 мл исследуемого раствора и опустите датчик для смачивания поверхности ячейки, а также ускорения процесса установления температурного режима. Включите прибор. Дайте прибору прогреться 3 минуты. Выполните измерение 2 раза (см. инструкцию). Результат занести в таблицу.
Измерять электропроводимость в пальчиковых стаканчиках (см. инструкцию к прибору), можно в произвольном объеме воды – примерно половина стаканчика. Важно, чтобы вода была выше рамки кондуктометра, после погружения электрода. Полученные значения надо занести в таблицу.
После измерения электропроводимости – измерить в этом же стаканчике рН.
ИНСТРУКЦИЯ ПО РАБОТЕ НА КОНДУКТОМЕТРЕ АНИОН-7020
1.ВКЛЮЧИТЬ ПРИБОР В СЕТЬ 220 В.
2.ПРОМЫТЬ ДАТЧИК ДИСТИЛЛИРОВАННОЙ ВОДОЙ. ОСУШИТЬ ФИЛЬТРОВАЛЬНОЙ БУМАГОЙ.
3.ПОГРУЗИТЬ ДАТЧИК В СТАКАН С ИССЛЕДУЕМОЙ ЖИДКОСТЬЮ. ЧТОБЫ ЩЕЛЬ ДАТЧИКА БЫЛА ЗАКРЫТА РАСТВОРОМ.
4.НАЖАТЬ КНОПКУ ВКЛ. – ЗАФИКСИРОВАТЬ ПОКАЗАНИЯ ПРИБОРА.
5.ВЫНУТЬ ДАТЧИК ИЗ РАСТВОРА. ПРОМЫТЬ ЕГО ДИСТИЛЛИРОВАННОЙ ВОДОЙ. ОБСУШИТЬ ФИТРОВАЛЬНОЙ БУМАГОЙ.
6.ОТКЛЮЧИТЬ ПРИБОР.
Определение величины рН и окислительно–восстановительного потенциала методом потенциометрии
Метод потенциометрии – измерение ЭДС гальванической цепи (рН раствора), состоящей из индикаторного и вспомогательного электродов, опущенных в исследуемый раствор. При этом различают прямую потенциометрию, позволяющую определять концентрацию свободных ионов гидроксония в водном растворе (рН), и потенциометрическое титрование, при котором устанавливается общее содержание кислых слабоионизирующих продуктов обмена. Потенциометрическое определение рН растворов проводят с помощью потенциометра со стеклянным и хлорсеребряным электродами.
Ход определения:
Включите прибор в сеть на 220 В и дайте прогреться примерно 20 минут. После этого промойте электроды дистиллированной водой, осушите фильтровальной бумагой, погрузите их в исследуемый раствор и отметьте показания на шкале прибора. Переключите прибор в режим определения 0 растворов (см. инструкцию), результат измерения занесите в табл.1.
Постройте график зависимости рН = f (С); = f (С)
Таблица 1 Результат определения рН и Red/Ox потенциала в исследуемых растворах К.О.
№ системы |
СЭ, моль/л |
æ |
рН |
, В |
Дистиллированная Н2О
ИНСТРУКЦИЯ ПО ЭКСПЛУАТАЦИИ рН-150МИ
1.ВКЛЮЧИТЬ ПРИБОР В ЭЛЕКТРИЧЕСКУЮ СЕТЬ ЗА 10 МИНУТ ДО НАЧАЛА ИЗМЕРЕНИЙ.
2.ПРОМЫТЬ ЭЛЕКТРОД ДИСТИЛЛИРОВАННОЙ ВОДОЙ ДО рН = 5,2-5,6.
3.ОСУШИТЬ ЕГО ФИЛЬТРОВАЛЬНОЙ БУМАГОЙ.
4.ДЛЯ ИЗМЕРЕНИЯ НЕОБХОДИМО ВЫБРАТЬ РЕЖИМ РАБОТЫ – «ИЗМЕРЕНИЕ»
– ОСНОВНОЙ РЕЖИМ РАБОТЫ.
ПРИ НЕОБХОДИМОСТИ КНОПКОЙ ВЫБОР СЛЕДУЕТ УСТАНОВИТЬ РЕЖИМ «рН» ИЛИ «mV». В ПРАВОЙ ЧАСТИ ДИСПЛЕЯ ВЫСВЕТИТСЯ СИМВОЛ «рН» ИЛИ «mV».
5.ПОГРУЗИТЬ ЭЛЕКТРОД В СТАКАН С АНАЛИЗИРУЕМЫМ РАСТВОРОМ. ВЫДЕРЖАТЬ 3 МИНУТЫ.
6.ЗАПИСАТЬ С ДИСПЛЕЯ ПОКАЗАНИЯ ПРИБОРА.
7. УБРАТЬ РАСТВОР, ПРОМЫТЬ ЭЛЕКТРОД ДИСТИЛЛИРОВАННОЙ ВОДОЙ ДО рН = 5,2-5,6 И ОСТАВИТЬ ЕГО В СТАКАНЕ С ДИСТИЛЛЯТОМ.
Определение зависимости светопоглощения (светопропускания) от длины волны методом фотоколориметрии
Фотоколориметрия – физико–химический метод исследования, основанный на измерении оптической плотности жидкой среды. Оптическая плотность пропорциональна концентрации дисперсной фазы, которая поглощает световой поток в определенном диапазоне длин волн.
Ход определения:
Включите прибор (см. инструкцию). Дайте прибору прогреться 5 минут. В кювету (10 мл) налейте дистиллированной воды, выполните измерение, запишите данные в тетрадь и на доску, в общую таблицу. Раствор можно использовать для других измерений
Аналогичным образом необходимо определить оптическую плотность в исследуемом растворе. Данные записывайте в тетрадь, в таблицы 1,2.
ПОРЯДОК РАБОТЫ НА КФК-3
1.КЮВЕТУ С Х.П. УСТАНОВИТЬ В ГНЕЗДО.
2.УСТАНОВИТЬ КЮВЕТУ С Х.П. В СВЕТОВОЙ ПУЧОК (РУКОЯТКА ВЛЕВО ДО УПОРА).
3.УСТАНОВИТЬ ДЛИНУ ВОЛНЫ. ДЛИНА ВОЛНЫ ВЫСВЕТИТСЯ НА ВЕРХНЕМ ТАБЛО.
