
ИДЗ Альмяшева / 0501_ИДЗ1_Конунников
.pdf
МИНОБРНАУКИ РОССИИ САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ ЭЛЕКТРОТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ «ЛЭТИ» ИМ. В.И. УЛЬЯНОВА (ЛЕНИНА) Кафедра физической химии
ОТЧЕТ по Индивидуальному домашнему заданию №1
по дисциплине «Химия» Тема: Основные стехиометрические законы химии. Строение атома и
химическая связь. Ионно-электронный метод уравнения окислительно-
востоновительных реакций.
Студент гр. 0501 |
|
Конунников Г.А. |
|
Преподаватель |
|
|
Кириллова С.А. |
Санкт-Петербург
2020
7
Основные формулы для расчетов
Уравнение состояния идеального газа описывается формулой (1):
pV |
m |
RT vRT , |
(1) |
|
M |
||||
|
|
|
где p – давление, Па;
V – объем, м3;
m – масса газа, кг;
M – молярная масса газа, кг/моль; v – число молей газа;
R = 8.314 Дж/(моль · К) – универсальная газовая постоянная;
T – температура, К.
Следствие из закона Авогадро описывается формулой (2):
m1 |
|
M1 |
D1/ 2 , |
(2) |
|
m2 |
M 2 |
||||
|
|
|
где m1 m2, – массы газов, г;
M1, M2 – молярные массы газов, г/моль;
– относительная плотность первого газа по второму.
Закон эквивалентов описывается выражением (3):
m1 |
|
m2 |
, |
(3) |
|
|
|
||||
M ЭК 1 |
|
M |
|
|
|
|
ЭК 2 |
|
|||
где m1 m2, – массы взаимодействующих веществ, г;
Mэк1 Mэк2, – молярные массы эквивалентов веществ, г/моль.
Молярные эквивалентные массы веществ определяются по следующим соотношениям:
М эк. оксида |
|
|
|
|
М оксида |
; |
|||
число атамов элемента валентность элемента |
|||||||||
|
|
|
|
||||||
М эк. кисл оты |
|
М |
кисл оты |
|
; |
|
|||
|
|
|
|
||||||
|
|
|
|
основность кислоты |
|
||||
|
|
|
|
|
|
8 |
|
|
М |
|
|
|
|
М основ ания |
|
; |
|
эк. основ ания |
|
|
|
|||||
|
|
|
|
|
кислотность основания |
|
||
М |
|
|
|
|
М |
сол и |
. |
|
эк. сол и |
число атамов металла валентность металла |
|||||||
|
|
|
|
|||||
Ход работы.
Вариант – 8.
Пример 1. Какой объем кислорода при Т = 600 К и р = 1.03 · 105 Па потребуется для полного сжигания 6 · 10–2 кг углерода (до СО2)?
Решение.
Запишем уравнение реакции:
C2+2O2 → 2CO2
Отсюда следует:
M(О2) = 16 ∙ 2 = 32 г/моль
m СO |
|
|
|
m 2O |
|
6 10 |
2 4 16 |
16 |
10 2 кг |
|||||||
|
|
|
2 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|||||||||
|
2 |
|
|
|
|
C2 |
|
12 2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Из уравнения (1) следует |
|
|
||||||||||||||
v |
m |
|
|
|
16 10 2 |
5моль |
|
|
||||||||
M |
|
|
|
32 10 3 |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
V |
vRT |
|
|
5 8.314 600 |
|
0.24 м3 |
|
|||||||||
|
|
1.03 105 |
|
|||||||||||||
|
|
|
p |
|
|
|
|
|
|
|||||||
Пример 2. Требуется:
а) написать электронную формулу атома элемента № 51; б) записать в форме энергетических ячеек электронную конфигурацию
валентного уровня атома сурьмы в основном и «возбужденном» состояниях.
Решение.
а) Элемент № 51 – сурьма, р-элемент. Электронная формула будет выглядеть следующим образом:
1s22s22p63s23p64s23d104p65s224d105p3
б) Внешний энергетический уровень атома сурьмы содержит 5 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
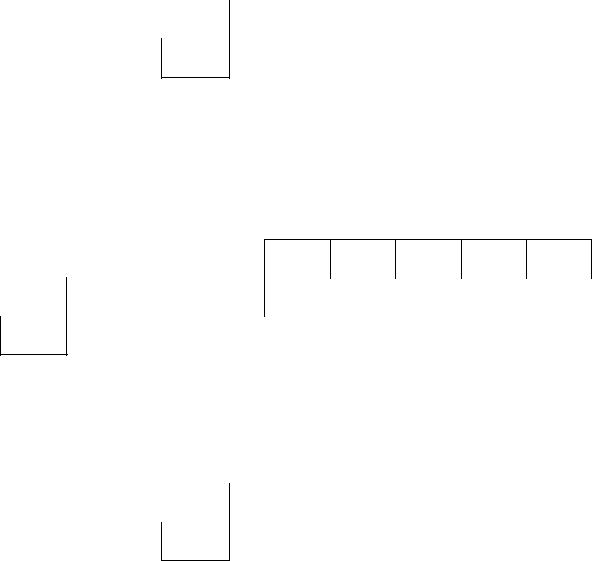
9
5p |
↑ |
↑ |
↑ |
|
|
|
|
5s ↑↓
Наличие трех неспаренных электронов свидетельствует о том, что для сурьмы характерна степень окисления +3. За счет наличия вакантных орбиталей 5d-подуровня для атома сурьмы возможно возбужденное состояние:
5d ↑
5p |
↑ |
↑ |
↑ |
|
|
|
|
|
|
5s ↑↓
Пример 3. Укажите тип гибридизации орбиталей в молекуле NH3.
Решение. Азот имеет электронную конфигурацию: 1s22s22p3.
Определим тип гибридизации азота в молекуле аммиака:
2p |
↓ |
↓ |
↓ |
|
|
|
|
2s ↓↑
В образовании связи участвуют три единичных электрона, находящиеся на р-орбитали, но гибридизоваться р-орбитали без s не могут, поэтому тип гибридизации sp3.
Пример 4. Закончите и уравняйте ионно-электронным методом окислительно-восстановительные реакции:
FeSO4 +KMnO4 +H2SO4 → Fe2(SO4)3 +MnSO4 +…
KCrO2 +KMnO4 +KOH → K2CrO4 +K2MnO4 +…
Решение.
1. Данное уравнение реакции перепишем в ионной форме:
Fe3+ + SO42- +K+ + MnO4- + 2H+ + SO42- → 2Fe2+ + 3SO42- + Mn2+ + SO42- +…
и определим для восстановителя его окисленную форму:
Fe2+ → Fe3+

10
а для окислителя – его восстановленную форму:
MnO4- → Mn2+
Для процессов окисления и восстановления необходимо сначала составить материальный баланс с помощью ионов Н+ и Н2О, а затем баланс по электрическим зарядам. Два полученных уравнения следует просуммировать,
умножив каждое из них на коэффициенты, подобранные так, чтобы число электронов, теряемых восстановителем, было равно числу электронов,
приобретаемых окислителем. В результате получаем ионное уравнение окислительно-восстановительной реакции:
5 Fe2+ - e- → Fe3+
1 15MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
5Fe2+ + 15MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
Теперь переносим все коэффициенты из ионного уравнения в молекулярное уравнение реакции, согласно материальному балансу.
10FeSO4 + 2KMnO4 + 8H2SO4 → 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
Проводим проверку правильности расстановки стехиометрических коэффициентов по кислороду: количество атомов кислорода в левой и правой части уравнения окислительно-восстановительной реакции должно быть одинаковым.
2. Данное уравнение реакции перепишем в ионной форме:
K+ + CrO2- + 3K+ + MnO4- + 4K+ + OH- → 2K+ + CrO43- + 2K+ + MnO4- +…
и определим для восстановителя его окисленную форму:
Cr3+ → Cr6+
а для окислителя – его восстановленную форму:
Mn7+ → Mn6+
Для процессов окисления и восстановления необходимо сначала составить материальный баланс с помощью ионов Н+ и Н2О, а затем баланс по электрическим зарядам. Два полученных уравнения следует просуммировать,
умножив каждое из них на коэффициенты, подобранные так, чтобы число

11
электронов, теряемых восстановителем, было равно числу электронов,
приобретаемых окислителем. В результате получаем ионное уравнение окислительно-восстановительной реакции:
1
3
Cr3+ + 3Mn7+ + 3OH- → Cr6+ + 3Mn6++ 3H2O
Теперь переносим все коэффициенты из ионного уравнения в молекулярное уравнение реакции, согласно материальному балансу.
KCrO2 + 3KMnO4 + 4KOH → K2CrO4 + 3K2MnO4 + 2H2O
Проводим проверку правильности расстановки стехиометрических коэффициентов по кислороду: количество атомов кислорода в левой и правой части уравнения окислительно-восстановительной реакции должно быть одинаковым.
