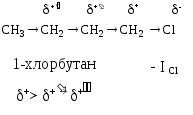Электронное и пространственное строение атома азота в пирроле
Три sр2-гибридизованные орбитали атома азота, содержащие по одному электрону образуют 3 -связи (с двумя углеродами и водородом) и р-орбиталь, содержащая неподеленную пару электронов, участвует в образовании р---сопряженной системы. В результате sр2-гибридизации всех атомов цикла — молекула плоскостная, система сопряжения становится замкнутой и включает 6 р-электронов. Выполняется правило ароматичности Хюккеля при n=1. Эта система, подобно бензолу, будет иметь ароматические свойства. Такие системы являются -избыточными, так как на пять атомов цикла приходится 6р-электронов. По сравнению с бензолом они легче вступают в реакции замещения. Энергия сопряжения для пиррола равна 110 кДж/моль.
Пиррол
входит в состав многих биологически
важных соединений, например, порфиринов.
Четыре пиррольных ядра образуют порфин
— плоскостную ароматическую систему,
в которой в сопряжении участвуют 26
р-электронов (n=6), и эта система обладает
высокой стабильностью (Е сопр.=840
кДж/моль). Порфиновая структура входит
в состав гемоглобина и хлорофилла, где
образует, соответственно, комплекс с
ионами Fе2+
и Mg2+
.
Пиридиновый атом азота. Примером шестичленных гетероциклических соединений является пиридин. Ароматическая система в пиридине образуется при участии пяти р-орбиталей атомов углерода и одной р-орбитали атома азота, содержащей один электрон.
|
|
|
|
Электронное и пространственное строение атома азота в пиридине
Атом азота в пиридине находится в sр2-гибридизации. На р-орбитали атома азота находится один электрон, эта р-орбиталь участвует в образовании -связи с атомом углерода, а неподеленная пара электронов находится на sр2- гибридизованной орбитали, и не участвует в сопряжении. Пиридин соответствует правилу Хюккеля и проявляет ароматический характер. Так как атом азота имеет большую электроотрицательность, чем атом углерода, общая электронная плотность смещается к нему, и такая система называется -недостаточной. Пиридин по сравнению с бензолом труднее вступает в реакции замещения. Е сопр. для пиридина равна 134 кДж/моль.
Гетероциклические соединения могут содержать два и более гетероатомов. Примерами являются имидазол, пиримидин:
|
|
|
|
Цикл имидазола содержится в аминокислоте гистидине, биогенном амине — гистамине, других соединениях. Устойчивое ароматическое ядро пиримидина входит в состав пиримидиновых оснований нуклеиновых кислот: урацила, тимина и цитозина.
Важнейшей конденсированной гетероциклической системой является пурин, ядро которого входит в состав пуриновых оснований нуклеиновых кислот — аденина и гуанина. Ядро пурина состоит из конденсированных циклов пиримидина и имидазола, содержит 3 пиридиновых атома азота и один пиррольный. Образуется ----р-сопряженная система, включающая 10 р-электронов и удовлетворяющая правилу Хюккеля при n=2.
5. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ
Электроотрицательность – способность атомов смещать к себе электронную плотность ковалентной связи. Л. Полинг оценил количественно электроотрицательность различных элементов — органогенов и представил ее в относительных единицах по отношению к наиболее электроотрицательному элементу — фтору:
F > О > N, Cl > Br > Csp > Csp2 > Csp3 S > H
4,0 3,5 3,0 2,8 2,78 2,69 2,5 2,5 2,2
В молекулах, содержащих различные по электроотрицательности атомы, электронная плотность химических связей распределена неравномерно, что приводит к поляризации ковалентной связи и появлению частичных зарядов, обозначаемых .
Смещение электронной плотности, передающееся по механизму электростатической индукции по цепи -связей называется индуктивным эффектом и обозначается I. Передача индуктивного эффекта по цепи постепенно затухает; как правило, через три-четыре связи он уже не действует.
|
Заместители, смещающие электронную плотность по цепи -связей к себе, проявляют отрицательный индуктивный эффект (-I). Графически индуктивный эффект изображается стрелочкой, совпадающей с -связью, а острие ее направлено к более электроотрицательному атому. | |
|
|
|
|
Индуктивный эффект водорода равен нулю. Заместители, смещающие электронную плотность от себя, проявляют положительный индуктивный эффект (+I). Так, все алкильные радикалы обладают положительным индуктивным эффектом. (СН3)3С- > (СН3)2 СН- > СН3 — СН2 - > CН3 трет.бутил изопропил этил метил | |
По индуктивному эффекту может поляризоваться и -связь. В этом случае его обозначают как I-эффект:

Поляризация -связи обозначается изогнутой стрелкой. СН3-группа выступает в роли электронодонорного заместителя.
Перераспределение -электронной плотности в сопряженной системе под влиянием заместителя, вступающего в -- или р--сопряжение с этой системой, называется мезомерным эффектом (М-эффектом). Графически мезомерный эффект изображается изогнутой стрелкой, начало которой показывает какие электроны (р или ) смещаются, а конец—направление смещения электронной плотности. Мезомерный эффект проявляют только те заместители, которые вступают в -- или р--сопряжение с кратной связью молекулы.
Если заместитель вступает в --сопряжение, то электронная плотность сопряженной системы будет смещаться в сторону более электроотрицательного атома -связи заместителя, который при этом будет проявлять отрицательный мезомерный эффект.
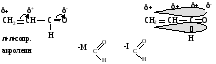
Если заместитель имеет р-орбиталь с неподеленной парой электронов (р--сопряжение), то электронная плотность сопряженной системы смещается в сторону р-орбитали с меньшим количеством электронов на ней. Электронная плотность на заместителе уменьшается (+М). Так как -связь более подвижна, легче поляризуется, то мезомерный эффект передается по всей сопряженной системе.

Заместители, понижающие электронную плотность в сопряженной системе (смещающие ее на себя), проявляют отрицательный мезомерный эффект (-М). К ним относятся заместители, содержащие кратные связи с кислородом.
Заместители, повышающие электронную плотность в сопряженной системе (смещающие ее от себя) проявляют положительный мезомерный эффект (+М). К ним относятся, в первую очередь, гетероатомы (галогены) или группы атомов, такие как аминогруппа, гидроксильная группа и др.
6. ЭЛЕКТРОНОДОНОРНЫЕ И ЭЛЕКТРОНОАКЦЕПТОРНЫЕ ЗАМЕСТИТЕЛИ
В молекулах органических соединений, наряду с имеющимся мезомерным эффектом, одновременно действует и индуктивный эффект. Оба эффекта могут действовать либо согласованно, либо в противоположном направлении. В результате проявляется некий суммарный эффект — электронодонорное (ЭД) или электроноакцепторное (ЭА) действие. В общем случае можно руководствоваться правилом, что мезомерный эффект значительно преобладает над индуктивным, исключением из этого правила являются галогены: у них индуктивный эффект является преобладающим.