
Варианты билетов (заочное отд_1 сем. 3 курс) / Bilety_peresdacha_1_ch
.docxФИЗИЧЕСКАЯ ХИМИЯ ч. 1
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
– 01
Основные понятия химической термодинамики. Термодинамическая система, равновесное состояние и термодинамический процесс. Экстенсивные и интенсивные свойства. Функции состояния и функции процесса. Может ли термодинамическая величина, являющаяся, в общем случае, функцией процесса, приобретать свойства функции состояния? При положительном ответе приведите примеры.
Законы Гиббса-Коновалова. Азеотропные смеси.
Определение парциальных молярных свойств методом касательных. Получена графическая зависимость объема водного раствора от количества молей растворенной мочевины в 1000г воды. Изобразите схематически график, укажите величины, откладываемые на осях координат. Приведите соответствующие расчётные формулы и поясните процедуру расчета парциальных молярных объемов компонентов
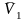 и
и
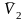 при концентрации раствора, равной
при концентрации раствора, равной
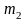 .
.Рассчитать стандартное изменение энергии энтальпии и внутренней энергии в реакции 2Br → Br2 при температуре 1000К. Воспользуйтесь 41 табл.
ФИЗИЧЕСКАЯ ХИМИЯ ч. 1
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
– 02
Первый закон термодинамики, формулировки 1-го закона термодинамики. Внутренняя энергия. Теплота и работа как формы передачи энергии. Взаимосвязь этих величин в изохорном, изобарном и изотермическом процессах.
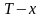 -диаграмма
кипения (при
-диаграмма
кипения (при
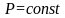 )
двухкомпонентной системы с азеотропом
и положительными (отрицательными)
отклонениями от закона Рауля. Дайте
краткую характеристику диаграммы
(фазовые поля, линии, характерные точки).
Постройте график зависимости равновесного
состава пара от состава жидкости для
легколетучего компонента системы
)
двухкомпонентной системы с азеотропом
и положительными (отрицательными)
отклонениями от закона Рауля. Дайте
краткую характеристику диаграммы
(фазовые поля, линии, характерные точки).
Постройте график зависимости равновесного
состава пара от состава жидкости для
легколетучего компонента системыВ эксперименте получены данные о величинах теплоты растворения (
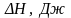 )
при смешении различных количеств (в
)
при смешении различных количеств (в
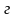 )
метанола (5,20, 50, 100, 500, 1000) в
)
метанола (5,20, 50, 100, 500, 1000) в
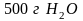 при
при
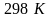 .
Как используя эти данные найти
парциальные молярные энтальпии смешения
компонентов (
.
Как используя эти данные найти
парциальные молярные энтальпии смешения
компонентов (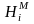 )
при различных концентрациях второго
компонента
)
при различных концентрациях второго
компонента
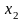 с помощью метода пересечений (отрезков).
Дайте графическое представление данного
метода.
с помощью метода пересечений (отрезков).
Дайте графическое представление данного
метода.Определите среднюю теплоту реакции Ca(OH)2 → CaO + H2O в температурном интервале 500-600 К. Воспользуйтесь данными о логарифмах констант образования.
ФИЗИЧЕСКАЯ ХИМИЯ ч. 1
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 03
Схематическое (графическое) изображение пути процессов обратимого изотермического, изобарного и изохорного процессов идеального газа (и их комбинации) в координатах параметров состояния
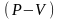 .
Для какого из указанных выше процессов
работа расширения больше при расширении
системы от
.
Для какого из указанных выше процессов
работа расширения больше при расширении
системы от
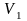 до
до
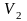 ?
?
Фазовое равновесие “жидкость – пар” в двухкомпонентных системах с полной взаимной растворимостью в жидкой фазе. Диаграмма состояния (
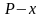 -
диаграмма
кипения при T=const)
для идеальной летучей двухкомпонентной
системы. Укажите фазовые поля (области)
диаграммы. Приведите уравнение линии
жидкости
-
диаграмма
кипения при T=const)
для идеальной летучей двухкомпонентной
системы. Укажите фазовые поля (области)
диаграммы. Приведите уравнение линии
жидкости
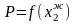 .
Изобразите схематически
-
диаграмму кипения (при
)
.
Изобразите схематически
-
диаграмму кипения (при
)
Совершенные (идеальные) растворы. Свойства идеальных растворов. Вывод уравнений, связывающих термодинамические функции смешения (GM, SM, HM и VM) с концентрацией образующегося раствора.
Определите равновесное давление углекислого газа над карбонатом кальция при температуре 925 К, если известно, что при температуре 850 и 1125 К оно составляет 1,3 и 307 мм рт. ст., соответственно.
ФИЗИЧЕСКАЯ ХИМИЯ ч. 1
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 04
Изохорная и изобарная теплоемкость. Зависимость теплоемкости от температуры и агрегатного состояния вещества. Теплоемкость идеального газа.
Анализ диаграмм кипения “давление-состав” “температура-состав” и “состав пара-состав жидкости” для систем, не образующих (образующих) азеотроп.
Классификация растворов. Способы выражения состава раствора, концентрация растворов, физическая и химическая теории растворов.
Рассчитать стандартное изменение энтропии и энергии Гиббса в реакции 2I → I2 при температуре 1200К. Воспользуйтесь 41 табл.
ФИЗИЧЕСКАЯ ХИМИЯ ч. 1
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 05
Внутренняя энергия и энтальпия системы, их взаимосвязь. Зависимость внутренней энергии и энтальпии от температуры, уравнения в дифференциальной форме. Интегрирование соответствующих уравнений. Графическая зависимость
 в широком температурном интервале,
включающем точки плавления и кипения
вещества
в широком температурном интервале,
включающем точки плавления и кипения
веществаЗапишите уравнение, выражающее правило рычага. Назовите входящие в это уравнение величины. Рассмотрите применение правила рычага на примере диаграммы кипения «температура – состав» (P=const) для двухкомпонентной системы без азеотропа (с азеотропом) (диаграмму выберите в справочнике). Покажите на диаграмме, до какой температуры следует нагреть жидкую систему произвольного состава
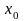 ,
чтобы количества равновесных жидкой
и паровой фаз, выраженные в молях, были
одинаковы?
,
чтобы количества равновесных жидкой
и паровой фаз, выраженные в молях, были
одинаковы?Парциальные молярные свойства (величины) компонентов раствора. Связь парциальных молярных свойств с общим свойством и составом системы. Термодинамическое обоснование уравнений Гиббса-Дюгема. Какую смысловую нагрузку несет каждое из этих уравнений? Аналитические и графические методы определения парциальных молярных величин.
Определите среднюю теплоту реакции FeCO3 → FeO + CO2 в температурном интервале 600-700 К. Воспользуйтесь данными о логарифмах констант образования.
ФИЗИЧЕСКАЯ ХИМИЯ ч. 1
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 06
Закон Гесса. Следствия из закона Гесса. Стандартные теплоты образования и сгорания. Их использование для нахождения тепловых эффектов химических реакций.
Поясните, почему температурная зависимость давления насыщенного пара индивидуального вещества, представленная в широком интервале температур в координатах
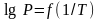 ,
представляется в виде двух линейных
участков с разными наклонами? Какие
величины могут быть определены по
тангенсу угла наклона соответствующих
прямых в указанных координатах?
,
представляется в виде двух линейных
участков с разными наклонами? Какие
величины могут быть определены по
тангенсу угла наклона соответствующих
прямых в указанных координатах?Температура замерзания (отвердевания) разбавленных растворов нелетучих веществ в летучем растворителе. Криоскопическая постоянная, ее связь со свойствами растворителя.
Определите равновесное давление углекислого газа над карбонатом магния при температуре 500 К, если известно, что при температуре 470 и 560 К оно составляет 6,8 и 410 мм рт. ст., соответственно.
ФИЗИЧЕСКАЯ ХИМИЯ ч. 1
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 07
Связь тепловых эффектов химических реакций при постоянном давлении и постоянном объеме.
Закон действующих масс и его термодинамическое обоснование. Термодинамическая и эмпирическая константы химического равновесия. Способы выражения эмпирической константы химического равновесия. Связь между эмпирическими константами равновесия
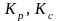 ,
,
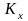 и
и
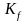 .
.Криоскопический и эбулиоскопический методы определения молярной массы растворенного вещества. Приведите выражение, используемое для определения молярной массы растворенного вещества криоскопическим (эбуллиоскопическим) методом и назовите входящие в него величины. Почему результат расчета по этому уравнению иногда называют кажущейся молярной массой? В силу каких причин кажущаяся молярная масса не совпадает с истинной (формульной) молярной массой? Введением какой величины удается устранить ошибку в определении молярной массы растворенного вещества?
Определите равновесное давление пара над масляной кислотой при температуре 50 оС.
ФИЗИЧЕСКАЯ ХИМИЯ ч. 1
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 08
Зависимость теплового эффекта химической реакции от температуры. Уравнение Кирхгофа, вывод. Интегральные формы уравнения. Применение уравнения Кирхгофа для расчета тепловых эффектов реакций и стандартной теплоты образования при
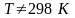 .
.Основные количественные характеристики химического равновесия: константа химического равновесия, степень превращения, степень диссоциации, равновесный выход, химическая переменная (глубина продвижения реакции). Поясните смысл этих величин на примере конкретных химических реакций.
Относительные парциальные молярные свойства (парциальные молярные функции смешения). Изменение термодинамических функций при образовании раствора из чистых компонентов (термодинамические функции смешения (
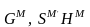 и
и
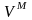 ).
Их связь с парциальными молярными
функциями смешения при образовании
раствора из чистых компонентов.
).
Их связь с парциальными молярными
функциями смешения при образовании
раствора из чистых компонентов.Определите температуру возгонки пентахлорида фосфора при внешнем давлении 0,1 атм.
ФИЗИЧЕСКАЯ ХИМИЯ ч. 1
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 09
Графические зависимости сумм теплоемкостей исходных веществ и продуктов реакции и теплового эффекта реакции от температуры {
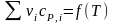 ,
,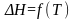 }.
Характер изменения теплового эффекта
}.
Характер изменения теплового эффекта
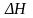 в зависимости от вида кривых
в зависимости от вида кривых
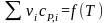 .
.Выражение константы равновесия через равновесный выход, степень превращения, степень диссоциации и равновесное давление в системе. Рассмотрите на произвольных примерах.
Идеальные растворы. Зависимость давления насыщенного пара от состава раствора, закон Рауля. Термодинамическое обоснование закона Рауля. Графические зависимости
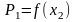 ,
,
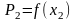 и
и
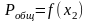 .
.Определите равновесное давление пара над октаном при температуре 0 оС.
ФИЗИЧЕСКАЯ ХИМИЯ ч. 1
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 10
Термодинамически обратимые и необратимые, самопроизвольные и несамопроизвольные процессы. Формулировки и математическое выражение второго начала термодинамики.
Эмпирическая константа химического равновесия. Влияние общего давления, примеси инертного газа и соотношения реагентов на константу химического равновесия и смещение химического равновесия (равновесный выход продуктов реакции, степень превращения, степень диссоциации исходного вещества).
Совершенные (идеальные) растворы. Свойства идеальных растворов. Вывод уравнений, связывающих термодинамические функции смешения (GM, SM, HM и VM) с концентрацией образующегося раствора.
Определите температуру кипения тетрахлорметана при внешнем давлении 0,1 атм.
