
Варианты билетов (заочное отд_1 сем. 3 курс) / Bilety_peresdacha_2_ch
.docxФИЗИЧЕСКАЯ ХИМИЯ ч. 2
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
– 01
Определите активность, среднюю ионную активность и среднюю ионную моляльность нитрата серебра в водном растворе при температуре 298 К, если моляльность электролита составляет 0,005 моль/кг.
Приведите пример химического гальванического элемента, составленного из газового электрода и электрода второго рода, электрохимическая цепь без жидкостных соединений - «без переноса». Запишите уравнения электродных полуреакций и уравнение химической реакции, за счет энергии которой вырабатывается электрическая энергия данным элементом.
Скорость химической реакции, основной постулат химической кинетики. Константа скорости гомогенной реакции, размерность константы скорости. Зависит ли константа скорости от концентрации реагентов и температуры и если да, то каким образом? Приведите соответствующие математические выражения.
Мономолекулярные газовые реакции в теории активных соударений. Схема Линдемана. Поясните, почему при низких давлениях мономолекулярные реакции протекают по 2-ому порядку?
ФИЗИЧЕСКАЯ ХИМИЯ ч. 2
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 02
Определите среднеионный коэффициент активности хлорида меди в водном растворе, содержащем 0,5*10-3 моль/кг хлорида меди и 0,5*10-3 моль/кг хлорида натрия, при температуре 25 оС.
Водородный электрод. Условная шкала потенциалов. Уравнение Нернста для потенциала водородного электрода. Зависимость потенциала электрода от рН раствора и давления молекулярного водорода. Область применения водородного электрода.
Последовательные реакции 1-го порядка. Кинетические уравнения и кинетические кривые для исходного вещества, промежуточного реагента и продукта реакции.
Схема Линдемана. Вывод кинетических уравнений, объясняющий изменение порядка газофазных реакций с ростом давления.
ФИЗИЧЕСКАЯ ХИМИЯ ч. 2
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 03
Определите растворимость хлорида серебра в воде и в водном растворе хлорида натрия с моляльностью 0,003 моль/кг при температуре 25 оС.
Газовые электроды, водородный электрод. Вывод и анализ уравнения, выражающего зависимость потенциала водородного электрода от активности водородных ионов и давления молекулярного водорода. Область применения водородного электрода.
Кинетика односторонней гомогенной реакции второго порядка A + B → P (концентрации A и B в момент начала реакции одинаковы). Изобразите кинетическую кривую для исходного вещества. Чему равен тангенс угла наклона касательной к кривой по отношению к оси абсцисс? Укажите координаты, в которых зависимость, соответствующая кинетической кривой, линеаризуется
Особенности протекания мономолекулярных реакций в газовой фазе. Механизм активации. Влияние давления (концентрации) на порядок мономолекулярной реакции. Схема Линдемана.
ФИЗИЧЕСКАЯ ХИМИЯ ч. 2
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 04
Определите молярную электропроводность при бесконечном разведении для нитрат аниона при температуре 25 оС, если известно, что молярная электропроводность при бесконечном разведении для нитрата натрия составляет 121,6*10-4 См*м2/моль, для хлорида натрия 126,5*10-4 См*м2/моль а для хлорид аниона 76,4*10-4 См*м2/моль.
Водородный электрод. Условная шкала потенциалов. Уравнение Нернста для потенциала водородного электрода. Зависимость потенциала электрода от рН раствора и давления молекулярного водорода. Область применения водородного электрода.
Дайте определение терминов «частный порядок», «полный порядок», «молекулярность» химической реакции. Связаны ли между собой молекулярность и порядок реакции, если да, то каким образом и в каком случае?
С чем связано наличие нижнего и верхнего пределов давления, между которыми разветвленная цепная реакция развивается со скоростью взрыва? От каких факторов зависят пределы воспламенения?
ФИЗИЧЕСКАЯ ХИМИЯ ч. 2
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 05
В кондуктометрическом опыте, при температуре 25 оС, было измерено сопротивление раствора водного раствора уксусной кислоты с разведением 25 л/моль. Сопротивление составило 2821 Ом. Площадь пластин кондуктометра составила 1,3 см2, а расстояние между пластинами 1,2 см. Определите pH, константу и степень диссоциации уксусной кислоты.
Электрохимическая форма уравнения Гиббса-Гельмгольца. Зависимость ЭДС гальванического элемента от температуры. Температурный коэффициент ЭДС.
Дайте определение термина "время полупревращения". Выведите уравнение для расчёта времени половинного превращения для односторонних гомогенных реакций 1-го и 2-го порядков, считая, что концентрации исходных веществ одинаковы. Для какой из этих реакций степень превращения будет выше по прошествии одного и того же времени от начала реакции?
Мономолекулярные газовые реакции в теории активных соударений. Схема Линдемана. Поясните, почему при низких давлениях мономолекулярные реакции протекают по 2-ому порядку?
ФИЗИЧЕСКАЯ ХИМИЯ ч. 2
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 06
Определите среднеионный коэффициент активности хлорида алюминия в водном растворе, содержащем 1,0*10-3 моль/кг хлорида алюминия и 2,5*10-3 моль/кг хлорида натрия, при температуре 25 оС.
Приведите пример электрода второго рода. Запишите электродную реакцию и уравнение Нернста для выбранного электрода. Влияние концентрации потенциалопределяющих ионов на потенциал электрода.
Кинетика односторонней гомогенной реакции второго порядка А + В → Р (концентрации А и В в момент начала реакции одинаковы). Изобразите кинетическую кривую для исходного вещества. Чему равен тангенс угла наклона касательной к кривой по отношению к оси абсцисс? Укажите координаты, в которых зависимость, соответствующая кинетической кривой, линеаризуется.
Назовите основные стадии неразветвленной цепной реакции. Дайте определения понятий «звено цепи» и «длина цепи». Укажите основные механизмы обрыва цепи.
ФИЗИЧЕСКАЯ ХИМИЯ ч. 2
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 07
Определите растворимость сульфата бария в воде и в водном растворе серной кислоты с моляльностью 0,002 моль/кг при температуре 25 оС.
Химические гальванические элементы. Приведите пример гальванического элемента, составленного из электродов первого и второго рода, электрохимическая цепь без жидкостных соединений - «без переноса». Запишите уравнения электродных полуреакций и уравнение химической реакции, самопроизвольно протекающей при включении данного гальванического элемента во внешнюю цепь.
Приведите дифференциальную и интегральную формы кинетического уравнения односторонней гомогенной реакции первого порядка, протекающей при постоянных температуре и объеме. Назовите величины, входящие в эти уравнения. Выведите выражение для времени полупревращения исходного вещества в данной реакции.
Поясните смысл понятий «линейный обрыв цепи» и «квадратичный обрыв цепи». Изменяется ли (и если да, то как?) вероятность обрыва цепи в каждом из двух названных механизмов с увеличением а) общего давления газовой смеси, б) размеров реакционного сосуда?
ФИЗИЧЕСКАЯ ХИМИЯ ч. 2
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 08
Определите молярную электропроводность при бесконечном разведении для ацетат аниона при температуре 25 оС, если известно, что молярная электропроводность при бесконечном разведении для ацетата натрия составляет 91,0*10-4 См*м2/моль, для хлорида натрия 126,5*10-4 См*м2/моль а для хлорид аниона 76,4*10-4 См*м2/моль.
Химические цепи с переносом. Уравнение Нернста для расчёта ЭДС гальванического элемента составленного из газового и окислительно-восстановительного электродов. Влияние рН на ЭДС элемента.
Односторонние реакции нулевого порядка. Вывод уравнения для расчета константы скорости реакции. Определение константы скорости из экспериментальных данных (графический метод).
Разветвленные цепные реакции в газовой фазе, основные стадии. Экспериментальные признаки цепных реакций. Какие внешние признаки позволяют сделать вывод о том, что изучаемая реакция относится к категории разветвленных цепных реакций?
ФИЗИЧЕСКАЯ ХИМИЯ ч. 2
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 09
Молярная и эквивалентная электропроводности растворов электролитов. Связь молярной электрической проводимости с абсолютными скоростями движения (подвижностями) ионов. Коэффициент электрической проводимости.
Рассчитайте ЭДС в нижеприведённой цепи при температуре 298 К:
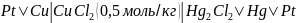
Приведите полуреакции, протекающую в электродах и реакцию, протекающую в элементе.
Вывод и анализ интегральной формы кинетического уравнения необратимой гомогенной реакции 1-го порядка. Изобразите схематически кинетические кривые для исходного вещества и продукта реакции, а также приведите математические выражения, описывающие ход этих кривых.
Назовите основные стадии неразветвленной цепной реакции. Дайте определения понятий «звено цепи» и «длина цепи». Укажите основные механизмы обрыва цепи.
ФИЗИЧЕСКАЯ ХИМИЯ ч. 2
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
21 – 10
Имеются данные о зависимости электропроводности раствора от концентрации электролита. Какие графические зависимости необходимо построить, чтобы получить ответ на вопрос – является данный электролит сильным или слабым? Какие характеристики растворов электролитов при этом могут быть определены.
Определите pH в кислородном электроде (№ 44 и 49), если ЭДС цепи составленной из насыщенного каломельного (№ 104) и исследуемого электродов составила 0,762 В. Температура 298К. Давление кислорода составило 5 атм. Приведите полуреакции, протекающую в электродах и реакцию, протекающую в элементе и условную запись элемента.
Последовательные реакции 1-го порядка
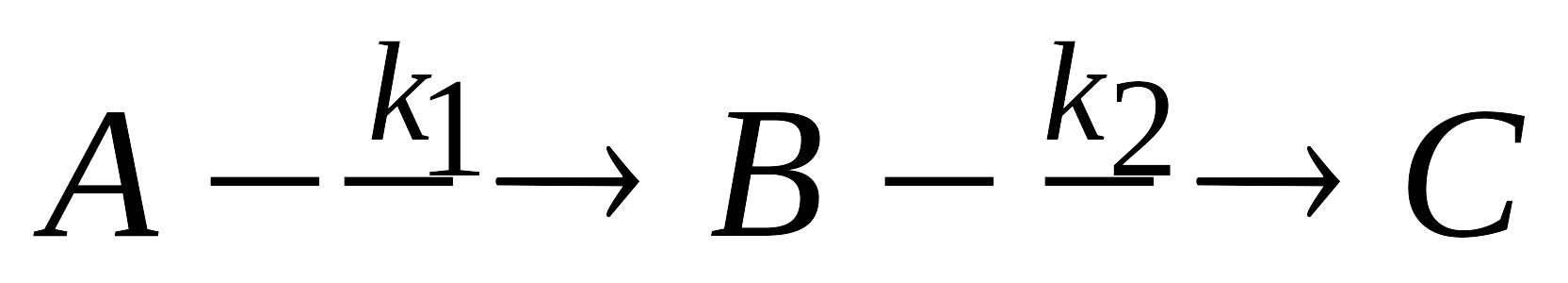 .
Кинетические уравнения и кинетические
кривые для исходного реагента,
промежуточного вещества и продукта
реакции. Как связаны между собой время
достижения максимальной концентрации
промежуточного вещества, и время,
соответствующее точке перегиба на
кривой изменения концентрации продукта
реакции со временем?
.
Кинетические уравнения и кинетические
кривые для исходного реагента,
промежуточного вещества и продукта
реакции. Как связаны между собой время
достижения максимальной концентрации
промежуточного вещества, и время,
соответствующее точке перегиба на
кривой изменения концентрации продукта
реакции со временем?Существуют два основных механизма обрыва цепи разветвленной цепной реакции. Назовите эти механизмы и поясните как изменяется вероятность обрыва цепи в соответствии с каждым из них при увеличении: а) общего давления газовой смеси; б) размеров внутреннего пространства реакционного сосуда.
