
- •Министерство здравоохранения и социального развития Российской Федерации
- •Тема : Способы выражения состава растворов. Приготовление растворов. Теоретический материал к занятию:
- •Формулы перехода от одних способов выражения состава раствора к другим
- •Тема: Способы выражения состава растворов. Приготовление растворов Решение задач
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Тема: Количественный анализ. Теоретический материал к занятию:
- •Домашнее задание:
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Лабораторная работа. Определение массы гидроксида натрия в растворе.
- •Тема: Принципы качественного анализа. Теоретический материал к занятию:
- •Лабораторная работа. Качественные и групповые реакции ионов.
- •Модуль №02.
- •Примеры решения типовых задач Пример 1
- •Пример 2
- •Пример 3.
- •Пример 4.
- •Пример 5.
- •Пример 6.
- •Пример 7.
- •Пример 8.
- •Пример 9.
- •Пример 10.
- •Для реакции
- •Пример 11.
- •Химическая термодинамика. Энергетика химических реакций.
- •Лабораторная работа. Определение стандартной энтальпии реакции нейтрализации.
- •Тема: Химическая кинетика. Теоретический материал к занятию:
- •Истинная скорость (в любой момент времени) определяется первой производной концентрации по времени:
- •Примеры решения типовых задач Пример 1
- •Определите порядок реакции
- •Пример 2
- •Пример 3
- •Пример 4
- •Пример 5
- •Для ответа на вопрос а) воспользуемся модифицированым уравнением:
- •Пример 6
- •Пример 7
- •Пример 8
- •Пример 9
- •Пример 10
- •Пример 11
- •Пример 12
- •Лабораторная работа. Определение кинетических характеристик реакции окисления йодид йонов пероксидом водорода. (Оценка практических навыков.)
- •Приготовление реакционной смеси.
- •Проведение измерений при комнатной температуре.
- •Проведение измерений при повышенной температуре.
- •Проведение измерений в присутствии катализатора.
- •Тема: Свойства водных растворов Теоретический материал к занятию:
- •Примеры решения типовых задач Пример 1
- •Пример 2
- •Пример 3
- •Пример 4
- •Пример 5
- •Пример 6
- •Пример 7
- •Лабораторная работа. Наблюдение явлений плазмолиза и гемолиза эритроцитов.
- •Свойства растворов
- •Протолитические равновесия и процессы
- •Примеры решения типовых задач
- •Пример 9
- •M(сн3соок)
- •0,0482 Моль/л 0,1 л 98 г/моль
- •Пример 16
- •Пример 20
- •Домашнее задание:
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Тема: Свойства буферных растворов. Лабораторная работа. Свойства буферных растворов, определение буферной емкости.
- •Экспериментальные данные
- •Расчет рН
- •Лигандообменные равновесия и процессы
- •Примеры решения типовых задач
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Изучение реакций комплексообразования с неорганическими лигандами.
- •Редокс-равновесия и редокс-процессы
- •Примеры решения типовых задач Пример 1
- •Пример 2 . Определение направления редокс-процесса в стандартном состоянии
- •Пример 3
- •Пример 4
- •Пример 5
- •Пример 6
- •Пример 7
- •Пример 8
- •Пример 9
- •Пример 10
- •Пример 11
- •Пример 12
- •Пример 13
- •Пример 14
- •После введения некоторого количества протолита значение редокс-потенциала системы уменьшается:
- •Пример 15
- •Пример 16
- •Пример 17
- •Пример 18
- •Пример 19
- •Ответ: эдс гальванического элемента равна 0,118 в.
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Изучение зависимости редокс-потенциала от соотношения концентраций окисленной и восстановленной форм
- •Изучение влияния лигандного окружения на редокс-потенциал
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Изучение влияния рН на редокс-потенциал.
- •Измерение рН растворов с помощью стеклянного электрода
Тема : Способы выражения состава растворов. Приготовление растворов. Теоретический материал к занятию:
Эквивалент – это реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции одному электрону.
Массовая
доля растворенного вещества ![]()
Х – растворенное вещество
Молярная концентрация,
![]()
Молярная
концентрация эквивалента 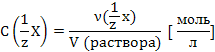
Фактор
эквивалентности, ![]()
Молярная
масса эквивалента, ![]()
Плотность
раствор, ![]()
Моляльная
концентрация, ![]()
Формулы перехода от одних способов выражения состава раствора к другим
|
Обозначение |
(Х) |
с(Х) |
сm(X) |
|
Массовая доля (Х)
|
|
с(Х) М(Х) 1000 |
____с(Х) М(Х)______ 1000 + с(Х) М(Х) |
|
Молярная концентрация с(Х), моль/л
|
(Х) 1000 М(Х) |
с |
сm(X) 1000 1000 + сm(Х)М(Х) |
|
Моляльная концентрация сm(X), моль/л
|
1000 (Х)__ (1 - (Х)) М(Х) |
___1000 с(Х)__ 1000с(Х)М(Х) |
сm |
Задача.
Какой объем соляной кислоты (ρ=1,070 г/мл) и воды необходим для приготовления раствора HCl объемом 200 мл и молярной концентрацией 0,1 моль/л для кислотно-основного титрования натрия тетрабората.
|
Дано |
Решение |
|
V (р-р) =200 мл = 0,2 л С (HCl) = 0,1 моль/л ρ (р-р) = 1,07 г/мл М (HCl) = 36,5 г/моль _____________________ m ( р-р HCl) и V (H2O) = ?
|
(m (р-р HCl) – неизвестна) |
2. Массу исходного раствора HCl можно рассчитать по формуле :
m (p-p HCl) = m (HCl) / V (HCl) (m (HCl) и V (HCl) – неизвестны)
3. Массовую долю ω можно найти в справочнике, зная плотность ρ исходного раствора HCl. Массу HCl можно рассчитать зная молярную массу вещества и количество вещества
m (HCl) = M (HCl) · n (HCl) (n (HCl) – неизвестно)
4. Количество вещества HCl можно рассчитать зная объем раствора и его концентрацию
n (HCl) = V (p-p) · C(HCl) (обе величины даны в условии задачи)
4.1 n (HCl) = 0,2 л · 0,1 моль/л = 0,02 моль
4.2 m (HCl) = 36,5 г/моль · 0,02 моль = 0,73 г
4.3 ω (%) = 14% или ω (в долях) = 0,14 (по таблице №14)
4.4 m (p-p HCl) = 0,73 г / 0,14 = 5,2 г
4.5 V (р-р HCl) = 5,2 г / 1,07 г/мл = 5мл
4.6 V(H2О) = 200 мл - 5 мл = 195 мл
Тема: Способы выражения состава растворов. Приготовление растворов Решение задач
1. Можно ли использовать для инъекций раствор хлорида натрия, с концентрацией 0,154 моль/л (плотность раствора 1,001 г/л.)?
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Рассчитайте молярную концентрацию раствора пероксида водорода с массовой долей вещества равной 3% (плотность раствора пероксида водорода 1,0058 г/л,.).
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Вычислите, какую массу раствора соли с массовой долей 10% следует взять для приготовления 100 г раствора той же соли с массовой долей, равной 6%.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Смешали по 100 мл растворов KI и КВr с концентрациями 0,1 моль/л. Какова стала концентрация ионов калия и йодид-ионов?
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
