
6-лекция-часть-1
.pdf
Аналитическая химия
Лекция 6
Комплексонометрическое титрование

План лекции:
1.Инструментальная индикация КТТ в комплексонометрии
2.Практическое применение методов комплексонометрического титрования
3.Органические аналитические реагенты
Учебная литература:
1.Аналитическая химия. Химические методы анализа
/под ред. О.М. Петрухина.
2.Окислительно-восстановительное и комплексонометрическое титрование. Практическое пособие / под ред. Кузнецова В.В.
3.Аналитическая химия. Химические методы анализа.
Лабораторный практикум / под редакцией доц. С. Л. Рогатинской

Инструментальные методы для индикации КТТ в комплексонометрии
Кондуктометрия
Регистрация изменения электропроводности титруемого раствора в ходе титрования
Потенциометрия
Регистрация изменения потенциала индикаторного электрода в ходе титрования
Вольтамперометрия
Регистрация изменения тока электролиза в ходе титрования
Спектрофотометрия
Регистрация изменения поглощения электромагнитного излучения видимого диапазона титруемого раствора в ходе титрования

Кондуктометрический метод анализа
Электропроводность [Ом-1 = См (сименс)] – величина,
обратная электрическому сопротивлению. = , где R
- сопротивление, d – расстояние между электродами (см), А – площадь электрода (см2), ρ – удельное сопротивление
Удельная электропроводность – ӕ, |
ӕ = |
|
|
|
|||
|
|
[ӕ ]=[Ом-1см-1] – электропроводность 1 см3 раствора, находящегося между электродами,
площадью 1 см2 каждый, расстояние между которыми 1 см.
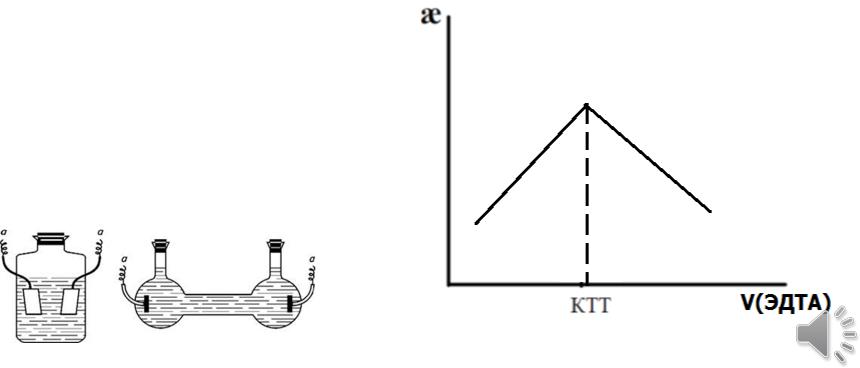
Кондуктометрическая индикация при комплексонометрическом титровании
Пример: кондуктометрическая индикация. Титрование солей Ni2+ раствором ЭДТА с кондуктометрической индикацией
Измеряют зависимость удельной электропроводности титруемого раствора от объема титранта (ЭДТА)
До ТЭ:
Ni2+ + H2 Y2- Ni Y2- + 2H+
После ТЭ:
H+ + H2 Y2- H4 Y

Молекулярная оптическая спектроскопия
Аналитическая молекулярная спектрометрия
Фотометрия (спектрофотометрия)
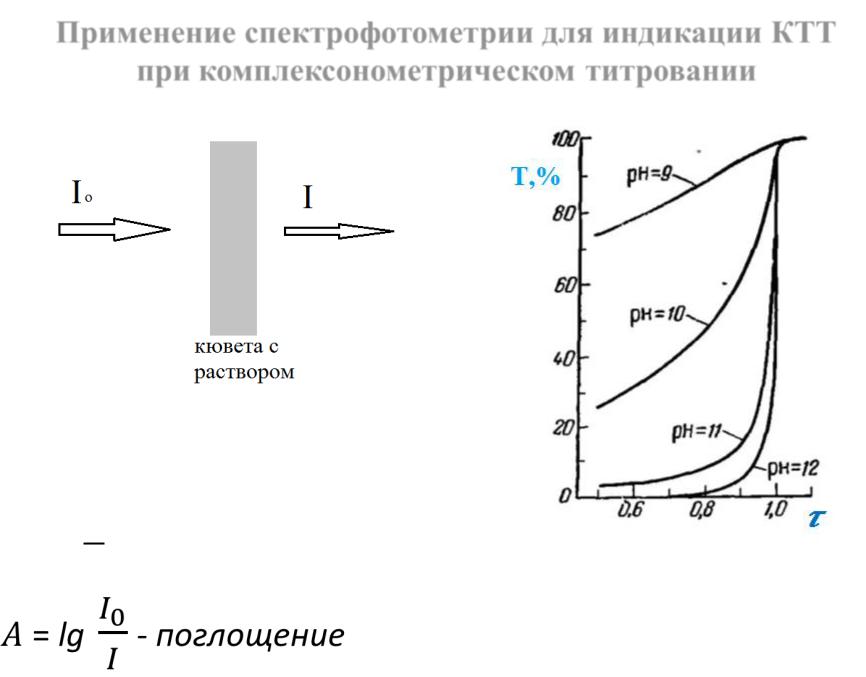
Применение спектрофотометрии для индикации КТТ при комплексонометрическом титровании
I0, I – интенсивности падающего и прошедшего потоков;
(%) =
- пропускание
MInd + Y4- → MY(4-n)- + Ind 

Практическое применение комплексонометрического титрования
1. Прямое титрование. Применяют для титрования ионов металлов, если lg βусл(MY) > 7-8 и есть подходящий индикатор.
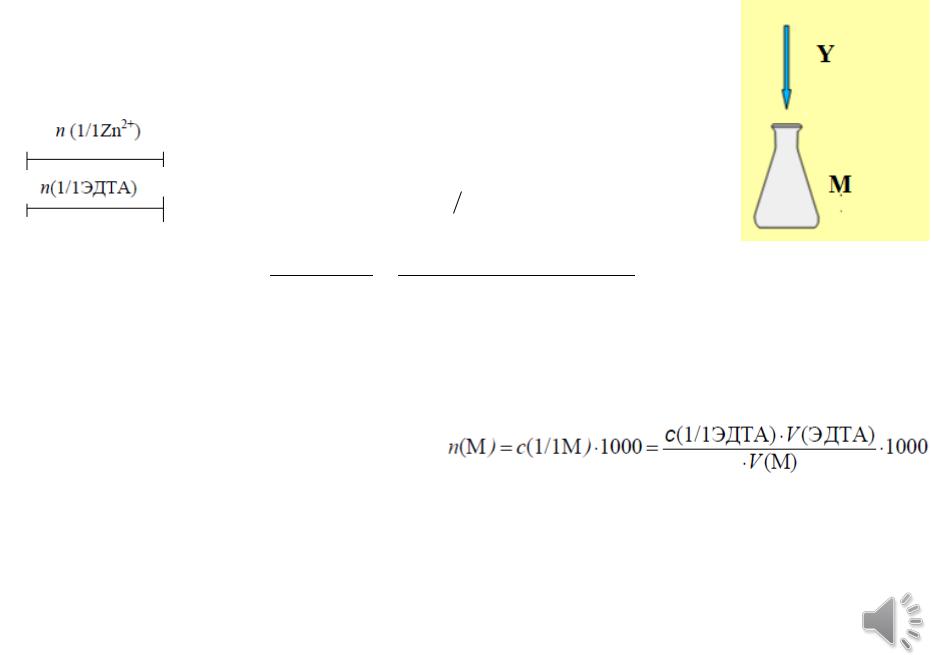
Определение ионов Zn2+ в растворе
Zn2+ + HY3– = ZnY2– + 3H+
fэкв(Zn2+) = 1/1; fэкв(HY3–) =1/1
|
Схема расчета для метода прямого титрования: |
||||||
|
|
|
n(1/1Zn |
2 |
) n(1 1ЭДТА) |
||
|
|
|
|
|
|||
n(1/1Zn |
2 |
) |
m(Zn) |
|
|
c(1/1ЭДТА) V (Э ДТА) |
|
|
M (1/1Zn) |
1000 |
|||||
|
|
|
|
|
|||
Определение общей жесткости воды
Жесткость воды выражают числом миллимоль эквивалентов металлов в 1 литре воды.
рН 10: |
Ca2+ + HY3– = CaY2– + H+ |
|||||
|
Mg2+ + HY3– = MgY2– + H+ |
|||||
f (Ca2+) = 1/1; f |
экв |
(Mg2+) = 1/1; f |
экв |
(HY3–) =1/1 |
||
экв |
|
|
|
|||
Схема расчета: |
|
n(1/1Ca2 ) n(1/1Mg2 ) n(1/1ЭДТА) |
||||
n(1/1Ca |
2 ) n(1/1Mg |
2 ) c(1/1M) V (M) c(1/1ЭДТА) V (ЭДТА) |
||||
|
|
|
|
1000 |
1000 |
|

Раздельное комплексонометрическое определение ионов кальция и магния при их совместном присутствии
1.Определение общего содержания ионов кальция и магния при рН 10.
2.Последующее определение в отдельной пробе ионов кальция при рН 12.
Схема расчета (прямое титрование): |
|||||
При рН 10: |
|
|
|
||
n(1/1Ca |
2 |
) n(1/1Mg |
2 |
) n |
(1/1ЭДТА) |
|
|
||||
|
|
|
|
1 |
|
При рН 12: |
|
|
|
||
n(1/1Ca |
2 ) n (1/1ЭДТА) |
|
|||
|
|
2 |
|
|
|
n(1/1Ca2 ) n(1/1Mg |
2 ) n |
(1/1ЭДТА) |
c(1/1ЭДТА) V1(Э ДТА) |
||||||
|
|||||||||
|
|
|
|
|
1 |
|
|
|
1000 |
n(1/1Ca |
2 |
) n |
|
(1/1ЭДТА) |
c(1/1ЭДТА) V |
2 |
(Э ДТА) |
||
2 |
|
|
|
||||||
|
1000 |
|
|||||||
|
|
|
|
|
|
|
|||
