
Добавил:
Pirozhochek
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:Семинары и лекции Обручниковой / Семинары.pdf
X
- •Семинары по физической химии 1 часть
- •Физическая химия
- •Теория
- •Задачи
- •Второй закон термодинамики
- •Объединенное выражение I и II начал термодинамики. Зависимость энтропии от параметров состояния
- •Типы задач
- •Рассчитайте изменение энтропии при изобарном нагревании 1 моль хлора от температуры 300 до 500 К. Воспользуйтесь справочными данными о зависимости теплоемкости хлора от температуры.
- •Рассчитайте изменение энтропии в реакции синтеза аммиака при температуре 598 К и давлении 1 атм.
- •Типы задач
- •Рассчитайте изменение энергии Гиббса, если в результате расширения 20 кг гелия при 298 К объем газа увеличился в 1 000 раз. Газ считать идеальным.
- •Рассчитайте изменение энергии Гельмгольца, если в результате сжатия 500 моль кислорода при 400 К давление газа увеличилось в 100 раз. Газ считать идеальным.
- •Расчет изменения энергии Гиббса при смешении идеальных газов
- •Рассчитайте изменение энергии Гиббса и энергии Гельмгольца при стандартных условиях и температуре 400 К для реакции H2 + 1/2O2 = H2O(ж), считая температурный коэффициент энергии Гиббса величиной постоянной. Воспользуйтесь справочными данными.
- •Рассчитайте изменение энергии Гиббса и энергии Гельмгольца при стандартных условиях и температуре 400 К для реакции H2 + 1/2O2 = H2O(ж), считая температурный коэффициент энергии Гиббса величиной постоянной. Воспользуйтесь справочными данными.
- •Уравнение Гиббса-Гельмгольца
Семинары по физической химии 1 часть
Преподаватель:доценткафедры физическойхимии, к.х.н.
Обручникова Яна Андреевна
Физическая химия
•наука о закономерностяххимических процессов;
•объясняети количественноописывает свойства химическихвеществ,химические процессыи фазовые превращенияс помощьюзаконов физики.
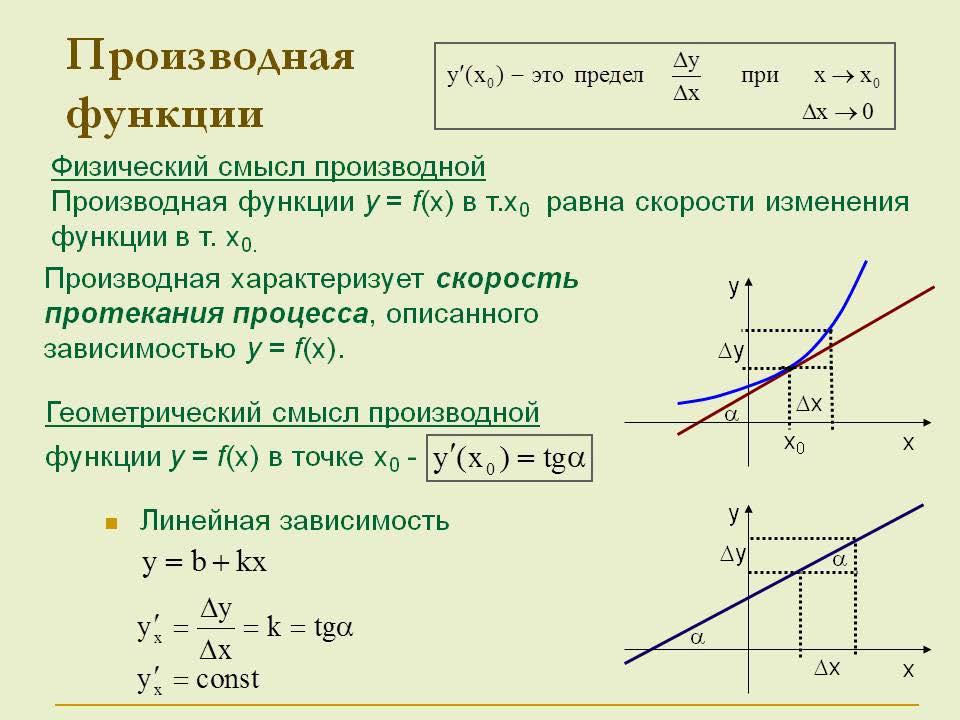


Производная |
|
|
|
|
|
|
Интеграл |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+1 |
+ |
|||
′ = ∙ −1 |
|
|
= + 1 |
|||||||
|
|
|
= + |
|||||||
|
′ |
1 |
|
|
|
|||||
|
= |
|
|
|
|
|
|
|
|
|
∙ ′ = ′ |
∙ + ∙ |
|
= + |
|||||||
lna – lnb = ln (a/b) |
|
|
||||||||
|
|
|
|
|
|
|
+1 |
+1 |
||
|
|
|
|
|
|
= + 1 |
− + 1 |
|||
Соседние файлы в папке Семинары и лекции Обручниковой
