
Семинары и лекции Обручниковой / Семинар_Фазовое равновесие
.pdf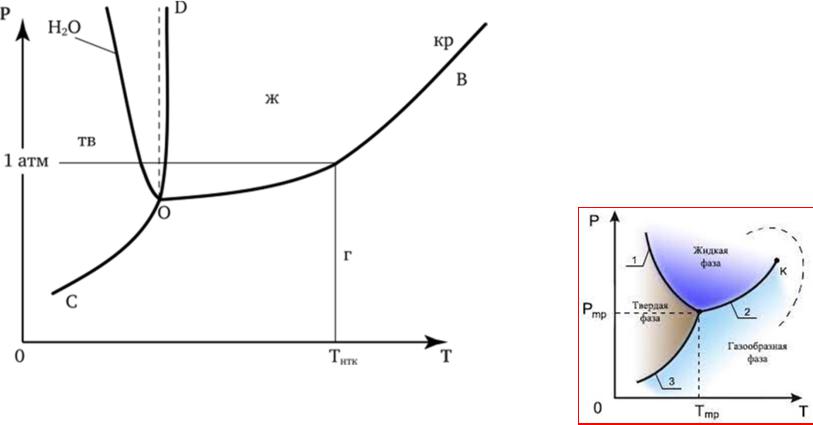
Фазовое равновесие в однокомпонентных системах
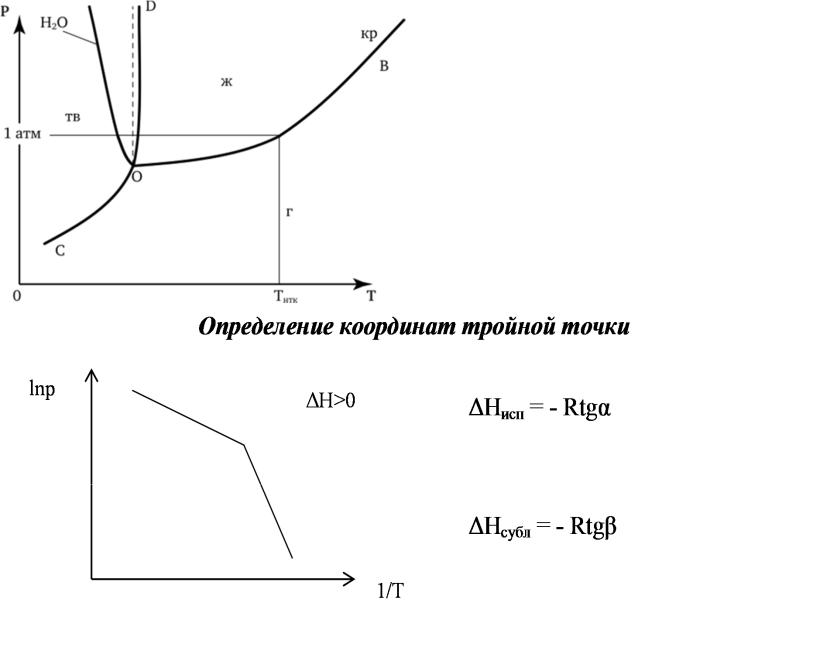
Диаграмма фазовогоравновесия однокомпонентной системы (диаграмма состояния):
Неверно изображать сильныйнаклонлинии плавления
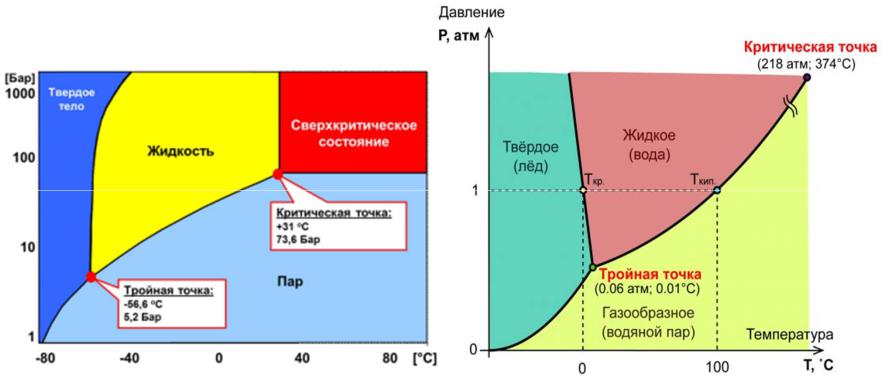
Фазовое равновесие в однокомпонентных системах
Тпл увеличивается с увеличением |
Тпл уменьшаетсяс увеличением |
|
давления (H2O, Ga, Bi); Vпл < 0; Vж < Vтв; |
||
давления (CO2); Vпл > 0; Vж > Vтв; ρж < ρтв |
||
ρж > ρтв |
||
|
Правило фаз Гиббса: f = k – ф + 2

Уравнение Клапейрона
 фп
фп
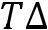
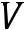 фп
фп
уравнение Клапейрона – для всех фазовых переходов.
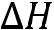 пл
пл
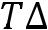 пл
пл
– для плавления.
Vпл = Vж – Vтв
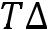 пл
пл
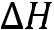 пл
пл
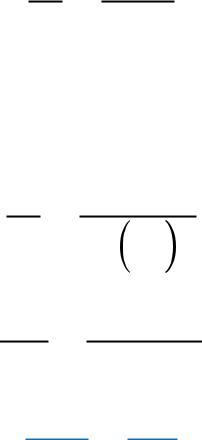
Уравнение Клапейрона Клаузиуса
∆ фп
∆ фп
Допущения:
•при температурах далеких от критических Т<< Ткр Vпар >> Vконд. фазы, поэтому можно считать, что V = (Vпар Vконд. фазы) ≈ Vпар
•при Т<< Ткр поведение пара не отличается от свойств идеального газа. Тогда
для 1 моль газа пар |
. Подставляем объем пара в уравнение Клапейрона. |
∆исп/субл
∆исп/субл
уравнение Клапейрона Клаузиусаиспользуется для процессов парообразования и сублимации.

Зависимость температуры плавления калия от давления выражается уравнением: T = 335,65 + 1,56∙10 2P – 6,8∙10 7P2 (P, атм). Определить теплоту плавления при давлении 100 атм, если температура плавления равна 337,2 К и изменение объема при плавлении составляет 0,0265 см3/г.
|
|
|
|
|
|
|
|
|
|
∆ |
пл |
|
|
|
|
|
|
Vпл = Vж – Vтв |
|
|
|
|
|
|
|
|
|
∆ пл |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
∆ пл |
|
|
|
|
|
|
|
|
|
|
dT |
|
|
|
|
|
∆ |
пл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
1,56 10 |
2 |
–13,6 10 |
7 |
P |
|
|
|||||||
При р = 100 атм |
2 |
|
dp |
|
|
|
5 град |
||||||||||
dT |
1,56 10 |
–13,6 10 |
7 |
100 |
|
0,015 |
град |
0,015 10 |
|||||||||
dp |
|
|
|
|
атм |
Па |
|||||||||||
|
|
|
|
|
∆ |
|
пл |
|
∆ пл |
|
|
|
Дж |
|
|||
|
∆Hпл |
337,2 |
|
0,0265 |
10 |
|
59,6 |
|
|||||||||
|
|
0,015 10 5 |
|
|
г |
|
|||||||||||
Теплота плавления бензола при температуре 5,6 °С и давлении 1 атм составляет 128 Дж/г. Изменение объема при плавлении составляет 1,3∙10 2 см3/г. Определить температуру плавления при давлении 100 атм.
|
|
|
|
|
|
|
∆ пл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆ |
∆ пл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆ пл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆ |
пл |
|
|
|
|
|
|
|
|
dp |
|
∆Hпл |
|
128 |
|
|
∆ пл |
Па |
|
Па° |
|
|
атм |
||
|
|
|
3,5 |
10 |
3,5 10 |
350 |
|
||||||||
dT |
|
T∆Vпл |
278,6∙ |
1,3∙10−2∙10−6 |
К |
|
С |
°С |
или К |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
278,6 |
3,5 |
1 |
100 |
1 |
10 |
278,87 К |
10 |
Зависимость давления пара для твердого и жидкого вещества от температуры выражается следующим образом:
тв |
10,648 |
2559,5 |
,мм рт.ст. |
ж |
7,540 |
1511,3 |
,мм рт.ст. |
Определить координаты тройной точки и теплоту плавления в тройной точке.
В тройной точке линии возгонки ( |
тв |
) и испарения ( |
ж |
) пересекаются. |
||
10,648 |
2559,5 |
7,540 |
1511,3 |
|
||
337,3 ; |
1148 ммрт.ст. |
|
|
|||
2,3
∆ |
возг |
∆ |
пл |
∆ |
исп |
∆ возг |
∆ исп ∆ пл |
∆ |
пл |
∆ |
возг |
∆ |
исп |
|
кДж |
∆ пл 2,3 8,31 2559,5 |
2,3 8,31 |
1511,3 |
20,04 |
моль |
|||
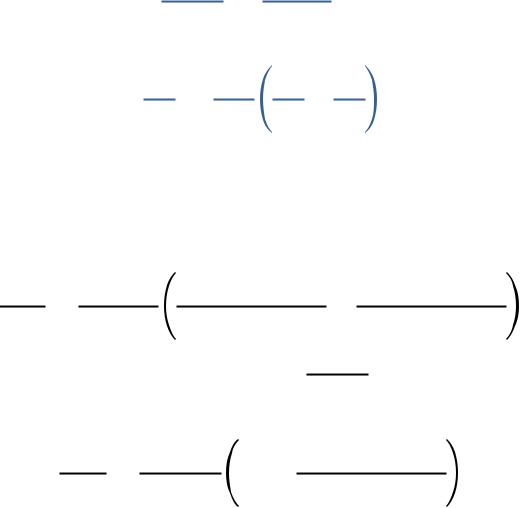
Найти температуру кипения ацетона при давлении 0,6 атм, если температура нормального кипения (Тнтк) равна 56,2 °С, используя справочные данные (табл. 24).
исп
Температура нормального кипения температура, при которой давление насыщенного пара жидкости становится равным 1 атм.
1 атм = 760 мм рт. ст.
0,6 атм = ?
760 |
исп |
° |
|
1 |
|
|
|
|
1 |
|
||
400 |
8,31 |
39,5 |
|
|
273 |
56,2 |
273 |
|||||
|
|
|
|
° |
32,87 |
кДж |
|
|
|
|||
|
760 |
|
исп |
моль |
|
|
||||||
|
|
32 870 |
1 |
|
|
|
1 |
|
|
|||
|
456 |
|
8,31 |
|
|
|
|
56,2°С |
273 |
|
||
|
|
|
|
|
|
|
||||||
|
|
|
|
315,8 К |
42,8 |
|
|
|
||||
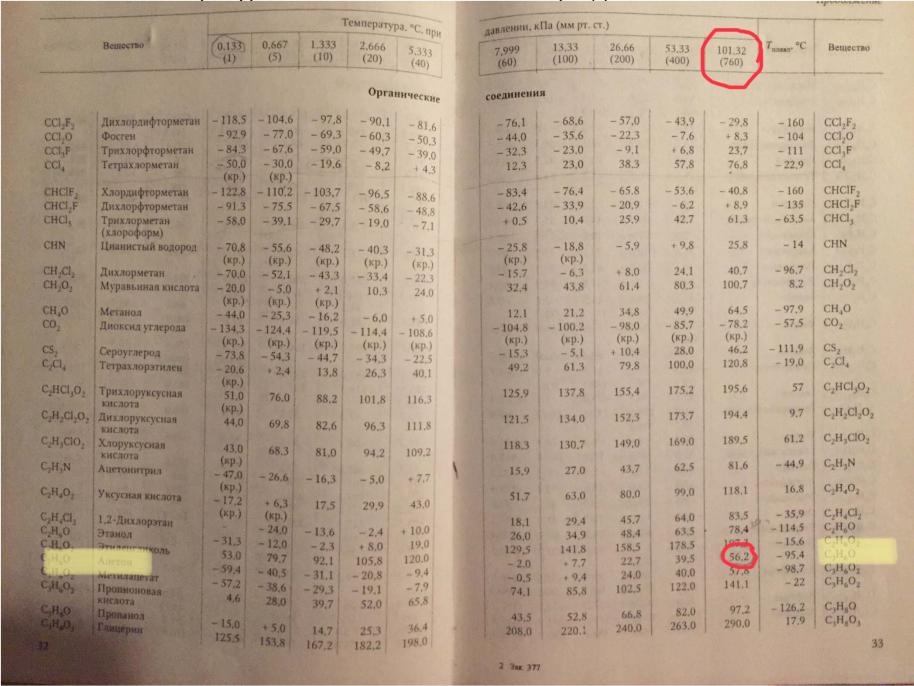
Температуры возгонки или кипения при давлении ≤1 атм
