
Семинары и лекции Обручниковой / Лекция 13_Обручникова Я.А._Коллигативные свойства
.pdf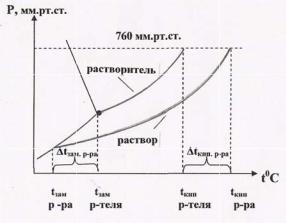
Лекция №13
Разбавленные растворы нелетучих веществв летучи х раств рителях.
Подчиняются закону Рауля для разбавленных растворов: |
|||
В разбавленных растворах относительное понижение давление пара |
|||
рас ворител |
|
|
, понижение темпер туры на ала отвердевания раствора и |
|
|
||
повышение |
температуры начала его кипен я в сравнении с чист ым |
||
рас ворител м не зависят от п |
рироды растворенных веществ и определяются |
||||||||||
только отношением |
исла мо |
лекул (моль) растворенного вещес ва к числу |
|||||||||
молекул (моль) растворителя, |
т.е. концентрацие . |
|
|
|
|
||||||
Свойства предельно |
разбавл нных р створов, |
не |
зависящие от |
природы |
|||||||
рас воренного |
вещества, а |
зависящи |
только |
от |
конц ентрации |
|
раствора, |
||||
являются коллигативными |
|
свойствами. Если |
кон центрации |
равны, |
|||||||
коллигативные |
сво ства |
о |
динаковы. |
Если |
раство р приготовлен |
из |
|||||
нескольких, |
величина колли |
гативного |
свойства |
определяется |
значением |
||||||
суммарной концентрации. В |
еличина коллига ивного свойства |
позвол ет |
|||||||||
определить |
олекулярную массу раств ренного вещества. |
|
|
|
|||||||
К коллигативным свойствам относятся: |
|
|
|
|
|
|
|||||
1) понижение дав ения пар а растворителя н д раствором по сравнени |
с |
||||||||||
давлением пара чистого растворителя |
|
|
|
|
|
||||||
2) понижение температуры |
начала |
отвердевания (за мерзания) |
раствора |
||||||||
(раств ры в отличие от индивид альных веществ кипят/отвердевают в |
|||||||||||
интервале температур) |
|
|
|
|
|
|
|
|
|||
3) |
повышение температуры начала ипения раствора нелетучего вещества |
|
в лету ем растворителе по сравнению с температу рой кипения чистого |
|
растворителя |
4) |
осмотическое давление |
|
Диаграмма фазового равновесия на примере воды (растворитель) и ра твора. |
Физическая химия I. Доцент каф ы физической хи ии РХТУ им. Д.И. Менделеева Обручникова Я.А.

Относительное понижение давления пара растворителя
1
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
/
/
Такой способ определения молекулярной массы растворенного вещества плох тем, что очень сложно технически точно измерить давления. На практике используют другие методы.
Понижение температуры начала замерзания раствора
Раствор нелетучего вещества в летучем растворителе кристаллизуется при более низкой температуре, чем растворитель.
∆ зам ∆плпл 1000
пл
∆пл 1000
K – криоскопическая постоянная. Чем выше криоскопическая постоянная, тем больше при данной концентрации понижается температура начала отвердевания раствора.
В конце 19 века этот метод определения молекулярной массы растворенного вещества был очень популярен. Термометр Бекмана позволяет измерять температуру с точностью до 0,001 К.
1000
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

1000
∆ зам
Повышение температуры начала кипения раствора
Раствор нелетучего вещества в летучем растворителе кипит при более высокой температуре, чем растворитель.
∆ |
|
кип |
|
кип |
∆исп |
1000 |
|
|
|
кип |
|
|
|
∆исп |
1000 |
E – эбулиоскопическая постоянная. Чем выше эбулиоскопическая постоянная, тем больше при данной концентрации повышается температура начала кипения раствора.
1000
1000
∆ кип
K>E поэтому для раствора понижение температуры замерзания больше повышения температуры кипения.
Осмос
Осмос – способность чистого растворителя проникать в раствор через полупроницаемую мембрану (в растворе химический потенциал меньше).
Осмотическое давление – давление, при котором прекращается проникновение растворителя через мембрану. Или если речь идет о двух растворах с разной концентрацией, разделенных мембраной, то это осмотическое давление – это дополнительное давление, приложение которого к раствору с более высокой концентрацией, останавливает поступление в него растворителя через полупроницаемую мембрану. Если это дополнительное давление превышает осмотическое, то будет происходить обратный осмос – переход из более концентрированного раствора в менее концентрированный (фильтры очистки воды, процесс опреснения морской воды).
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

Метод определения молекулярной массы растворенного вещества по осмотическому давлению незаменим при определении молекулярных масс высокомолекулярных соединений. Криоскопия и эбулиоскопия недостаточно чувствительны – значения изменения температур замерзания/кипения на уровне 0,001 К.
Почему морская рыба не может не может жить в пресной воде? – Клетки обладают свойством полупроницаемых мембран. Вода транспортируется во внутриклеточный раствор. Клетка набухает и может разорваться.
На чем основан принцип консервирования? Плазмолиз – при помещении клетки в сильно концентрированный раствор вода из клетки будет переходить в раствор. Клетка микроорганизма коллапсирует в концентрированных растворах соли или сахара. Для заживления раны можно засыпать ее солью или сахаром.
Осмос обеспечивает подъем воды от корней деревьев до вершины.
Изотонический коэффициент Вант-Гоффа
В ходе экспериментов было обнаружено, что для водных растворов солей, оснований и кислот понижение давления пара и температуры замерзания больше, чем ожидалось. Был введен коэффициент Вант-Гоффа i.
∆зам
∆кип
Величина коэффициента i зависит от природы растворенного вещества и его концентрации. i>1 за счет увеличения числа частиц растворенного вещества при его диссоциации, i<1 – при ассоциации. Появление этого коэффициента инициировало появление теории электролитической диссоциации.
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

Выражение для изотонического коэффициента Вант-Гоффа получено основоположником теории электролитической диссоциации Аррениусом.
Физический смысл изотонического коэффициента – отношение суммарной концентрации всех форм растворенного вещества к концентрации исходной формы.
1 1
11
1
1
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
