
Семинары и лекции Обручниковой / Лекция 10 (фазовое равновесие)
.pdfЛекция №10
Фазовое равновесие в однокомпонентных системах
Системы подразделяются на гомогенные и гетерогенные. Гетерогенные системы состоят из различных по физическим и химическим свойствам частей, разграниченных поверхностями раздела. Гетерогенные системы называют неоднородными, а в зависимости от числа фаз -2-х, 3-х и многофазными. Фаза – гомогенная часть гетерогенной системы, ограниченная поверхностью раздела, имеющая макроскопические размеры и характеризующаяся одинаковыми физическими и химическими свойствами во всех своих точках.
Число фаз в равновесной системе не может быть произвольным.
Равновесное состояние термодинамической системы характеризуется совокупностью термодинамических параметров, например, p, T. Число фаз, присутствующих в системе, может изменяться при изменении термодинамических параметров. f, (v, c)
Число термодинамических степеней свободы системы (или вариантность системы) – число параметров, которые можно произвольно изменять без изменения числа фаз. В зависимости от числа степеней свободы различают системы:
инвариантные (нонвариантные), где f = 0
моновариантные, где f = 1
бивариантные (дивариантные), где f = 2
и т.д.
Число степеней свободы может быть равно нулю или целому положительному числу.
Составляющие системы, компоненты, независимые компоненты
Составляющие вещества – вещества, которые могут быть выделены из системы и существовать вне системы. Пример: водный раствор NaCl. NaCl, H2O, но не ионы натрия и хлора.
Если в системе не протекают химические реакции, то каждое из веществ, составляющих систему, является компонентом. Пример: водный раствор
NaCl. 2 компонента NaCl, H2O.
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
Если в системе имеются вещества, способные к химическому взаимодействию, то концентрации этих веществ взаимосвязаны и для того, чтобы определить состав системы, нет необходимости указывать концентрации всех веществ. Если в системе происходят химические реакции, то применяют понятие независимый компонент. Наименьшее число индивидуальных веществ, достаточное для выражения состава любой фазы системы, называется числом независимых компонентов.
Число независимых компонентов (k) равно числу составляющих веществ (k’) минус число реакций (q):
k = k’ – q
CaCO3 (тв) = CaO + CO2 k = 3 – 1 = 2
Правило фаз Гиббса
Рассматриваем гетерогенную систему, состоящую из k компонентов, находящихся в ф фазах. В качестве независимых переменных принимаем p, T и k – 1 концентраций (концентрации в массовых или мольных % или мольных долях). Для двухкомпонентной системы достаточно указать одну концентрацию. В таком случае правило фаз Гиббса имеет вид:
f = k – ф + 2
или f = k’ – q – ф + 2
(v = k – p + 2)
Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов влияют только p и Т, равно числу независимых компонентов минус число фаз плюс два. Число степеней свободы (вариантность системы) – число параметров, характеризующих состояние системы, изменение которых произвольно (независимо друг от друга) в известных пределах не приводят к изменению природы и числа фаз в системе.
Если состояние системы определяется, кроме p и T, еще одним внешним фактором (например, значением напряженности электрического поля, световым излучением), правило фаз будет иметь вид:
f = k – ф + 3
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

В общем случае, если число внешних факторов равно n:
f = k – ф + n
Если p или T = const, то есть n = 1:
f = k – ф + 1
Если p и T = const, то есть n = 0:
f = k – ф
Правило фаз позволяет подсчитать:
максимальное число фаз гетерогенной системы с заданным числом компонентов;
сколько параметров, определяющих состояние системы можно менять произвольно без изменения числа фаз в системе.
f = k – ф + 2 |
|
f = k – ф + 2 |
2 = k – ф + 2 |
|
0 = k – ф + 2 |
k = ф |
|
ф = k + 2 |
k =1, ф =1 |
|
Максимальное число фаз ф = k + 2 |
Минимальное число |
фаз в |
ф = 1 + 2 = 3 |
однокомпонентной |
системе |
в однокомпонентной системе равно |
равно единице |
|
трем. |
Примером однокомпонентной системы может служить простое вещество или химическое соединение, обладающее строго определенным составом во всех агрегатных состояниях: вода, сера, углекислый газ.
При нарушении условий фазового равновесия происходит переход вещества из одной фазы в другую, называемый фазовым переходом.
Если при фазовом превращении происходит изменение объема (и соответственно, плотности сосуществующих фаз) превращение называют фазовым переходом I рода. При фазовом переходе I рода претерпевают скачки первые производные от термодинамического потенциала по соответствующим ему параметрам.
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

Скачкообразно изменяются H, U, S, мольный V.
К фазовым переходам I рода относят: |
|
|
||
|
плавлени (кристаллизация) |
|
|
|
|
тв ↔ ж |
|
|
|
|
парообразование (конденсация) |
|
|
|
|
↔ пар |
|
|
|
|
сублимация (десублимация) |
|
|
|
|
тв ↔ пар |
|
|
|
|
полиморфные |
превращения, |
при |
кот орых изменяется |
кристаллическая структура твердого вещества
тв α (1) ↔ тв β (2)
Фазовая диаграм ма (диа рамма состояния)
- графическое изображение всех возмо ных фазовых состояний тер модинам ческой системы в пространстве координат основных параметров или функций состояния систем ы.
Диаграммы |
могут быть трехмерными, например, p- V-T |
диаграмма |
для |
||
однокомпон нтной системы. Мы |
будем |
рассматриват ь |
двухмерные |
p-T |
|
диаграммы |
одноко понентных |
систем. |
Для построения диаграм мы |
||
используют экспериментальн ые данные. Каждому реаль но существующему сос оянию системы на диаграмме состояния отвечает определенная точка,
наз ываемая фигуративной.
p-T диаграмма однокомпонентной системы
Физическая химия I. Доцент каф ы физической хи ии РХТУ им. Д.И. Менделеева Обручникова Я.А.
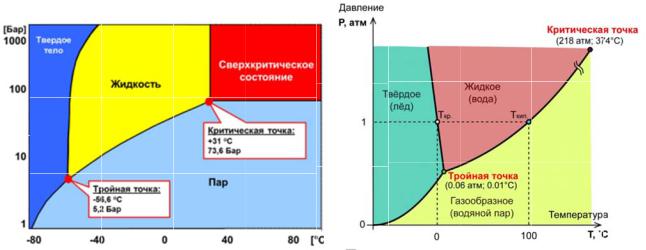
Тпл увеличивается с увеличением |
Тпл уменьшается с увеличением |
давления (CO2); ΔVпл > 0; Vж > Vтв; |
давления (H2O , Ga, Bi); ΔVпл < 0; |
ρж < ρтв |
Vж < Vтв; ρж > ρтв |
Рассмотрим диаграмму состояния воды более подробно. |
|
|
|
|
Каждой фазе |
на диа рамме соответст ует свое фазовое |
поле тв, ж, пар. |
В |
|
пределах фазового поля число степеней свободы системы равно д ум. |
|
|||
f = k – ф + 2 |
|
|
|
|
f = 1 – 1 |
2 = 2 |
|
|
|
Это означает, что одновремен ное изменение p и Т не |
вызывает изменения |
|||
числа фаз. |
|
|
|
|
Кривые линии диаграммы обозначаю т границы однофазных областей |
и |
|||
соответству |
т равновесию д вух фаз. Число степеней |
свободы на каждой |
||
кривой линии равно единице. |
|
|
|
|
f = 1 – 2 |
2 = 1 |
|
|
|
ОD – равновесие жидкости и твердого тела T = f(p) – кри вая плавления |
|
|||
СО – равновесие твердого тела и н сыщенн го пара |
p = f(T) – |
кривая |
||
сублимации |
|
|
|
|
ОB – равно есие жидкости и насыщенного пара p = f(T) или Tкип |
= f(p |
– |
||
кривая испа ения (парообразования). ривая п рообразо вания о рываетс |
в |
|||
точке, назы аемой критической. При критической температуре плотно ть
жидкости равна плотности пар а, ΔHисп = 0. В критической точке k = 1, ф = 1, q = 2 – дополнительн ые услови я устойчивости при pкр,Tкр
Физическая химия I. Доцент каф ы физической хи ии РХТУ им. Д.И. Менделеева Обручникова Я.А.

0
0
f = k – ф + 2 – q = 1 – 1 + 2 – 2 = 0
В критической точке ∆ исп 0, ∆ исп 0, ∆ исп 0.
Температурой кипения вещества называют температуру, при которой давление его насыщенного пара равно внешнему давлению.
Нормальной температурой кипения (Тнтк) называют температуру кипения при внешнем давлении 1 атм.
Кривые двухфазных равновесий пересекаются в тройной точке.
Согласно правилу фаз: f = k – ф + 2, k = 1, ф = 3, f = 1 – 3 + 2 = 0
Это означает, что сосуществование трех фаз (ж, тв и г) возможно только при определенных p и Т.
Для воды ТТТ = 273,16 К, рТТ = 609 Па. Эта температура отличается от Тпл = 273,15 К при р = 1 атм.
Существуют вещества, у которых тройная точка располагается при давлении выше атмосферного, например, СО2. В таких случаях при внешнем давлении 1 атм не существует равновесия ж ↔ пар и твердое вещество переходит сразу в паровую фазу (сублимируется).
Уравнение Клапейрона-Клаузиуса
Рассмотрим общий случай двухфазного равновесия
фаза′ ↔ фаза″ (ж ↔ пар, ж ↔ тв, тв ↔ пар).
При равновесии химические потенциалы фаз равны μ′ = μ″
Следовательно, равны и энергии Гиббса G′ = G″ (для чистого вещества μ = G для 1 моль). Для того, чтобы перевести систему из одного равновесного состояния в другое, нужно одновременно изменить р и Т так, чтобы
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

dG′ = dG″
На фазовой диаграмме это выражается перемещением фигуративной точки по кривой равновесия
dG = Vdp – SdT
В таком случае
V′dp – S′dT = V″dp – S″dT
или
(S″– S′)dT = (V″ – V′)dp
или
ΔSфпdT = ΔVфпdp
∆ фп ∆ фп
При обратимом фазовом переходе
∆ |
фп |
∆ |
фп |
||
|
фп |
||||
|
|
|
∆ |
фп |
|
|
|
|
∆ фп |
||
|
|
|
|||
- уравнение Клапейрона – уравнение p = f(T) соответствующих функций равновесий.
Анализ уравнения Клапейрона
Рассмотрим применение уравнения тв ↔ ж
∆ пл ∆ пл
ΔVпл = Vж - Vтв – изменение объема при плавлении Уравнение переписываем в виде
∆ пл ∆ пл
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

Величина , характеризующая изменение температуры с изменением
внешнего давления, может быть положительной или отрицательной. Это означает, что температура плавления может повышаться или понижаться с увеличением внешнего давления.
Для большинства веществ температура плавления повышается с увеличением
внешнего давления. Тпл > 0, ΔVпл > 0 (Vж > Vтв), ΔHпл > 0. Кривая плавления наклонена вправо от оси давления.
Для воды ΔVпл < 0 (Vж < Vтв), |
0. Кривая плавления наклонена влево |
от оси давления. Температура плавления уменьшается с увеличением давления.
Температура плавления слабо зависит от изменения давления. Кривая плавления идет почти вертикально. Тогда уравнение
∆ пл ∆ пл
можно записать в виде
∆∆ пл
∆∆ пл
Показать расчет теплоты плавления
Для равновесий ж ↔ пар, тв ↔ пар
∆исп/субл
∆исп/субл
∆ исп/субл 0, ∆ исп/субл |
пар |
тв |
0, исп/субл 0 |
0. |
Таким образом, при равновесном парообразовании (сублимации) |
||||
Это означает, что с увеличением температуры увеличивается давление насыщенного пара, а увеличение внешнего давления приводит к повышению температуры кипения (сублимации).
Уравнение Клапейрона-Клаузиуса для равновесий ж ↔ пар, тв ↔ пар
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

Клаузиус преобразовал уравнению к более удобному виду для практического применения.
Допущения:
при температурах далеких от критических Т<< Ткр Vпар >> Vконд. фазы, поэтому можно считать, что
ΔV = (Vпар - Vконд. фазы) ≈ Vпар
при Т<< Ткр поведение пара не отличается от свойств идеального
газа. Тогда для 1 моль газа |
пар |
. Подставляем объем пара в |
||||
уравнение Клапейрона. |
|
∆ |
исп/субл |
|
||
|
|
|
|
|||
∆ исп/субл
Уравнение применимо для 1 моль вещества для процессов парообразования и сублимации. Уравнение Клапейрона-Клаузиуса аналогично уравнению изобары Вант-Гоффа.
Интегрирование уравнения Клапейрона-Клаузиуса. Определение среднего теплового эффекта испарения или возгонки.
Разделим переменные
Если H = const
1 1
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
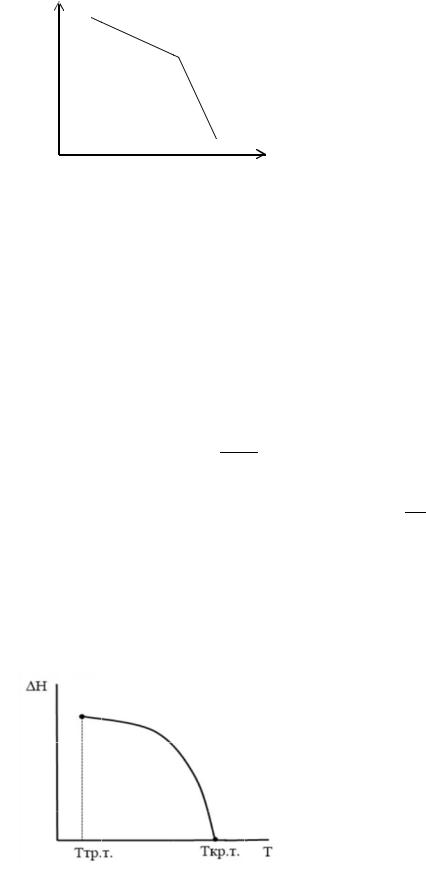
Определение координат ройной точки. Графическое определение реднего теплового эффекта испарения и возгонки.
lnp |
|
исп |
H >0 |
ΔHи п = - Rtg α |
|
|
|||
|
|
|||
|
|
|
возг |
ΔHс бл = - Rtgβ |
|
|
|
|
1/Т
Константу интегрирования находят, подставля в уравн ение прямой ΔH, р при определенной те ператур е.
В ш ироком интервале температур (более 200 К) завис имость l p – 1/T не является линейной. Наклон линии уме ьшается с повышением температуры,
что обусловлено уменьшением ΔHисп с |
величением T. |
||
Если ΔH = f(T), необходимо |
уч сть |
зависимость теплоемкости от |
|
температуры. |
|
|
|
∆ |
Спар |
Сж |
∆С |
∆С ∆ ∆ ∆
Теплоемкость пара всегда меньше теплоемкости жидкости.
Теплота испарения |
|
при невысоки |
|
темпе |
ратурах |
мало зависит от |
||||
температуры. При |
|
риближении температуры |
к кри тической |
∆ |
резко |
|||||
стр мится к нулю. В |
п |
ритичес кой точке |
∆ |
исп |
, |
, |
исп |
= 0 |
|
|
|
|
|
|
∆ исп ∆ |
|
|
|
|||
Эт |
схематично. Ниж е из справочника: |
Физическая химия I. Доцент каф ы физической хи |
ии РХТУ им. Д.И. Менделеева Обручникова Я.А. |
