
Семинары и лекции Обручниковой / Лекции 11-12_Обручникова Я.А._Растворы
.pdfЛекция №11
Растворы. Парциальные молярные величины.
Классификация растворов: идеальные, бесконечно разбавленные, неидеальные.
Идеальные растворы (бесконечно разбавленные растворы) – растворы, при образовании которых в результате смешивания чистых, находящихся в одном агрегатном состоянии веществ для всех составов, соблюдаются следующие условия:
∆0
∆0
∆
∆
Примеры: газовые системы, растворы гомологов с большой молекулярной массой, оптических изомеров в примерно равных соотношениях.
Для идеальных растворов сила взаимодействия разноименных частиц равна силе взаимодействия одноименных:
Неидельные растворы (положительные и отрицательные отклонения)
см следующую лекцию
Состав раствора выражается через величину, независящую от температуры: мольная доля, моляльность, молярная концентрация, массовая доля (проценты).
Парциальные молярные величины
L – свойство раствора,
Li0 – свойство чистого вещества
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

ni – число молей i-ого компонента
Вследствие ежмолекулярных взаимодействий:
Парциальная |
молярная величина |
оказывает на |
сколько изменится |
экстенсивно |
е свойство раствора при добавлени к бесконечно большому его |
||
количеству |
одного моль компонента при p, T = const |
и постоя стве чисел |
|
молей всех других компонентов.
, ,
Уравнение Гиббса-Д гема
,
Любое экстенсивное свойство раствора являет я аддити вным относительно парциальных мольных свойств компонентов, об азующих раствор.
Для одного оль раствора:
,
Методы определения парциальных олярных величи н
ПМВ находят в результате обработки эксперимен тальных данных о зави симости общего свойства раствора от состава.
Ме тод касательных
Построить зависимость общего свойс ва раствора от числа молей второго компонента при постоянстве числа молей перв го компонента. Зависимость описывается полиномным ура внением.
(На |
г |
рафике вместо “L” |
ис |
пользуется обозначени |
е |
“Ф”) |
|
|
|
|
|
|
|||
Физи |
ческая химия I. Доцент каф ы физической хи |
ии РХТУ |
учникова Я.А. |
||||
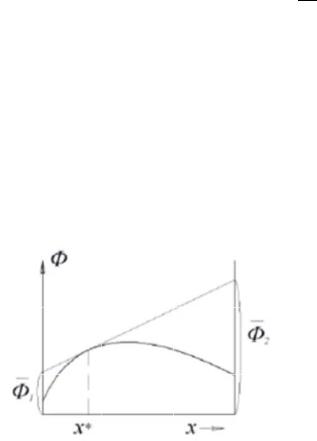
Построить касательн е. Взять произво ную от полиномной зависимости.
|
|
, , |
2 |
3 |
|
|
|||||
Подставляем n, определяем . |
|
|
|
||
Для нахождения П МВ другого |
компонента |
|
пользуемся уравнением |
||
Гиббса-Дюгема: |
|
|
|
||
Ме тод отрезков (пе есечени й)
Применим т олько для бинарны х систем.
Построить зависимо ть общего свойства раствора, отн есенног к 1 моль рас вора, от мольной доли.
Построить касательные. Определить ПМВ при конкретной концентрации (могут быть отрицательными).
(На графике вместо “L” используется обозначение “Ф”)
Относит льные парциальные мольные величины (функции с мешения)
ОПМВ – разность между ПМ В i-ого компонента и мольной величиной тог же свойства в ст ндартном состоя ии (ч стое вещество):
∆
Физическая химия I. Доцент каф ы физической хи ии РХТУ им. Д.И. Менделеева Обручникова Я.А.
К ОПМВ применимо уравнение Гиббса-Дюгема:
∆ ∆ ∆
∆
Для идеального раствора:
0, |
0, |
, |
Избыточные функции
идеал
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

|
Лекция №12 |
|
Активность. Коэффициент активности. |
Для |
количественной характеристики отклонения от идеальности |
Г.Н. Льюисом предложено использовать функцию активности: |
|
|
ст |
где |
– летучесть компонента над раствором заданной концентрации, ст – |
летучесть компонента в стандартном состоянии.
Если пар подчиняется законам идеальных газов, то летучесть заменяется на давление:
ст
В случае если в качестве стандартного состояния выбрано чистое вещество и его агрегатное состояние совпадает с состоянием растворителя и раствора:
где – давление насыщенного пара чистого компонента при температуре раствора.
Для идеальных растворов:
°
Для неидеальных растворов:
ст
Отсюда активность – величина, подстановка которой в уравнения для идеальных растворов, делает их применимыми для неидеальных растворов; зависит от концентрации и температуры.
Активность – действующая или эффективная концентрация компонента в растворе.
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

Помимо активности характеристикой отклонений свойств компонента от идеальности является коэффициент активности. В идеальных растворах коэффициент активности равен единице, так как активность совпадает с мольной долей. В неидеальных растворах:
1
Экспериментально для определения активности и коэффициента активности необходимо определить давление пара компонента над раствором и в чистом виде.
1 – при положительных отклонений
1 – при отрицательных отклонений
Системы стандартных состояний для компонентов в растворах.
Выбор стандартного состояния учитывает природу процессов, происходящих при образовании раствора, - эффекты, связанные с диссоциацией и ионизацией растворенного вещества при переходе его в состояние раствора. В соответствии с этим используются две системы стандартных состояний – симметричная и несимметричная.
Симметричная система стандартных состояний
Неэлектролиты (спирты) и металлы при переходе в раствор (для металлов – сплав) сохраняют свою примерную молекулярную или атомарную форму. Для таких систем в качестве стандарта состояния выбирается чистое вещество, агрегатное состояние которого совпадает с состоянием раствора (ж. для спиртов, тв. Для металлов). Такая система стандартных состояний называется симметричной, т.е. одинаковой как для растворенного вещества, так и для растворителя.
При симметричной системе стандартных состояний:
→ |
→ 1при |
→ 1 |
при |
→ 0 |
|
|
→ 1при |
→ 1 |
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
→ |
при → 0 |
Коэффициент активности каждого из компонентов бинарного раствора стремится к единице при его концентрации, стремящейся к единице, и – к некоторому постоянному числу при концентрации, стремящейся к нулю.
Система является симметричной, так как оба компонента существуют в виде чистых веществ, а также, потому что для обоих веществ зависимость коэффициента активности от концентрации одинакова.
Симметричная система используется, когда агрегатные состояния растворенного вещества и растворителя совпадают с состоянием этих веществ в чистом виде.
Несимметричная система стандартных состояний
Несимметричная система используется, когда при переходе в раствор растворенное вещество принципиально изменяет свое состояние, а состояние растворителя не меняется (NaCl и вода). Выбирается для растворов электролитов. Растворенное вещество переходит в ионизированную форму.
Для растворителя в качестве стандартного состояния берут чистое вещество, а для растворенного вещества – его состояние в гипотетическом бесконечно разбавленном растворе (ионы находятся на огромном расстоянии, можно пренебречь межионным взаимодействием, то есть учитывается только взаимодействие ионов с растворителем).
При несимметричной системе стандартных состояний:
→ |
→ 1при |
→ 1 |
при |
→ 0 |
|
|
→ 1при |
→ 0 |
На основании активности и коэффициента активности можно определить значение парциальной мольной энергии Гиббса смешения:
Для энтропии смешения использовать активность нельзя, так как она зависит от температуры, а в формуле температура не учитывается.
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

Предельно разбавленные растворы.
Термодинамическое обоснование закона Рауля. Закон Генри.
Предельно разбавленные растворы могут считаться идеальными. Границу, начиная с которой, раствор можно считать предельно разбавленным, можно определить с помощью неэмпирических критериев.
– для бинарного раствора
∑ – для многокомпонентного раствора
Втаком случае присутствие растворенного вещества практически не будет сказываться на свойствах растворителя, и раствор можно считать идеальным. Допустим, что это действительно так, и выясним, какими свойствами должно было бы обладать в этом случае растворенное вещество.
Для растворителя химический потенциал в растворе и в паре одинаков:
пар ж
Если считать пар идеальным газом, а жидкость – идеальным раствором, тогда
° пар |
|
° ж |
||
|
|
|
|
|
∙
Выражаем p1:
°ж ° пар
Выражение под экспонентой не содержит величин, зависящих при фиксированной температуре от концентрации раствора, и, так как при x1→1 давление пара растворителя над раствором будет стремиться к давлению насыщенного пара чистого компонента (p1→p10), тогда
Для растворенного вещества обратимся к уравнению Гиббса-Дюгема. Для одного моль бинарного раствора при постоянной температуре:
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

0
Так как для растворителя справедлив закон Рауля:
1и
В интегральном виде:
ln
∙Кг ∙
-аналитическое выражение закона Генри: парциальное давление пара растворенного вещества над предельно разбавленным раствором
пропорционально мольной доле растворенного вещества. Кг – коэффициент пропорциональности (константа Генри).
Если раствор |
идеальный, то |
Кг. |
Если |
отклонения |
положительные |
||
Кг |
. |
Если |
отрицательные |
. Константа Генри |
имеет смысл |
||
|
|
|
Кг |
|
|
|
|
давления |
насыщенного пара |
растворенного |
вещества, находящегося в |
||||
гипотетическом состоянии бесконечно разбавленного раствора.
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
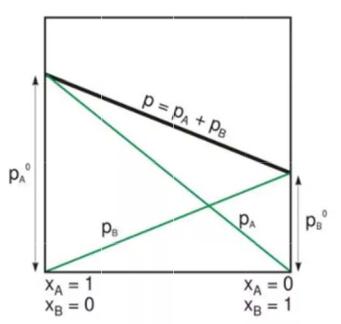
В предельно разбавленном растворе поведение растворителя подчиняется зако ну Рауля, а поведение растворенно о вещества – закону Генри.
Закон Рауля для идеальных астворов
0, |
0, |
, |
Положительн е отклонения от закона Рауля
0, |
0, |
∑ |
, |
0, |
∑ |
0 |
Кг ∙
Физическая химия I. Доцент каф ы физической хи ии РХТУ им. Д.И. Менделеева Обручникова Я.А.
