- •Тема: Белки I. Механизмы переваривание и всасывания белков
- •Роль белка в питании. Показатели качества пищевого белка
- •Количество белка в некоторых пищевых продуктах
- •3. Азотистый баланс. Принципы нормирования белка в питании. Белковая недостаточность
- •Нормы белка в питании
- •Белковая недостаточность
- •Переваривание белков в жкт
- •Переваривание белков в желудке
- •Нарушения переваривания белков в желудке
- •Защита клеток от действия протеаз
- •Регуляция желудочно-кишечной секреции
- •Нарушение переваривания белков и транспорта аминокислот
- •4. «Гниение» белков в кишечнике. Роль удф-глюкуроновой кислоты и фафс в процессах обезвреживания и выведения продуктов «гниения» (фенол, индол, скатол, индоксил и др.). Гниение
- •Лекция № 18 Тема: Белки II. Общие пути обмена аминокислот. Биосинтез мочевины.
- •2 Курс.
- •Пути образования пула аминокислот в крови и его использование в организме
- •Общие реакции обмена аминокислот
- •Трансаминирование (переаминирование) аминокислот
- •Дезаминирование аминокислот
- •Прямое дезаминирование ак
- •2. Оксидаза l-аминокислот
- •3. Оксидаза d-аминокислот
- •Пути обмена безазотистого остатка аминокислот
- •Связывание (обезвреживание) аммиака
- •Орнитиновый цикл
- •Гипераммониемия
- •Обмен аминокислот и аммиака между тканями
- •Декарбоксилирование аминокислот и их производных
- •Лекция № 19 Тема: Белки III. Специфические пути обмена аминокислот
- •2 Курс. Фолиевая кислота
- •Кобаламин (в12)
- •Обмен серина и глицина
- •Путь образования оксалатов из глицина
- •Метионин
- •Цистеин
- •Фенилаланин
- •Тирозин
- •1. Обмен тирозина в надпочечниках и нервной ткани
- •2. Обмен тирозина в меланоцитах
- •3. Превращение тирозина в щитовидной железе
- •5. Катаболизм тирозина в печени
- •Триптофан
- •Глутамат
- •Глутамин
- •Аспартат
- •Аспарагин
Лекция № 18 Тема: Белки II. Общие пути обмена аминокислот. Биосинтез мочевины.
Факультеты: лечебно-профилактический, медико-профилактический, педиатрический.
2 Курс.
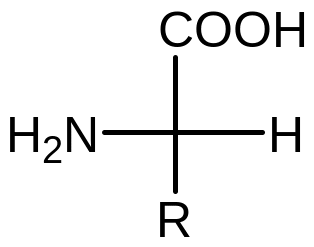
Аминокислоты (АК) – органические соединения, содержащие –СООН и -NH2 в α-положении. Почти все АК имеют хиральный атом и обладают оптической изомерией. У человека присутствуют L-аминокислоты.
|
|
Всего известно около 300 видов АК, у человека в организме - 70, а в составе белков - 20.
Физико-химические свойства аминокислот
АК белые кристаллические вещества, хорошо растворимые в воде. Имеют высокую температуру плавления, в твердом состоянии находятся в виде внутренней соли. Многие сладкие на вкус (гли).
АК амфотерные вещества – проявляют свойства кислот и оснований.
К наиболее важным общим реакциям АК относятся реакции:
декарбоксилирования,
переаминирования,
дезаминирования,
образование пептидных связей
образование оснований Шиффа (при гликозилировании белков).
Специфические реакции АК связаны с наличием функциональных групп в радикале (окислительно-восстановительные реакции цис).
Существует несколько классификаций аминокислот.
Классификация АК по природе радикала: 1). алифатические (гли, ала, вал, лей, иле и.т.д.); 2). ароматические (фен, тир, три, гис); 3). гетероциклические (про, оксипро).
Классификация АК по количеству карбоксильных и аминогрупп: 1). нейтральные; 2). кислые (глу, асп); 3) основные (арг, лиз).
Классификация АК по функциональным группам в радикале: 1). содержащие –ОН (сер, тре); 2). содержащие –SH (цис, мет); 3). содержащие –СОNH2 (глн, асн);
Классификация АК по способности к синтезу:
АК, которые синтезируются в организме, называют заменимыми (глицин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, серии, пролин, аланин).
АК, которые не синтезируются в организме, но для него необходимы, называются незаменимыми (фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин).
Аргинин и гистидин - частично заменимые АК, у взрослых они образуются в достаточных количествах, а у детей - нет. Поэтому, необходимо дополнительное поступление этих АК с пищей.
Тирозин и цистеин — условно заменимые, так как для их синтеза необходимы незаменимые АК (фенилаланин и метионин).
Функции аминокислот
Используются для синтеза белков, углеводов, липидов, нуклеиновых кислот, биогенных аминов (гормонов, нейромедиаторов), других аминокислот
Служат источником азота при синтезе всех азотсодержащих небелковых соединений (нуклеотиды, гем, креатин, холин и др);
Выполняют регуляторную функцию (гли, глу - нейромедиаторы);
служат источником энергии для синтеза АТФ.
Пути образования пула аминокислот в крови и его использование в организме
Большая часть аминокислот организма человека, примерно 15кг, входит в состав белков. Фонд свободных АК организма составляет примерно 35г.
Источниками АК в организме являются белки пищи, белки тканей и синтез АК из углеводов. В сутки у человека распадается на АК около 400г белков, примерно такое же количество синтезируется. Специальной формы депонирования АК, подобно глюкозе (в виде гликогена) или жирных кислот (в виде ТГ), не существует (исключение - казеин молока). Поэтому резервом АК служат все белки тканей, но преимущественно белки мышц (т.к. их много).