
- •Общие пути обмена аминокислот.
- •Синтез аминокислот
- •Азотистый обмен
- •Биологическая ценность белков.
- •Аминокислоты как лекараственные препараты.
- •Пути обезвреживания аммиака.
- •Синтез заменимых аминокислот
- •Индивидуальные пути обмена аминокислот. Обмен глицина и серина.
- •Нарушения обмена дофа-амина
- •Обмен цистеина и метионина.
- •Обмен дикарбоновых аминокислот.
- •Обмен фенилаланина и тирозина.
- •Распад пуриновых оснований.
- •Распад пиримидиновых оснований.
- •Распад пуриновых оснований.
- •Матричные биосинтезы.
- •Репликация.
- •Этапы биосинтеза днк.
- •Механизм транскрипции днк
Обмен дикарбоновых аминокислот.
Глутаминовая кислота – моноаминодикарбоновая, заменимая, глюкогенная.
Необходима для трансдезаминирования аминокислот:

![]()

Связывает NH3 в нервных клетках, прямо на месте, по мере образования:
 +NH3 + АТФ
+NH3 + АТФ


Глн входин в полипептидную цепь белка, это продукт обезвреживания NH3.



Это процесс сохранения кислотно-щелочного равновесия.
Основной
щелочной эквивалент Na+,
его нельзя терять с мочой.Na+
реабсорбируется, процесс регулируется
гормонально. ВместоNa+
выводится
![]() .
.
Глутамин является возбудительным медиатором, в процессе метаболизма превращается в тормозной медиатор.

![]()
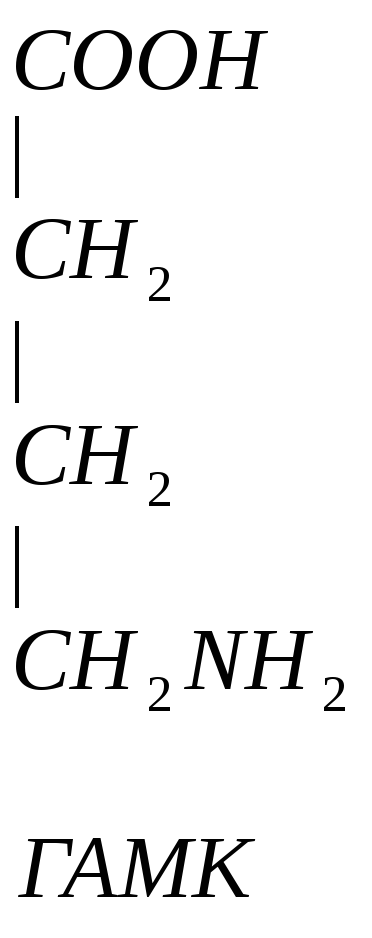


![]()

![]() -аланин
– заменимая, глюкогенная АМК, много в
машечной ткани.
-аланин
– заменимая, глюкогенная АМК, много в
машечной ткани.
Здесь существует 2 цикла глю – лак и глю – ала.

Пируват аминируется или трансаминируется и образуется ала. Благодаря этому:
меньше образуется лактата
связывается определенное количество NH3 (его много в работающей мышце за счет дезаминирования).
В виде аланина NH3 идет в печень, где обезвреживается путем синтеза мочевины.
Аргинин – диаминомонокарбоновая кислота, заменимая, гликогенная.
О
 тдача
гуанидиновой группы в видеNH2-CО-NH2
(мочевины)
тдача
гуанидиновой группы в видеNH2-CО-NH2
(мочевины)Отдача на гли гуанидиновой группы и образование креатина. При этом образуется орнитин NH2-(CH2)3-CH(NH2)-COOH. Его мало в пищевых продуктах, он не входит в белки, но он необходим для синтеза мочевины.
Основа для синтеза орнитина – аргинин.
Аспарагиновая кислота – моноаминодикарбоновая кислота, заменимая, гликогенная.
У
 частвует
в обезвреживанииNH3 с
образованием аспарагина (связыв.NH3
в 10 раз меньше, чем глу). Асн входит в
полипептидную цепь (в геноме есть
триплет).
частвует
в обезвреживанииNH3 с
образованием аспарагина (связыв.NH3
в 10 раз меньше, чем глу). Асн входит в
полипептидную цепь (в геноме есть
триплет).При дезаминировании превращается в ЩУК.
Два источника ЩУК
а) асп (энергонезависимый путь)
б) Карбоксилирование пирувата (энергозависимый путь).
Без ЩУК не идет ЦТК, невозможен для многих веществ путь превращения в глю, т.е. глюконеогенез.
Асп – основа для синтеза пиримидиновых оснований. 4 положения из асп кислоты (по Лениджиру только 3) 2 остальных положения из карбомаилфосфата. Обезвреживание NH3 связано с синтезом пиримидиновых оснований.

Асп
 источник
источник
 и
и
 -аланина
(встречается в КоА, кранозин,
ансериндипептиды – находится в мышечной
ткани.)
-аланина
(встречается в КоА, кранозин,
ансериндипептиды – находится в мышечной
ткани.)
В других тканях таких дипептидов мало, нужны для функционирования мышечной ткани и повышения физической работоспособности.

Обмен триптофана.
Триптофан – незаменимая кислота.

В физиологических условиях 95% триптофана окисляются по кинурениновому пути и не более 1% по серотониновому.
Основной обмен триптофана приводит к синтезу НАД, уменьшая потребность организма в витамине РР.

Обмен фенилаланина и тирозина.
Фен – незаменимая аминокислота. Тирозин может синтезироваться из фенилаланина. Глюко-кетогенные аминокислоты.


Синтез катехоламинов (адреналина, норадреналина)

Синтез тироксина.

Обмен разветвленных аминокислот.
Вал, лей, илей.
Незаменимые аминокислоты.
Вал
![]() глю
(пропионил-КоА
глю
(пропионил-КоА
![]() сукцинил-КоА
сукцинил-КоА
![]() глю)
глю)
Лей![]() кетокислота
кетокислота
Илей
![]() глю
+ кето (ацетил-КоА + пропионил-КоА)
глю
+ кето (ацетил-КоА + пропионил-КоА)
![]()
фумарат
![]()
глю
Лейцин

![]()


![]()

![]()


![]()
![]()

![]()
![]() -ОМГ-КоА
-ОМГ-КоА
Ацетоацетат Ацетил-КоА
Структура и свойства нуклеопротеидов.
Функция нуклеопротеидов заключается в хранении и передаче наследственной информации.
Состоят из белков и нуклеиновых кислот. Простетической группой нуклеопротеидов является нуклеиновая кислота.
При легком гидролизе белок дает пептиды, а нуклеиновые кислоты дают нуклеотиды или нуклеозиды.
При жестком гидролизе образуются аминокислоты, азотистые основания (аденин, гуанин, урацил, цитозин, тимин), рибоза, дезоксирибоза.
Виды нуклеиновых кислот
|
Признаки |
ДНК |
РНК |
|
I. Химическое строение |
|
|
|
а) производные пурина |
А, Г |
А, Г |
|
б) производные пиридина |
Ц, Т |
Ц, У |
|
в) углеводы |
Дезоксирибоза-5-фосфат |
Рибоза-5-фосфат |
|
г) Фн |
Н3РО4 |
Н3РО4 |
|
д) минорные основания |
+ |
+ + + |
|
II. Локализация |
Ядро, митохондрии |
Ядро, цитоплазма |
|
III. Содержание |
Неизменно |
Изменяется |
|
IV. Метаболизм |
Инертен |
Активный |
|
V. Функция |
Хранитель информации |
Передача информации |
Виды РНК: информационная (матричная)
Рибосомальная
Транспортная
Функции: И-РНК – передача информации
Р-РНК – основа рибосом. Способствует передвижению и-РНК по рибосоме.
Т-РНК – перенос аминокислот.
Структура нуклеопротеидов.
Первичная структура – это последовательность нуклеотидов, соединенных сложноэфирной связью. При изучении структуры Чаргафом установлены закономерности:
а. Количество А=Т, Ц=Г
б. Количество пуриновых оснований = количеству пиримидиновых А+Г=Ц+Т
в.
![]()
Вторичная структура – трехмерная, пространственная структура, состоящая из антипараллельных противозакрученных спиралей. Шаг спирали содержит 10 нуклеотидов. Внутри цепочки находятся азотистые основания, соединенные по принципу комплиментарности.
Образуют вторичную структуру водородные связи, вандер-вальсовы связи, гидрофобные. ДНК имеет двуцепочную вторичную структуру, РНК – одноцепочную.
Изучена в Работах Уотсона и Крика.
Третичная структура – определенная укладка спирализованной структуры. М-ДНК имеет форму восьмерки. РНК – изучена мало.
Четверичная структура – фонкционально активная, соединена с белком.
В состав нуклеопротеидов входят белки гистонового ряда, которые соединяются с НК слабой электростатической связью.
Функции гистонов:
Участвуют в пространственном построении НК;
Регулируют активность генома – репрессия гена, с которым соединен гистон и ген будет молчать.
Гистоновые белки содержат лиз, арг, мало цис.
Негистоновые белки образуют с ДНК легко разрушаемые связи и это обеспечивает регуляцию активности генома.
В процессе жизни ДНК может подвергаться под действием химических соединений (кофеин) или радиоактивного излучения изменениям, т.е. мутациям.
Виды мутаций:
Транзиция – замена пуринового основания на другое пуриновое.
Трансверсия – замена пуринового основания на пиримидиновое.
Делеция – вставка пары нуклеотидов.
Вставка пары нуклеотидов.
Тяжелые последствия наблюдаются при вставке или выпадении нуклеотидов.
В случае делеции одного мономера изменяется считывание всех последующих кодонов – это мутация со «сдвигом рамки». В результате синтезируется белок с «бессмысленной» последовательностью аминокислот. При делеции двух мономеров также происходит сдвиг рамки.
При утрате трех мономеров (или число, кратное трем) сдвига рамки нет и синтезируется белок, укороченный на 1 аминокислоту.
Обмен нуклеотидов.
Источники нуклеотидов
Поступление с пищей
|
|
НК |
|
|
|
|
|
Белок (как и все белки) |
НК в 12-перстной кишке под действием ДНК-азы и РНК-азы разщепляются за счет разрыва сложноэфирных связей, в результате образуются нуклеотиды, нуклеозиды, очень редко компоненты нуклеотидов. Внутриклеточно идет такой же распад НК.
Основное количество нуклеотидов идет denovo.
Соединения, участвующие в синтезе пурина


Глн + 2 АТФ + СО2
![]() карбамоилфосфат + асп
карбамоилфосфат + асп
Рибоза и дезоксирибоза – синтезируются в пентозофосфатном цикле и поступают с пищей.
Катаболизм нуклеотидов.
РНК быстрее ДНК. Конечные продукты распада азотистых оснований – мочевина, мочевая кислота.
Ц, У, Т – конечный продукт мочевина.


 НП
в желудке
НП
в желудке