
- •Биохимия печени
- •Основные функции печени
- •Обезвреживающая функция печени.
- •1) Система микросомального окисления
- •1 Цепь включает:
- •2 Цепь включает:
- •3 Пути обезвреживания ксенобиотиков с участием гТазы:
- •Примеры обезвреживания токсических в-в в печени:
- •Биотрансформация лекарств в печени
- •Химический канцерогенез
1) Система микросомального окисления
За 1 стадию обезвреживания отвечает система микросомального окисления (СМО), локализованная в мембранах ЭР.
СМО работает практически во всех тканях организма, но наиболее активно в печени.
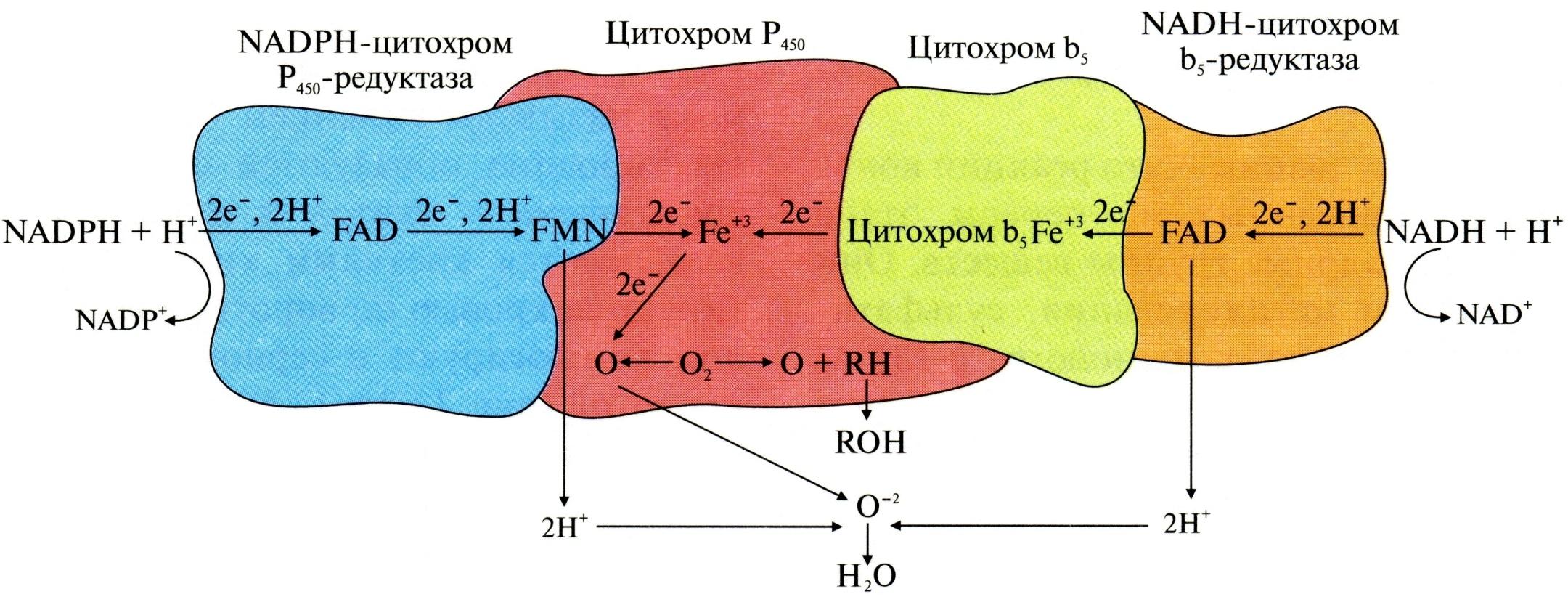
В печени существуют 2 электрон-транспортные цепи СМО, которые катализируют гидроксилирование субстратов и являются монооксигеназами.
1 Цепь включает:
цитохром P450 (гемопротеин), который имеет центры связывания для O2 и гидрофобного субстрата и обладает широкой субстратной специфичностью;
фермент NADPH-цитохром P450-редуктазу, содержащий коферменты FAD и FMN;
NADPH+H+ – донор ē и Н+ в этой электрон-транспортной цепи;
O2.
2 Цепь включает:
цитохром P450;
фермент NADH-цитохром b5-редуктазу, коферментом которой является FAD;
цитохром b5 – гемопротеин, переносящий ē от NADH-цитохром b5-редуктазы на цитохром P450;
NADH + Н+ – донор ē и Н+;
O2.
Цитохром P450 один атом O2 включает в молекулу субстрата, а 2-й восстанавливает с образованием H2O за счет переноса ē и Н+ от NADPH+H+ при участии цитохром P450-редуктазы
(или от NADH+H+ с помощью цитохром b5-редуктазы и цитохрома b5).
Примеры модификации
ксенобиотиков в 1 стадии обезвреживания:

Появление в молекулах субстратов полярных групп в результате микросомального окисления повышает гидрофильность веществ и обеспечивает возможность их вступления в реакции конъюгации.
Второй этап инактивации – это реакции конъюгации модифицированных на 1 этапе или содержащих полярные группы веществ.
Реакции конъюгации – присоединение к гидрофильным группам какого-либо вещества (глюкуроновая кислота, серная кислота, глицин, глутамин, ацетильный остаток и др.).
Эти реакции катализируют трансферазы, имеющие широкую субстратную специфичность.
! Конъюгация снижает реакционную способность веществ и, следовательно, уменьшает их токсичность, повышает гидрофильность и способствует выведению их из организма.
Донором CH3– группы является SAM, группы –SO3H – активная форма серной кислоты (ФАФС), ацетильной группы – ацетил-КоА, остатка глюкуроновой кислоты – УДФ-глюкуронат.
Примеры реакций конъюгации:

Присоединение остатка глюкуроновой к-ты.
Ферменты: УДФ-глюкуронилтрансферазы
Активная форма:
УДФ-глюкуронат:

Реакция в общем виде:
ROH + УДФ–C6H9O6 RO–C6H9O6 + УДФ
Присоединение остатка серной к-ты.
Ферменты: сульфотрансферазы
Активная форма: ФАФС – фосфоаденозинфосфосульфат:
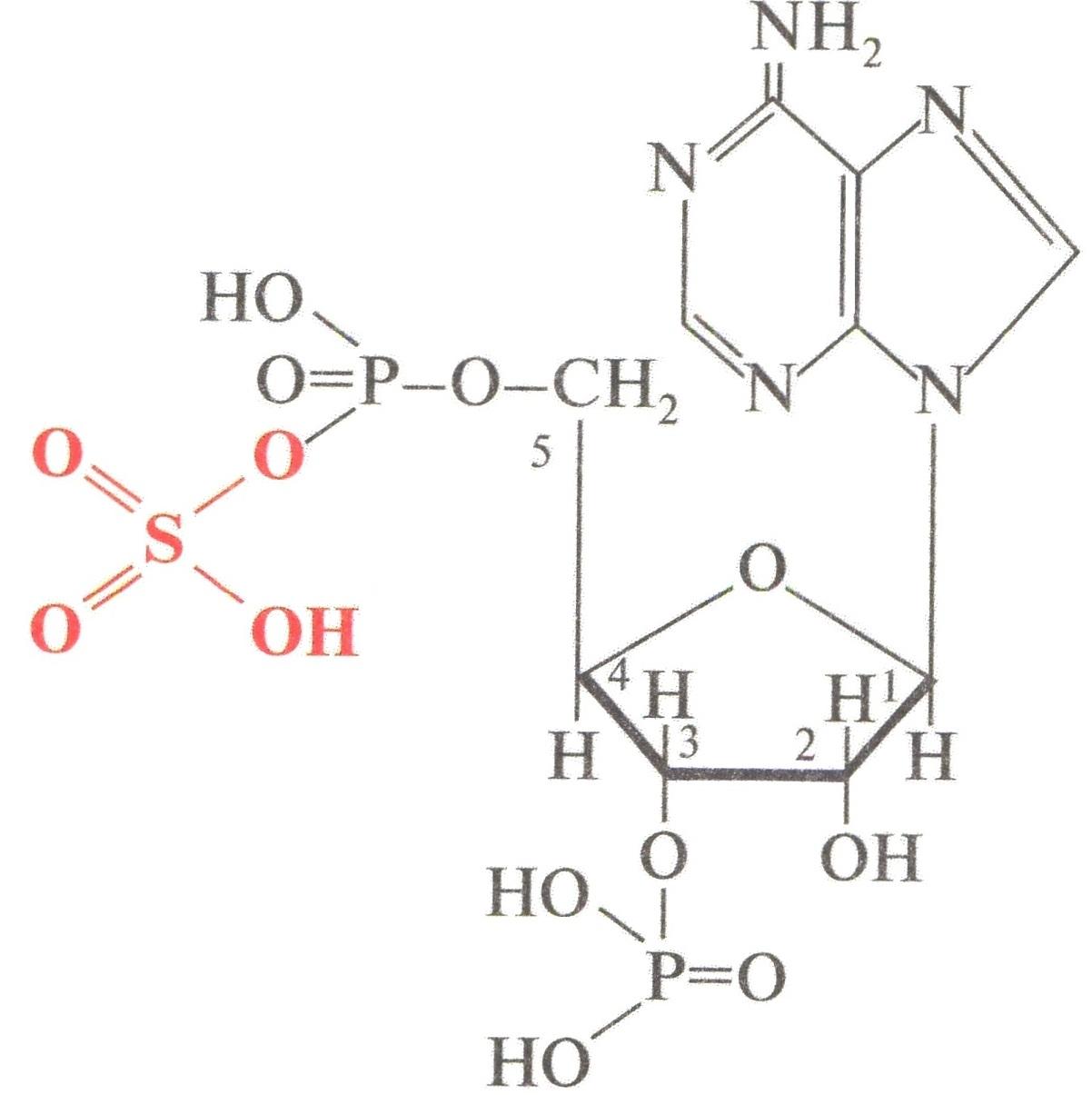
Реакция в общем виде:
ROH + ФАФ–SO3H RO–SO3H + ФАФ
Глутатионтрансферазы (ГТазы).
Для работы ферментов требуется глутатион.
Глутатион – трипептид глу-цис-гли. Остаток Глу присоединен к Цис COOH-группой радикала.
Глутатион:
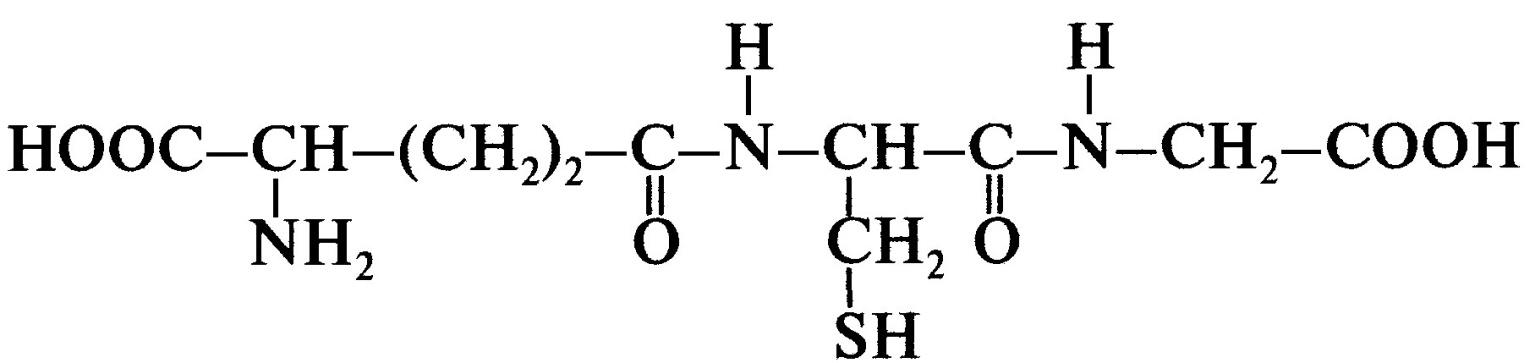
ГТазы имеются во всех тканях (больше всего: в печени).
! Играют важную роль в обезвреживании собственных метаболитов: некоторых стероидных гормонов, простагландинов, билирубина, желчных кислот, продуктов ПОЛ и др.
