
Лабораторная работа №2 / Лаболаторная работа №2
.odt
МИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра Физической химии
отчет
по лабораторной работе №2
по дисциплине «Химия»
Тема: Определение молярной массы эквивалента металла
Студент гр. 8802 |
|
Попов А. П. |
Преподаватель |
|
Васильев Б. В. |
Санкт-Петербург
Цель работы.
Определить молярную массу эквивалента металла методом вытеснения водорода из раствора кислоты; установить, какой это металл.
Основные теоретические положения.
Основными структурными единицами вещества являются атомы, молекулы, ионы, эквиваленты.
Эквивалентом элемента называют такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента называется его эквивалентной массой.
Молярная масса эквивалента вещества - это масса 1 моль эквивалентов данного вещества обозначается Mэк(вещество). Выражается в граммах на моль (г/моль).
Для определения эквивалента (или эквивалентной массы) элемента необязательно исходить из его соединения с водородом. Эквивалент (эквивалентную массу) можно вычислить по составу соединения данного элемента с любым другим, эквивалент (эквивалентная масса) которого известен.
Для окислительно восстановительной реакции, идущей в работе, закон эквивалентов можно записать так:
m1/M эк1 = V2/Vэк2,
где m1 и M эк1 масса и молярная масса вещества 1; V2 и Vэк2 - объем и молярный объем эквивалентов газообразного вещества 2.
Молярная масса эквивалента металла-восстановителя имеет вид
M эк = M ат / z,
где M ат - молярная масса атомов металла, г/моль; z - число электронов, отданных атомом металла в ходе окислительно-восстановительной реакции.
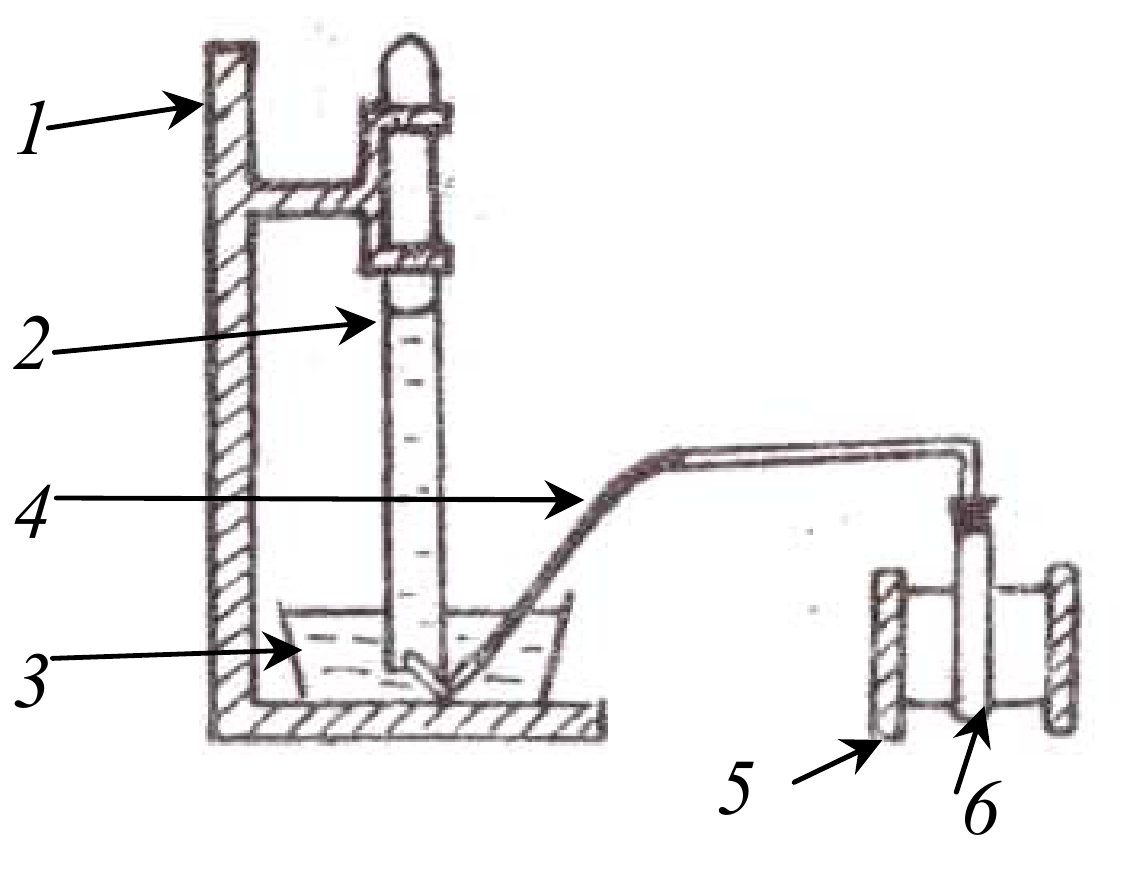
Схема прибора для определения молярной массы эквивалента металла методом вытеснения водорода из раствора кислоты приведена выше, где обозначены: 1 - штатив для эвдиометра; 2 - эвдиометр; 3 - кристаллизатор; 4 - газоотводная трубка; 5 - штатив пробирки; 6 - пробирка.
Экспериментальные результаты.
Сразу после добавления навески металла в кислоту, можно увидеть ход окислительно-восстановительной реакции. В пробирке с реагентами началось образование соли и выделение водорода. Водород по газоотводной трубке поступает в эвдиометр. Через некоторое время реакция завершилась. Показания эвдиометра и прочие нужные для опыта данные представлены в таблице ниже.

Обработка результатов эксперимента.
1. Приведение объема выделившегося водорода к нормальным условиям
V₀ = ((97653,67 * 3 * 10⁻⁵) / 293) * (273 / 101325) ≈ 2,694 * 10⁻⁵ м³.
2. Расчет молярной массы эквивалента металла.
Мэк = (0,0321*3*10-5) / (2,694 * 10⁻⁵) ≈ 0,0357 кг/моль ≈ 35,7 г/моль
3. Определение молярной массы атомов металла.
Mат = z * Mэк = 35,7, где z - количество электронов
Пусть:
z = 1, тогда Mат = 1 * 35,7 = 35,7 г/моль. Ближайший по массе металл - K, калий. Калий при комнатной температуре реагирует с кислородом воздуха, что делает невозможным его использование в опыте.
z =2, тогда Mат = 2 * 35,7 = 71,4 г/моль. Ближайший по массе металл - цинк Zn (65,38 г/моль).
z=3, тогда Mат = 3 * 35,7 = 107,1 г/моль. Ближайший по массе металл - серебро. Серебро - не активный металл (находится правее водорода в ряду электрохимической активности). Реакция при комнатной температуре невозможна.
Исходя из расчетов, z = 2 и искомый металл - Zn (цинк).
4. Вычисление абсолютной и относительной погрешности определения металла.
M(ат. теор.) = 65,38 г/моль; M(ат. пр.) = 71,4 г/моль;
M(эк. теор) = M(Zn)/z = (65,38)/2 = 32,69 г/моль;
Ƞaбс = |M(эк. теор.) - M(эк. пр.)| = |32,69 - 35,7| = 3,01 г/моль;
Ƞотн = [Ƞaбс / M(эк. теор.)] * 100% = [3,01 / 32,69] * 100 ≈ 9,2%;
5. Уравнение окислительно-восстановительной реакции
Zn0 + H+Cl- → Zn2+Cl2- + H20
Zn0 → -2e- → Zn2+ 2 1
2H+ → +2e- → 2H0 2 1
Zn + 2HCl → ZnCl2 + H2↑
Выводы.
В ходе окислительно-восстановительной реакции с участием металла и соляной кислоты выделяется соль и водород H₂↑. Зная объем выделившегося водорода можно вычислить молярную массу эквивалента металла (массу эквивалентов, вступивших в реакцию) и установить тип металла.
2018
