
ЭКГ: волны трепетания предсердий в виде зубьев пилы лучше всего
видны в отведениях III и V1 — при типичном ТП отрицательная волна трепетания — во II, III и V6, положительная — в V1; в ТП «против часовой стрелки» — положительная во II, III и V6, а отрицательная —
в V1. Оценка волны трепетания может быть тяжелой при наличии АВблокады 2:1, когда комплекс QRS накладывается на волну предсердий; в таких случаях помогает массаж каротидного синуса или введение аденозина с целью временного увеличения степени АВблокады. У нелеченых пациентов чаще всего имеет место АВ-блокада 2:1 с быстрым ритмом желудочков ≈150/мин. Если степень блокады меняется, ритм желудочков становится нерегулярным. Редко, главным образом при применении антиаритмических ЛС, уменьшающих частоту возбуждений в предсердиях, может иметь место проведения 1:1, — как правило, с широкими комплексами QRS.
50.Принципы лечения фибрилляции предсердий.
Цели лечения ФП – уменьшение симптомов и профилактика тяжелых осложнений заболевания.
Цель – восстановление синусового ритма Антиаритмики 1А, 1С ( противопоказаны,если есть ИБС) и 3 классов Пропафенон – 300-600 мг Амиодарон (если есть ИБС) 15 мг.кг в/в
-профилактика пароксизмов фибрилляции предсердий Антиаритмики: амиодарон 200-400мг
-контроль чсс
Недигидропиридиновые антагонисты кальция (верапамил и дилтиазем) бета-адреноблокаторы сердечные гликозиды (Дигоксин и дигитоксин)
- профилактика тромбоэмболических осложнений Аннагонисты витамина К (варфарин, аценокумарол)
Антикоагулянты (перорально)-аспирин – 75-100 мг.сут.
Прямые ингибиторы тромбина (апиксабан 5 мг дважды в день, дабигатрана этексилат 110 мг
Неотложная помощь – экстренная электрическая дефибрилляция предсердий
51.Электрическая и фармакологическая кардиоверсия: показания, противопоказания, техника выполнения.
Электрическая кардиоверсия
Электрическая кардиоверсия – купирование приступа аритмии разрядом дефибриллятора, синхронизированной с ЭКГ (с наименее уязвимой фазой электрической систолы желудочков, как правило, через 20-30 мс после вершины зубца R).
Электрическую дефибрилляцию и кардиоверсию обычно объединяют термином электроимпульсная терапия (ЭИТ).
Показания |
к |
наружной |
ЭИТ |
при |
ФП. |
•Отсутствие эффекта и/или непереносимость лекарственной
антиаритмической |
терапии; |
•Прогрессирующая сердечная недостаточность, вследствие пароксизма ФП;
•Острые признаки нарушением гемодинамики, сердечной недостаточности, нарушения периферического кровообращения.
Противопоказания. |
|
|
|
|
|
• |
Редкие |
непродолжительные |
пароксизмы |
ФП; |
|
• |
Интоксикация |
сердечными |
гликозидами; |
||
•ФП при тиреотоксикозе до коррекции содержания гормонов щитовидной железы;
•ФП у больных с полной предсердно-желудочковой блокадой.
Подготовка к плановому восстановлению ритма сердца при ФП.
Антитромботическая подготовка перед кардиоверсией, как минимум 3 недели!
Общие |
принципы |
включают |
в |
себя: |
• Последний |
прием пищи |
вечером |
накануне |
операции. |
• В месте наложения пластин дефибрилляции (грудная клетка) должны быть выбриты волосы.
• В утренние часы отмена приема лекарств.
Методика наружной ЭИТ.
ЭИТ проводится в блоке интенсивной терапии или рентген-операционной. ЭИТ проводится в помещении, оснащенным:
• оборудованием для слежения за жизненно важными функциями организма (ЭКГ, измерения АД, частоты дыхания и насыщение крови
кислородом) |
и |
проведения |
реанимационных |
мероприятий |
(дефибриллятор, |
дыхательный |
аппарат, |
мониторы); |
|
• специализированным электрокардиостимулятором, в случае развития блокад сердца.
Перед ЭИТ устанавливается внутривенный доступ, налаживается мониторинг жизненно-важных функция (ЭКГ, измерения АД, частоты дыхания и насыщение крови кислородом), за 30 мин вводят седативное лекарственное средство. Для проведения процедуры, вы ложитесь на спину. Анестезиолог вводит лекарственные препараты и пациент засыпает.
При наружной ЭИТ накладываются 2 электрода на поверхность грудной клетки, один электрод помещается справа от грудины под ключицей, а второй — в области верхушки сердца, причем центр должен располагаться в шестом — седьмом межреберье по переднеподмышечной линии. Это положение важно для охвата всей мышечной массы миокарда потоком электронов. Рисунок Электроды покрывают электропроводным гелем, плотно прижимаются к грудной клетке, чтобы между их поверхностью и кожей не было воздуха, производят разряд. Ритм сердца должен восстановиться.
При двухфазном разряде начинают со 100 Дж, при необходимости силу каждого следующего разряда повышают на 50 Дж. Однофазный разряд требует в 2 раза больше энергии, то есть начинают с 200 Дж, с последующим увеличением на 100 Дж, пока не будет достигнут максимальный уровень 360 Дж.
Дефибрилляторы, генерирующие биполярный импульс, имеют ряд преимуществ перед дефибрилляторами, генерирующими монофазный импульс, т.к. «способность» разряда устранять фибрилляцию зависит от суммарной величины (в амперах) первой и второй полуволн, а возможность повреждающего действия разряда связана лишь с величиной первой полуволны. После ЭИТ Вас переводят в палату и назначают постельный режим на несколько часов. Если вы проголодались, спросите лечащего врача, когда вы можете принять пищу. Уточните у врача время возобновления приема лекарственных препаратов, особенно если Вы принимаете сахароснижающие средства. Наблюдение в стационаре после операции от одного дня. Большинство пациентов могут быть благополучно выписаны из стационара в течение 24-48 часов после ЭИТ.
Фармакологическая кардиоверсия
Медикаментозная кардиоверсия– купирование приступа аритмии введением антиаритмических препаратов.
Показания.
–Стратегия лечения котроль и поддержание синусового ритма.
–Подготовка к плановому восстановлению ритма сердца при ФП.
–Антитромботическая подготовка перед кардиоверсией, как минимум 3 недели!
Для фармакологической кардиоверсии применяют антиаритмические препараты IA, IC и III классов. К ним относят прокаинамид,амиодарон, пропафенон, нитрофенилдиэтиламинопентилбензамид (ниб ентан.
Прокаинамид выпускают в ампулах по 5 мл, содержащих 500 мг препарата (10 % раствор). Его вводят струйно или капельно в дозе 500—1000 мг однократно внутривенно медленно (в течение 8—10 мин или 20—30 мг/мин). В Европейских рекомендациях 2010 года исключён из списка препаратов для кардиоверсии. Однако в Российской Федерации благодаря невысокой стоимости он весьма распространён. К побочным эффектам прокаинамида относят артериальную гипотензию, слабость, головную
боль,головокружение, диспепсию, депрессию, бессонницу, галлюцинации, агранулоцитоз, эоз инофилию, волчаночноподобныйсиндром[25][27].
Пропафенон выпускают в ампулах по 10 мл, содержащих 35 мг препарата, и в таблетках по 150 и 300 мг. Вводят в дозе 2 мг/кг внутривенно в течение 10 мин (ожидаемый эффект от 30 мин до 2 ч) или перорально в дозе 450—600 мг (ожидаемый эффект через 2—6 ч). Препарат малоэффективен при персистирующей форме ФП и трепетании предсердий. Не следует использовать у пациентов со сниженной сократительной способностью левого желудочка и ишемией миокарда. Вследствие наличия слабого β-блокирующего действия противопоказан пациентам с выраженной ХОБЛ[35].
Амиодарон выпускают в ампулах по 3 мл, содержащих 150 мг препарата (5 % раствор). Его вводят внутривенно струйно в дозе 5 мг/кг в течение 15 мин, затем продолжают капельно в дозе 50 мг/ч в течение 24 ч. Восстанавливает синусовый ритм медленно, его максимальный эффект — через 2—6 часов. Амиодарон рекомендуют использовать у пациентов с органическими заболеваниями сердца[35].
Нибентан выпускают в ампулах по 2 мл, содержащих 20 мг препарата (1 % раствор). Вводят внутривенно в дозе 0,065—0,125 мг/кг в течение 3—5 минут. При отсутствии эффекта — повторные инфузии в той же дозе с интервалом 15 мин (до максимальной дозы 0,25 мг/кг). Его применение допускается только в палатах интенсивной терапии с мониторированием ЭКГ в течение 24 часов после введения, так как возможно развитие проаритмических эффектов в виде полиморфной желудочковой тахикардии типа «пируэт», а также удлинение интервала QT с появлением зубца U
52.Кардиомиопатии: определение, классификация, методы диагностики.
Кардиомиопатии (КМП) группа гетерогенных заболеваний, характеризующаяся патологией миокарда с его структурными и/или функциональными нарушениями, не обусловленная ишемической болезнью сердца, гипертензией, клапанными пороками и врожденными заболеваниями.
Патофизиологическая классификация кардиомиопатий (ВОЗ, 1995)Дилатационая кардиомиопатия (ДКМП)
Гипертрофическая кардиомиопатия (ГКМП) o с обструкцией;
o без обструкции.
Рестриктивная кардиомиопатия (РКМП) o первичная миокардиальная;
o эндомиокардиальная с эозинофилией; o эндомиокардиальная без эозинофилии.
Аритмогенная кардиомиопатия правого желудочка (АКПЖ)
• Под первичными кардиомиопатиями понимают такие их варианты, при которых поражение ограничивается исключительно (или преимущественно) мышцей сердца. Они относительно малочисленны и могут быть генетически обусловленными, смешанными, т.е.
генетическими и негенетическими либо приобретенными (рис. 2-4).
• Под вторичными кардиомиопатиями понимают такие их варианты, при которых вовлечение миокарда в патологический процесс происходит в рамках большого спектра часто
встречающихся генерализованных системных (мультиорганных) заболеваний (табл. 2-4). При этом необходимо отметить, что из данной классификации исключены такие варианты поражения и дисфункции миокарда, которые служат прямым следствием какого-либо другого сердечно-сосудистого заболевания (например, ГБ, врожденных заболеваний сердца, ИБС, клапанных пороков сердца и др.).
Диагностика:
ЭКГ – стандартная 12-канальная ЭКГ (аномалии ST и T волны, патологический зубец Q) ФКГ (усиление или ослабление тонов)
Рентген (увиление сердца)
Позитронно-эмиссионная томография (ПЭТ) – выявление нарушения перфузии
эхокардиография:
1)гипертрофия преимущественно вовлекает межжелудочковую перегородку в базальных отделах ЛЖ, может распространятся на боковю стенку, заднюю стенку и верхушку ЛЖ
2)движение створок клапанов, направленное вперед;
53.Дилатационная кардиомиопатия: клиника, диагностика, принципы лечения.
Дилатационная кардиомиопатия (ДКМП) характеризуется диффузным расширением камер сердца, преимущественно левого желудочка, в сочетании с необязательным умеренным развитием гипертрофии миокарда.
Клинические проявления дилатационной кардиомиопатии, независимо от её причины, можно свести к следующим синдромам:
Сердечная недостаточность — как левожелудочковая, так и правожелудочковая. Обычно имеет место тотальная («застойная») сердечная недостаточность.
Кардиалгии, а также приступы стенокардии (у ½ — ¼ больных).
Нарушения сердечного ритма (часто — фибрилляция предсердий, желудочковая экстрасистолия) и проводимости (блокады ножек пучка Гиса).
Тромбоэмболии
Объективные данные при ДКМП: обязательна кардиомегалия, перкуторные границы сердца расширены во все стороны, верхушечный толчок смещен влево-вниз, разлитой. При аускультации тоны сердца приглушены, возможен «ритм галопа» за счёт III и IV тонов. Часто выслушивается систолический шум относительной митральной и трикуспидальной недостаточности. Обнаруживается набухание шейных вен, отёчный синдром, гепатомегалия.
Диагностика
На I э т а п е диагностического поиска в ранней стадии заболевания симптомы могут не выявляться. При снижении сократительной функции миокарда появляются жалобы на повышенную утомляемость, одышку при физической нагрузке, а затем в покое. По ночам беспокоит сухой кашель (эквивалент сердечной астмы), позже — типичные приступы удушья. У 10 % больных наблюдаются характерные ангинозные боли. При развитии застойных явлений в большом круге кровообращения появляются тяжесть в правом подреберье (вследствие увеличения печени), отеки ног.
На II э т а п е диагностического поиска наиболее важным признаком является значительное увеличение сердца (признаки клапанного порока сердца или артериальной гипертензии отсутствуют). Обнаружение на ранних стадиях болезни кардиомегалии в большей или меньшей степени может быть случайным во время профилактического осмотра или обращения больного к врачу по поводу сердечных жалоб. Кардиомегалия проявляется расширением сердца в обе стороны, определяемым
перкуторно, а также смещением верхушечного толчка влево и вниз. В тяжелых случаях выслушиваются ритм галопа, тахикардия, шумы относительной недоста-
точности митрального и(или) трехстворчатого клапанов. В 20 % случаев развивается мерцание предсердий. Артериальное давление обычно нормальное или слегка повышено (вследствие сердечной недостаточности).
Остальные симптомы появляются только при развитии сердечной недостаточности и являются ее выражением (холодные цианотичные конечности, набухание шейных вен, отеки, увеличение печени, застойные хрипы в нижних отделах легких, увеличение числа дыханий в минуту).
Инструментальные методы исследования позволяют обнаружить: 1) признаки кардиомегалии; 2) изменения показателей центральной гемодинамики; 3) нарушения ритма и проводимости.
Фонокардиограмма подтверждает аускультативные данные в виде ритма галопа, частого обнаружения систолического шума (вследствие относительной недостаточности митрального или трехстворчатого клапана). При застойных явлениях в малом круге кровообращения выявляют акцент II тона.
Рентгенологически обнаруживается значительное увеличение желудочков (часто в сочетании с умеренным увеличением левого предсердия). Развивающиеся вследствие левожелудочковой недостаточности нарушения в малом круге кровообращения проявляются усилением легочного сосудистого рисунка, а также появлением транссудата в плевральных (чаще в правой) полостях.
Эхокардиография оказывает существенную помощь в диагностике, выявляя: 1) дилатацию обоих желудочков; 2) гипокинезию задней стенки левого желудочка; 3) парадоксальное движение межжелудочковой перегородки во время систолы. Кроме этого, выявляется увеличение амплитуды движения неизмененных створок митрального клапана.
На ЭКГ сдвиги носят неспецифический характер. К ним относятся признаки гипертрофии левого желудочка и левого предсердия; нарушения проводимости в виде блокады передней ветви левой ножки предсердножелудочкового пучка (пучка Гиса) или полной блокады левой ножки (15 % случаев); уплощение зубца Т в левых грудных отведениях; мерцание предсердий. Некоторые сложности возникают при появлении патологических зубцов Q в грудных отведениях, что заставляет заподозрить перенесенный ранее инфаркт миокарда. При морфологическом исследовании миокарда в таких случаях обнаруживают множество мелких рубчиков (не являющихся следствием коронарного атеросклероза).
Исследование показателей центральной гемодинамики выявляет низкий минутный и ударный объем (минутный и ударный индексы), повышение давления в легочной артерии.
Ангиокардиографически обнаруживаются те же изменения, что и на эхокардиограмме.
Биопсия миокарда (прижизненная) неинформативна для определения этиологии кардиомиопатии. В некоторых случаях в биоптате можно обнаружить вирусный антиген или увеличение содержания ЛДГ, а также ухудшение энергопродукции митохондриями.
Лечение. Основное лечение ДКПМ — борьба с развивающейся застойной сердечной недостаточностью, что осуществляется по общим принципам (прежде всего ограничение физической активности и потребления поваренной соли до 1 — 2 г/сут).
Наиболее эффективно применение: 1) мочегонных препаратов. Преимущество отдается так называемым петлевым диуретикам:
фуросемид 20 — 40 мг, урегит 25 — 50 мг утром натощак 1—3 раза в неделю.
2) ингибиторы ангиотензинпревращающего фермента (ИАПФ):
каптоприл (капотен) 25—100 мг/сут, эналаприл (ренитек, энап) 2,5—10 мг/сут, рамиприл 1,25—10 мг/сут. При назначении этих препаратов следует учитывать величину АД, так как они снижают АД..
Хороший лечебный вазодилататорный эффект оказывают изосорбид динитрат, кардикет, нитросорбид, что приводит к снижению притока крови к правому сердцу.
Дигоксин назначают при мерцательной аритмии в обычных дозах (при этом следует иметь в виду, что при ДКМП может быстро развиться дигиталисная интоксикация, поэтому контроль за приемом препарата должен быть строгим).
3) b-адреноблокаторы: атенолол 12,5 — 25 мг/сут, метопролол — 12,5 — 50 мг/сут). Лечебный эффект препарата в основном обусловливается его брадикардитическим действием и, возможно, уменьшением действия катехоламинов на миокард.
При ДКМП можно проводить трансплантацию сердца. Основное показание — тяжелая застойная сердечная недостаточность и отсутствие эффекта от лекарственной терапии.
54.Гипертрофическая кардиомиопатия: классификация, клиника, диагностика, лечебная тактика.
Гипертрофическая кардиомиопатия (ГКМП)- массивной гипертрофией желудочков (преимущественно левого) с выпячиванием в полость правого желудочка межжелудочковой перегородки, которая может быть значительно утолщена.
Классификация ГКМП в зависимости от локализации гипертрофии: I. Гипертрофия ЛЖ:
А) Асимметрическая гипертрофия, в том числе: ≈ 90% - гипертрофия МЖП ≈1% - среднежелудочковая гипертрофия ≈ 3%
- апикальная (верхушечная) гипертрофия ≈ 1% - гипертрофия свободной латеральной или задней части МЖП ≈ 5%
Б) Симметрическая (концентрическая) гипертрофия
II. Гипертрофия правого желудочка (редко в сочетании с гипертрофией ЛЖ) ≈ 1%
Возможные варианты: гипертрофия базального отдела, передней, переднебоковой, задней части МЖП, диффузная гипертрофия МЖП. В зависимости от наличия или отсутствия обструкции ВТЛЖ в покое и при нагругке выделяют следующие варианты ГКМП:
- обструктивный (обструктивная ГКМП): градиент давления в ВТЛЖ > 30 мм рт.ст. с развитием субаортальной или среднежелудочковой обструкции; - латентный (градиент давления ВТЛЖ < 30 в покое и > 30 мм рт. ст. при нагрузке); - необструктивны й (градиент давления ВТЛЖ < 30 в покое и при нагрузке).
Клиническая картина.
В развернутой фазе заболевания при ГКМП наиболее частыми клиническими проявлениями являются одышка, разнообразные болевые ощущения в грудной клетке кардиалгического и/или стенокардитического характера, нарушения ритма сердечной деятельности (перебои, учащенное

сердцебиение), головокружение, пре-, и синкопальные состояния. У большинства симптоматичных больных наблюдается сочетание нескольких жалоб вплоть до полного симптомокомплекса.
Наиболее частая жалоба больных ГКМП - прогрессирующая одышка инспираторного характера, что и служит поводом к обращению за медицинской помощью и свидетельствует о появлении и прогрессировании СН, чаще наблюдается при обструктивной форме.
Диагностика
1) признаки гипертрофии миокарда желудочков (преимущественно левого); 2) признаки недостаточной диастолической функции желудочков; 3) признаки обструкции выходного тракта левого желудочка (не у всех больных); 4) нарушения ритма сердца.
Стадии: 1 стадия – давления выходного тракта левого желудочка до 25 мм.рт.ст., жалоб нет
2стадия – давление выходного тракта до 36 мм.рт.ст, жалобы при нагрузке.
3стадия – давление выходного тракта до 44 мм.рт.ст, одышка, сердцебиение, стенокардия, обморочные состояния
4стадия – давление выходного тракта до 80 мм.рт.ст., гемодинамические, аритмические и цереброваскулярные расстройства.
На I э т а п е диагностического поиска в ранней, а также в развитой |
||
стадии заболевания может не быть жалоб. Иногда больные предъявляют |
||
следующие жалобы: 1) на боли за грудиной сжимающего характера, |
||
возникающие при физической нагрузке и исчезающие в покое; реже боли |
||
возникают в покое. Причина болей — диспропорция между увеличенной |
||
потребностью гипертрофированного миокарда в кровоснабжении и |
||
сниженным кровотоком в субэндокардиальных слоях миокарда |
||
вследствие плохого диастолического расслабления желудочков; 2) на |
||
одышку при физической нагрузке, обычно умеренно выраженную, но |
||
иногда и тяжелую; 3) головокружение, головные боли, наклонность к |
||
обморочным состояниям — следствие внезапного снижения сердечного |
||
выброса или пароксизмов аритмий, также уменьшающих выброс из |
||
левого желудочка и приводящих к временному нарушению церебрального |
||
кровообращения (пароксизмы мерцания предсердий, эктопических |
||
тахикардии). |
|
|
На II э т а п е |
диагностического поиска |
наиболее существенным |
является обнаружение систолического шума, измененного пульса и |
||
смещенного верхушечного толчка. |
|
|
Аускультативно: |
1) максимум звучания |
систолического шума |
(шум изгнания) определяется в точке Боткина и на верхушке сердца; |
||
2) систолический шум в большинстве случаев усиливается при резком |
||
вставании больного, а также при проведении пробы Вальсальвы; 3) II |
||
тон всегда сохранен; 4) шум не проводится на сосуды шеи. |
||
Пульс примерно у V3 больных высокий, скорый, что объясняется отсутствием сужения на путях оттока из левого желудочка в самом начале систолы, но затем за счет сокращения мощной мускулатуры появляется «функциональное» сужение путей оттока, что и приводит к преждевременному снижению пульсовой волны.
Верхушечный толчок в 34 % случаев имеет «двойной» характер: |
|
вначале при пальпации ощущается удар от сокращения левого |
|
предсердия, затем от сокращения левого желудочка. Эти свойства |
|
верхушечного |
толчка лучше выявляются в положении больного лежа |
на левом боку. |
|
На III э т а п е диагностического поиска наибольшее значение |
|
имеют данные |
эхокардиографии: |
3)асимметричная гипертрофия межжелудочковой перегородки, более выраженная в верхней трети, ее гипокинез;
4)систолическое движение передней створки митрального клапана, направленное вперед;
5)соприкосновение передней створки митрального клапана с межже лудочковой перегородкой в диастолу.
На ЭКГ Изолированная гипертрофия межжелудочковой перегородки обусловливает появление зубца Q увеличенной амплитуды в левых грудных отведениях что осложняет дифференциальную диагностику с очаговыми изменениями вследствие перенесенного инфаркта миокарда. Однако зубец Q неширокий, что позволяет исключить перенесенный инфаркт миокарда. могут появляться признаки синдрома гипертрофии левого предсердия: уширение зубца Р более 0,10 с, увеличение амплитуды зубца Р, появление двухфазного зубца Р в отведении Vi с увеличенной по амплитуде и продолжительности второй фазы.
общим симптомом является частое развитие желудочковых аритмий (экстрасистолия и пароксизмальная тахикардия). При суточном мониторировании (холтеровское мониторирование) ЭКГ эти нарушения ритма сердца хорошо документируются вследствие пароксизмальности их появления.
При рентгенологическом обследовании в развитой стадии болезни могут определяться увеличение левого желудочка и левого предсердия, расширение восходящей части аорты. Увеличение левого желудочка коррелирует с высотой давления в левом желудочке.
На фонокардиограмме амплитуды I и II тонов сохранены (и даже увеличены), что отличает ГКМП от стеноза устья аорты, обусловленного сра-
щением створок клапана (приобретенный порок), а также выявляется систолический шум различной степени выраженности.
Кривая каротидного пульса в отличие от нормы двухвершинная, с дополнительной волной на подъеме. Такая типичная картина наблюдается лишь при градиенте давления «левый желудочек — аорта», равном 30 мм рт.ст. При большей степени стеноза вследствие резкого сужения путей оттока на каротидной сфигмограмме определяется только одна пологая вершина.
Инвазивные методы исследования (зондирование левых отделов сердца, контрастная ангиография) в настоящее время не являются обязательными, так как эхокардиография дает вполне достоверную для постановки диагноза информацию. Однако в ряде случаев с помощью этих методов выявляют признаки, характерные для гипертрофической кардиоми-опатии: наличие градиента давления между левым желудочком и аортой от 50 до 150 мм рт.ст., повышение конечного диастолического давления в полости левого желудочка до 18 мм рт.ст. Градиент давления уменьшается после введения р-адреноблокаторов.
При контрастной ангиографии выявляется участок сужения путей оттока левого желудочка, коронарные артерии не изменены.
Сканирование сердца (с радиоизотопом таллия) помогает обнаружить утолщение межжелудочковой перегородки и свободной стенки левого желудочка.
Поскольку у 15 — 25 % больных наблюдается коронарный атеросклероз, то у немолодых лиц с приступами типичных ангинозных болей следует проводить коронарографию, так как эти симптомы, как уже упоминалось, при ГКМП обычно обусловлены самим заболеванием.
Диагностика. Диагноз основывается на обнаружении характерного сочетания симптомов заболевания при отсутствии данных, свидетельствующих о синдромно сходной патологии.
Наиболее характерны для гипертрофической кардиомиопатии последовательно обнаруживаемые следующие симптомы:
1) систолический Шум с эпицентром по левому краю грудины в сочетании с сохраненным II тоном;
2) сохранение I и II тонов на ФКГ в сочетании с мезосистолическим шумом; |
|||||
3) изменения каротидной сфигмограммы; 4) увеличение левого желудочка |
|||||
по данным ЭКГ и рентгенологического исследования; 5) типичные призна |
|||||
ки, обнаруживаемые при эхокардиографическом исследовании. |
|||||
В диагностически трудных случаях показаны зондирование левых |
|||||
отделов сердца |
и ангиокардиография. Диагностические сложности |
||||
обусловлены тем, |
что отдельно взятые симптомы гипертрофической |
||||
кардиомиопатии могут встречаться при самых разнообразных |
|||||
заболеваниях. Поэтому окончательный диагноз кардиомиопатии возможен |
|||||
лишь при обязательном исключении следующих заболеваний: стеноза |
|||||
устья аорты (клапанного), недостаточности митрального клапана, ИБС, |
|||||
гипертонической болезни. |
|
|
|
||
Лечение. |
Чаще всего |
для |
лечения |
ГКМП используют |
|
1) р-адреноблокаторы, которые снижают чувствительность миокарда к |
|||||
катехоламинам, |
потребность |
его в |
кислороде |
и градиент давления |
|
(возникающий или усиливающийся при физической нагрузке), удлиняют |
|||||
время диастолического наполнения и улучшают наполнение желудочка: |
|||||
анаприлин (пропранолол, индерал, обзидан) в дозе 40 — 200 мг/сут или |
|||||
атенолол |
|
|
50—100 |
мг/сут. |
|
2)антагонисты кальция — верапамил (изоптин, феноптин) в дозе 120 — 360 мг/сут, в меньшей степени — нифедипин. Их применение обусловлено обнаружением повышенного числа рецепторов к антагонистам кальция в миокарде больных с ГКМП, что, возможно, отражает увеличение плотности кальциевых каналов, по которым ионы кальция проникают в миокард.
При наличии нарушений желудочкового ритма назначают кордарон в дозе 600 — 800 мг/сут в 1-ю неделю, затем по 200 — 400 мг/сут.
При развитии сердечной недостаточности назначают мочегонные препараты (салуретики — фуросемид, урегит) и антагонисты альдостерона (верошпирон, альдактон) в необходимых дозах.
55.Рестриктивная кардиомиопатия: диагностика, клинические проявления, лечение.
Рестриктивная кардиомиопатия (РКМП) известна в двух вариантах
(ранее рассматривающихся как два самостоятельных патологических процесса) — эндокардиальный фиброз и эндомиокардиальный фиброэластоз Леффлера. Патоморфологическая картина при этих двух заболеваниях мало различается и характеризуется резким утолщением эндокарда в сочетании с гипертрофией миокарда желудочков, полости которых могут быть расширены или уменьшены. Обычно в патологический процесс вовлечены оба желудочка или изолированно правый либо левый
Клиническая картина. Проявления болезни чрезвычайно полиморфны, они определяются симптомами нарушения кровообращения в малом
или большом круге (в зависимости от преимущественного поражения правого или левого желудочка).
Симптомы включают одышку при физической нагрузке, ортопноэ и (при поражении правого желудочка) периферические отеки. Причиной усталости бывает фиксированный сердечный выброс из-за препятствия желудочковому наполнению. Предсердные и желудочковые аритмии, а также АВ-блокады встречают часто,

стенокардия и обмороки – редко. Симптомы похожи на таковые при констриктивном перикардите ( Перикардиты : Констриктивный перикардит).
При физикальном обследовании выявляют ослабление сердечных тонов, низкоамплитудный и ускоренный пульс на сонных артериях, легочные хрипы и выраженное набухание вен шеи с быстрым yснижением ( Нормальные пульсовые волны яремных вен.). 4-й сердечный тон (S4) почти всегда присутствует; 3-й сердечный тон (S3) может обнаруживаться, его необходимо дифференцировать от прекардиального щелчка при констриктивном перикардите. В некоторых случаях появляется шум функциональной митральной или трикуспидальной регургитации, связанной с тем, что инфильтрация миокарда или эндокарда либо фиброз изменяют хорды или конфигурацию желудочков. Пародоксальный пульс не встречают.
Диагностика.
На I э т а п е диагностического поиска не всегда можно получить необходимую информацию для постановки диагноза, так как жалобы или отсутствуют, или обусловлены застойными явлениями в малом или большом круге кровообращения.
На II э т а п е могут выявляться симптомы застойной недостаточности сердца разной степени выраженности. Большее значение имеет обнаружение увеличения сердца, мягкого позднего систолического шума и громкого раннего III тона (обусловленного быстрым наполнением желудочков во время диастолы).
На III э т а п е диагностического поиска обнаруживают признаки увеличения сердца (при рентгенологическом исследовании), неспецифические изменения зубца Т на ЭКГ, III тон сердца на ФКГ.
Наибольшее значение имеет эхокардиография, выявляющая быстрое движение передней створки митрального клапана во время диастолы и быстрое раннее движение задней стенки левого желудочка наружу. Уменьшение полости сердца.
При исследовании параметров центральной гемодинамики
определяется повышенное давление заполнения в обоих желудочках, причем конечное давление в левом превышает аналогичный показатель в правом желудочке.
При вентрикулографии наблюдаются усиленно сокращающийся левый желудочек или оба желудочка, гладкие контуры их стенок, иногда с дефектом заполнения в области верхушки, отражающим ее облитерацию. В некоторых случаях определяются вдавления в области сосочковых мышц. Отмечаются признаки недостаточности митрального или трехстворчатого клапана.
При эндомиокардиальном фиброэластозе Леффлера возможны выраженная эозинофилия и бронхоспастический синдром, что в сочетании с умеренным увеличением сердца и симптомами сердечной недостаточности помогает поставить правильный диагноз.
Лечение. Диуретики : гидрохлотиазид – 50 мг.сут. , вазадилататоры – изорбида мононитрат и динитрат – 2060 мг.сут.
56.Симптоматические артериальные гипертонии: классификация, особенности обследования пациента с целью исключения почечной этиологии артериальной гипертонии
Симптоматические, или вторичные, артериальные гипер-тензии (СГ) — это АГ, причинно связанные с определенными заболеваниями или повреждениями органов (или систем), участвующих в регуляции АД.
Частота симптоматических артериальных гипертензий составляет 5 — 15 % от всех больных АГ.
Классификация. Существует множество классификаций СГ, однако выделяют четыре основные группы СГ.
I.Почечные (нефрогенные).
II. |
Эндокринные. |
|
|
|
|
|
||
III. Гипертензий, обусловленные поражением сердца и крупных арте |
|
|
||||||
риальных сосудов (гемодинамические). |
|
|
|
|
|
|||
IV. Центрогенные |
(обусловленные органическим поражением нерв |
|
|
|||||
ной системы). Иногда выделяется группа СГ при сочетанных поражениях |
п о л и ц и т е м и и , |
|||||||
П о м и м о |
э т и х |
з а б о л е в а н и й А Г |
б ы в а е т п р и : |
|||||
х р о н и ч е с к и х о б с т р у к т и в н ы х |
б о л е з н я х |
л е г к и х . Т а к ж е в о з м о ж н о |
||||||
с о ч е т а н и е н е с к о л ь к и х з а б о л е в а н и й : д и а б е т и ч е с к и й г л о м е р у с к л е р о з и |
||||||||
х р о н и ч е с к и й |
п и е л о н е ф р и т , |
а т е р о с к л е р о з |
п о ч е ч н ы х |
а р т е р и й |
и |
|||
х р о н и ч е с к и й г л о м е р у л о – и л и п и е л о н е ф р и т . |
|
|
|
|||||
Особенности обследования пациента для исключения почечного генеза.
I э т а п а диагностического поиска входят: 1) сбор сведений о перенесенных ранее заболеваниях почек или мочевыводящей системы; 2) целенаправленное выявление жалоб, встречающихся при почечной патологии, при которой гипертензия может выступать как симптом.
На II э т а п е диагностического поиска выявляют симптомы, обусловленные повышением АД и основным заболеванием.
Наличие выраженных отеков при соответствующем анамнезе делает предварительный диагноз гломерулонефрита более достоверным. Возникают предположения и об амилоидозе.
При физикальном обследовании больного может быть обнаружен систолический шум над брюшной аортой у места отхождения почечных артерий, тогда можно предположить реноваскулярный характер АГ.
Обнаружение при пальпации живота опухолевого образования у больных АГ позволяет предположить поликистоз почек, гидронефроз или гипернефрому.
На основании оценки выявленных синдромов можно высказать следующие предположения о заболеваниях, сопровождающихся АГ почечного генеза.
•Сочетанием АГ с патологией мочевого осадка проявляется: а) хро нический и острый гломерулонефрит; 6) хронический пиелонеф рит.
•Сочетание АГ и лихорадки наиболее часто встречается при: а) хро ническом пиелонефрите; б) поликистозе почек, осложненном пие лонефритом; в) опухолях почки; г) узелковом периартериите.
•Сочетание АГ с пальпируемой опухолью в брюшной полости наблю дается при: а) опухоли почек; б) поликистозе; в) гидронефрозе.
•Сочетанием АГ с шумом над почечными артериями характеризуется стеноз почечных артерий различного происхождения.
•Моносимптомная АГ характерна для: а) фибромускулярной гипер плазии почечных артерий (реже стенозирующего атеросклероза по чечных артерий и некоторых форм артериита); б) аномалий разви тия почечных сосудов и мочевыводящих путей.
На III э т а п е диагностического поиска производят: а) обязательное обследование всех больных. б) специальные исследования по показаниям.
Исследования по показаниям включают:
1)количественную оценку бактериурии, суточную потерю белка с
мочой;
2)суммарное исследование функции почек;
3)раздельное исследование функции обеих почек (изотопная ренография и сканирование, инфузионная и ретроградная пиелография, хромоцистоскопия);
4) ультразвуковое сканирование почек;
5) компьютерную томографию почек;
6) контрастную ангиографию (аортография с исследованием почечно го кровотока и каваграфия с флебографией почечных вен);
7) исследование крови на содержание ренина и ангиотензина.
В сомнительных случаях для окончательного диагноза латентно протекающего пиелонефрита или гломерулонефрита производят биопсию почки.
Нередко патологический процесс в почках многие годы протекает скрыто и сопровождается минимальными и непостоянными изменениями мочи. Небольшая протеинурия приобретает диагностическое значение только при учете суточного количества теряемого с мочой белка: протеи-
нурию более 1 г/сут можно рассматривать как косвенное указание на связь АГ с первичным поражением почек. Экскреторная урография исключает (или подтверждает) наличие камней, аномалий развития и положения почек (иногда почечных сосудов), которые могут быть причиной макро- и микрогематурии.
При гематурии для исключения опухоли почек, помимо экскреторной урографии, проводят сканирование почек, компьютерную томографию и на завершающем этапе — контрастную ангиографию (аорто- и кавогра-фия).
Диагноз интерстициального нефрита, также проявляющегося микрогематурией, может быть поставлен только с учетом результатов биопсии почек.
Биопсия почки и гистологическое исследование биоптата позволяют окончательно подтвердить диагноз амилоидного ее поражения.
В случае предположения о вазоренальной гипертензии установить ее характер можно по данным контрастной ангиографии.
Эти исследования — биопсия почки и ангиография — проводятся по строгим покзаниям.
57.Реноваскулярная артериальная гипертония: этиология, особенности клинической картины, диагностика, методы лечения.
П о ч е ч н ы е ( н е ф р о г е н н ы е ) г и п е р т е н з и и . П о ч е ч н ы е АГ — наиболее частая причина АГ (70 — 80 %). Они подразделяются на АГ при заболеваниях паренхимы почек, реноваскулярные (вазоренальные) гипертензии и АГ, связанные с нарушением оттока мочи. Большую часть почечных АГ представляют заболевания с ренопаренхиматозной и вазоре-нальной патологией.
Стеноз или окклюзия одной или обеих основных почечных артерий, добавочной почечной артерии или любой из их ветвей может вызвать артериальную гипертензию путем высвобождения ренина из юкстагломерулярных клеток пораженной почки. Диаметр просвета артерии должен быть сужен на ≥ 70% и должен присутствовать значительный постстенотический градиент для того, чтобы стеноз мог способствовать повышению АД. По неясным причинам реноваскулярная гипертензия гораздо менее распространена среди афроамериканцев по сравнению с европейцами.
В целом, приблизительно 80% случаев вызваны атеросклерозом и 20% – фибромышечной дисплазией.
Клиническая картина многочисленных заболеваний, сопровождающихся АГ почечного генеза, может проявляться следующими синдромами:
АГ и патологией мочевого осадка; АГ и лихорадкой; АГ и шумом над почечными артериями; АГ и пальпируемой опухолью брюшной полости; АГ (моносимптомно).
Реноваскулярная гипертензия чаще всего протекает асимптомно. Возможно
возникновение систоло-диастолического шума в эпигастрии, часто проводящегося в верхнюю часть поясничной области с одной или обеих сторон, однако он встречается лишь у 50% пациентов с фибромышечной дисплазией и еще реже – у пациентов с атеросклерозом почечных артерий.
Реноваскулярную гипертензию следует заподозрить, если:
Диастолическая гипертензия развивается внезапно у пациента < 30 или >50 лет
Новая или ранее стабильная гипертензия быстро ухудшается в течение 6 месяцев
Гипертензия изначально является очень тяжелой, связана с ухудшением функции почек или высокорефрактерная к медикаментозному лечению.
Анамнез травмы спины или поясничной области, или острой боли в этих областях, с указанием на гематурию или без нее, позволяет заподозрить развитие реноваскулярной гипертензии (возможно из-за повреждений артерий), но такие случаи редки. Разный размер почек (>1 см разницы), выявленный случайно по данным визуализирующих методик, повторные эпизоды необъяснимого острого отека легких и сердечная недостаточность могут также свидетельствовать о реноваскулярной гипертензии.
Эти синдромы могут быть выявлены на разных этапах диагностического поиска.
В задачу I э т а п а диагностического поиска входят: 1) сбор сведений о перенесенных ранее заболеваниях почек или мочевыводящей системы; 2) целенаправленное выявление жалоб, встречающихся при почечной патологии, при которой гипертензия может выступать как симптом.
Указания на имеющуюся у больного патологию почек (гломеруло- и пиелонефрит, мочекаменная болезнь и т.д.), связь ее с развитием АГ позволяют сформулировать предварительную диагностическую концепцию.
На II э т а п е диагностического поиска выявляют симптомы, обусловленные повышением АД (описаны ранее) и основным заболеванием.
Наличие выраженных отеков при соответствующем анамнезе делает предварительный диагноз гломерулонефрита более достоверным. Возникают предположения и об амилоидозе.
При физикальном обследовании больного может быть обнаружен систолический шум над брюшной аортой у места отхождения почечных артерий, тогда можно предположить реноваскулярный характер АГ. Уточненный диагноз ставят по данным ангиографии.
Обнаружение при пальпации живота опухолевого образования у больных АГ позволяет предположить поликистоз почек, гидронефроз или гипернефрому.
На основании оценки выявленных синдромов можно высказать следующие предположения о заболеваниях, сопровождающихся АГ почечного генеза.
•Сочетанием АГ с патологией мочевого осадка проявляется: а) хронический и острый гломерулонефрит; 6) хронический пиелонеф рит.
•Сочетание АГ и лихорадки наиболее часто встречается при: а) хро ническом пиелонефрите; б) поликистозе почек, осложненном пие лонефритом; в) опухолях почки; г) узелковом периартериите.
•Сочетание АГ с пальпируемой опухолью в брюшной полости наблю дается при: а) опухоли почек; б) поликистозе; в) гидронефрозе.
•Сочетанием АГ с шумом над почечными артериями характеризуется стеноз почечных артерий различного происхождения.
•Моносимптомная АГ характерна для: а) фибромускулярной гипер
плазии почечных артерий (реже стенозирующего атеросклероза по чечных артерий и некоторых форм артериита); б) аномалий разви тия почечных сосудов и мочевыводящих путей.
На III э т а п е диагностического поиска производят: а) обязательное обследование всех больных б) специальные исследования по показаниям.
Исследования по показаниям включают:
1) количественную оценку бактериурии, суточную потерю белка с мочой;
2) суммарное исследование функции почек; 3) раздельное исследование функции обеих почек (изотопная рено-
графия и сканирование, инфузионная и ретроградная пиелография, хромоцистоскопия);
4) ультразвуковое сканирование почек;
5) компьютерную томографию почек;
6) контрастную ангиографию (аортография с исследованием почечно го кровотока и каваграфия с флебографией почечных вен);
7) исследование крови на содержание ренина и ангиотензина.
.
Уже по результатам обязательных методов исследования (характер мочевого осадка, данные бактериологического исследования) можно иногда подтвердить предположение о гломерулоили пиелонефрите. Однако для окончательного решения вопроса нужны дополнительные исследования.
Эти исследования включают анализ мочи по Нечипоренко, посев мочи по Гулду (с качественной и количественной оценкой бактериурии), проведение преднизолоновой пробы (провокация лейкоцитурии после внутривенного введения преднизолона), изотопной ренографии и сканирования, хромоцистоскопии и ретроградной пиелографии. Кроме того, следует безупречно выполнить инфузионную урографию.
В сомнительных случаях для окончательного диагноза латентно протекающего пиелонефрита или гломерулонефрита производят биопсию почки.
Нередко патологический процесс в почках многие годы протекает скрыто и сопровождается минимальными и непостоянными изменениями мочи. Небольшая протеинурия приобретает диагностическое значение только при учете суточного количества теряемого с мочой белка: протеи-
нурию более 1 г/сут можно рассматривать как косвенное указание на связь АГ с первичным поражением почек. Экскреторная урография исключает (или подтверждает) наличие камней, аномалий развития и положения почек (иногда почечных сосудов), которые могут быть причиной макро- и микрогематурии.
При гематурии для исключения опухоли почек, помимо экскреторной урографии, проводят сканирование почек, компьютерную томографию и на завершающем этапе — контрастную ангиографию (аорто- и кавогра-фия).
Диагноз интерстициального нефрита, также проявляющегося микрогематурией, может быть поставлен только с учетом результатов биопсии почек.
Биопсия почки и гистологическое исследование биоптата позволяют окончательно подтвердить диагноз амилоидного ее поражения.
В случае предположения о вазоренальной гипертензии установить ее характер можно по данным контрастной ангиографии.
Эти исследования — биопсия почки и ангиография — проводятся по строгим показаниям.
Ангиографию проводят больным молодого и среднего возраста при стабильной диастолической АГ и неэффективности лекарственной терапии (небольшое снижение АД наблюдается только после применения массивных доз препаратов, действующих на разные уровни регуляции АД).
Данные ангиографии трактуются следующим образом:
1)односторонний стеноз артерии, устья и средней части почечной ар терии, сочетающийся с признаками атеросклероза брюшной аорты (неров ность ее контура), у мужчин среднего возраста характерен для атероскле роза почечной артерии;
2)чередование на ангиограмме участков стеноза и дилатации пора женной почечной артерии с локализацией стеноза в средней трети ее (а не
вустье) при неизмененной аорте у женщин моложе 40 лет свидетельствует о фибромускулярной гиперплазии стенки почечной артерии;
3)двустороннее поражение почечных артерий от устьев и до средней трети, неравномерность контуров аорты, признаки стеноза других ветвей грудной и брюшной аорты характерны для артериита почечных артерий и аорты.
Дополнительные методы диагностики вазоренальной АГ - определение активности ренина плазмы и сцинтиграфия почечных артерий с каптоприлом. Как правило, активность ренина у таких больных повышена в 5-10 раз и более, что обусловлено патогенезом гипертензии, связанным с активацией ренинангиотензинового каскада. Сцинтиграфия с каптоприлом основана на том, что ингибиторы АПФ снижают клубочковую перфузию и кровоток в ишемизированной почке. Таким образом, на ренограммах, выполненных после приема каптоприла, отмечают замедление выведения индикатора со стороны стеноза почечной артерии. Дополнительные методы диагностики вазоренальной АГ - определение активности ренина плазмы и сцинтиграфия почечных артерий с каптоприлом. Как правило, активность ренина у таких больных повышена в 5-10 раз и более, что обусловлено патогенезом гипертензии, связанным с активацией ренинангиотензинового каскада. Сцинтиграфия с каптоприлом основана на том, что ингибиторы АПФ снижают клубочковую перфузию и кровоток в ишемизированной почке. Таким образом, на ренограммах, выполненных после приема каптоприла, отмечают замедление выведения индикатора со стороны стеноза почечной артерии.
Лечение
1.Немедикаментозные мероприятия (как при атеросклерозе иных локализаций)
2.Отказ от курения
3.Нормализация веса тела
4.Борьба с гиподинамией
5.Диета с ограничением тугоплавких жиров и углеводов, поваренной соли (<5 г натрия хлорида)
6.Медикаментозная терапия
7.Ингибиторы АПФ и антагонисты ангиотензина II рецепторов (при одностороннем стенозе)
8.Антагонисты медленных кальциевых каналов
9.β-адреноблокаторы
10.Диуретики
11.Препараты центрального действия (агонисты имидазолиновых рецепторов)
12.Гиполипидемические препараты
13.Хирургические методы
14.Эндоваскулярные процедуры (стентирование, баллонная ангиопластика со стентированием)
15.Реконструкция почечной артерии (почечная и трансаортальная эндартерэктомия, аорторенальное протезирование, разные виды шунтирования)
16.Нефрэктомия (практически не используется)
Для лечения АГ, ассоциированной с односторонним стенозом почечной артерии рекомендовано назначение
1)Ингибиторов АПФ**
2)Блокаторов ангиотензина II рецепторов
Для лечения АГ с одноили двусторонним стенозом почечных артерий рекомендовано назначение β-Адреноблокаторов** и антагонистов кальциевых каналов При одно- и двустороннем стенозе почечных артерий
рекомендовано назначение препаратов центрального действия диуретики
Хирургическое лечение
Реваскуляризация Проведение хирургической сосудистой реконструкции
В основном для хирургического лечения стенозирующих процессов в почках применяют эндоваскулярные вмешательства
(баллонная ангио-пластика со стентированием) и только в тех случаях, когда проведение их становится невозможным,
прибегают в операциям сосудистой реконструкции.
58.Роль инструментальных методов в диагностике заболеваний сердечно-сосудистой системы
ЭКГ:
-анализ деятельности сердца ( определить правильность ритма, подсчитать частоту сердечного ритма, определить расположение электрической оси, наблюдать изменение продолжительсти)
- выявить увеличение отдельных полостей -выявить дистрофические и склеротические изменения в миокарде
Холтеровское мониторирование (регистрация ЭКГ 24-48 часов подряд)
Программа обработки данных обеспечивает выявление и анализ всех видов аритмий и приступов стенокардии. Этот метод позволяет не только точно поставить диагноз, но и существенно повысить эффективность лечения сердечно-сосудистых заболеваний. Всем пациентам при холтеровском мониторировании выдается дневник, в котором пациент отмечает своё самочувствие, жалобы, вид деятельности, физические нагрузки, приём лекарственных препаратов, время бодрствования и сна. Затем, при расшифровке данных, врач сравнивает записи в дневнике с ЭКГ. Очень важно, что регистрация ЭКГ происходит в условиях обычной жизни пациента, что позволяет зарегистрировать различные события, возникающие при повседневной жизни пациента, и которые не удается зафиксировать при регистрации обычной ЭКГ.
Суточное мониторирование АД – это автоматическое измерение артериального давления в течение суток и более (при необходимости) через определенные интервалы, согласно заданной программе. На плечо пациента одевается манжета для измерения АД, соединенная с портативным монитором. Прибор крепится на поясе или на ремне через плечо. Измерения проводятся в амбулаторном режиме, в условиях обычной активности пациента. Аппарат обеспечивает автоматическое измерение пульса, систолического и диастолического АД через установленные интервалы времени осциллометрическим методом, т.е. путем анализа пульсовых явлений в пневмоманжете. Программирование
монитора перед установкой на пациента происходит с помощью компьютера. Результаты измерений запоминаются и отображаются на жидкокристаллическом индикаторе прибора. После окончания исследования монитор подключается к ПЭВМ для обработки и отображения результатов измерений.
Метод позволяет рассчитать среднесуточные показатели АД и пульса, средние значения АД в дневной и ночной период, определяется степень ночного снижения и утреннего повышения АД, реакция АД на физические нагрузки и психоэмоциональные стрессы, степень и длительность гипертонической нагрузки на органы-мишени, вариабельность АД и пульса в течение суток, выявить эпизоды гипотонии.
Суточное мониторирование АД используют для диагностики гипертонической болезни или гипотонии, для подбора медикаментозной терапии, для оценки эффективности и безопасности лечения.
Эхо-КГ: диагностика изменения полостей, выявление пороков сердца, оценка клапанного аппарата, определить сократительную способность миокарда
ФКГ: выявить сердечные шумы, определить их характер, отражает деятельность сердца
Реография: определить кровенаполнение в исследуемых областях, судить о состоянии тонуса, переполнении.
Рентгенологическое исследование:
Рентгенография органов грудной клетки позволяет оценить:
1.легочный рисунок, который отражает артериальный и/или венозный застой или, наоборот, свидетельствует о снижении кровенаполнения малого круга кровообращения;
2.размер камер сердца, магистральных сосудов;
3.форму сердечной тени;
4.состояние тимуса, ход ребер, состояние позвоночника.
59.Принципы лечебного питания при заболеваниях сердечно-сосудистой системы.
Диетотерапия заболеваний сердечно-сосудистой системы, являющаяся важным и эффективным методом комплексной терапии, составляется с учетом основных патогенетических механизмов отдельных заболеваний и направлена на корригирование метаболических нарушений, максимальную разгрузку сердечной деятельности, потенцирование действия лекарственных
препаратов (мочегонных, сердечных гликозидов и др.) и предупреждение их побочных влияний на организм. При назначении лечебного питания необходимо учитывать стадию заболевания, степень выраженности нарушений кровообращения, состояние пищеварения, наличие сопутствующих заболеваний и осложнений.
Общим для всех заболеваний сердечно-сосудистой системы является необходимость ограничения в рационе солей натрия и жидкости, обогащения солями калия и витаминами. Питание должно быть дробным и частым с последним приемом пищи за 3—4 ч до сна с тем, чтобы не затруднять работу органов сердечно-сосудистой системы, тесно связанную с деятельностью органов пищеварения. Диетотерапия отдельных заболеваний органов кровообращения имеет свои особенности.
При проведении диетотерапии заболеваний сердечно-сосудистой системы в основном используются диеты № 10, 10а, 10с, 10и. В осложненных случаях применяются специальные диеты (Карелля, калиевая, фруктовоовощная, гипонатриевая), на которых остановимся подробно.
Диета Карелля предложена в 1865 г. русским врачом Кареллем. В основу питания положено дозированное питание теплым снятым молоком с постепенным увеличением его количества (от 0,8 до 2 л в день). Однако плохая переносимость молока и неполноценность рациона послужили поводом к тому, что эта диета в дальнейшем неоднократно модифицировалась (С. П. Боткин, М. И. Певзнер, Г. Ф. Ланг и другие).
Показания к назначению. Выраженная недостаточность кровообращения (1Ш—III степень). Целевое назначение: повышение диуреза, резкая разгрузка межуточного обмена, противовоспалительное влияние. Общая характеристика: низкая энергетическая ценность с постепенным ее увеличением. Резкое ограничение соли с преобладанием ионов калия и кальция. Преобладание щелочных валентностей над
кислотными. Ограничение свободной жидкости с постепенным увеличением ее количества. Пищу готовят без добавления соли.
Калиевая диета. Рекомендуется при недостаточности кровообращения, гипертонической болезни, массивных отеках. Целевое назначение: увеличение диуреза, разгрузка межуточного обмена, понижение артериального давления, противовоспалительное влияние. Общая характеристика: ограничение энергетической ценности рациона с постепенным увеличением. Повышение содержания свободной жидкости.
Резкое ограничение натрия, исключение соли и экстрактивных веществ. Обогащение рациона калием (соотношение калия к натрию 8 : 1 — 14 : 1).
Кулинарная обработка обычная. Блюда готовят без добавления соли. Режим питания: пища принимается до 6 раз в день. Используется I и II рацион по 2 дня, III и IV — по 3—4 дня. Рекомендуются: дополнительно к диете № 10 продукты, богатые калием (картофель, капуста, курага, шиповник, изюм, инжир, чернослив, яблоки). Исключаются: те же продукты, что в диете № 10.
Диета Кемпнера (рисово-компотная). Является разновидностью калиевой диеты. Показания к применению и целевое назначение то же, что для калиевой диеты. Общая характеристика: ограничение энергетической ценности за счет резкого снижения содержания жиров и белков. Резкое ограничение натрия. Энергетическая ценность
Гипонатриевая диета. Показания к применению: гипертоническая болезнь, в том числе с явлениями атеросклероза сосудов, и симптоматические артериальные гипертензии. Целевое назначение: снижение повышенной возбудимости центральной нервной системы, улучшение функционального состояния почек, снижение функции коры надпочечников и артериального давления. Общая характеристика: оптимальная по энергетической ценности диета с достаточным содержанием белков, жиров и углеводов. Снижение количества рафинированных углеводов. Ограничение соли, жидкости, экстрактивных и других веществ, возбуждающих центральную нервную и сердечно-сосудистую системы, раздражающих почки. Обогащение рациона липотропными веществами, витаминами и клеточными оболочками.
60.Ожирение: классификация, методы диагностики, принципы лечения. Понятие о метаболическом синдроме
Ожирение — это хроническое мультифакторное гетерогенное заболевание, проявляющееся избыточным образованием жировой ткани, прогрессирующее при естественном течении, как правило, имеющее высокий кардиометаболический риск, специфические осложнения и ассоциированные с ним сопутствующие заболевания.
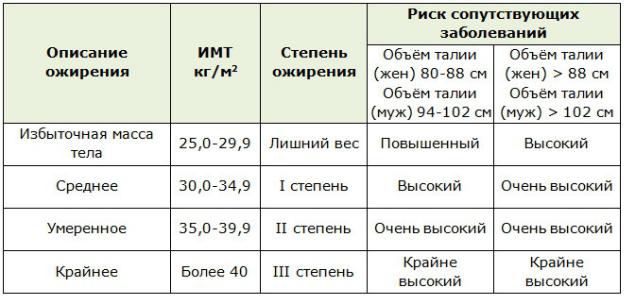
Классификация ожирения
1.Экзогенно-конституциональное ожирение (первичное, алиментарноконституциональное):
1.1.Гиноидное (ягодично-бедренное, нижний тип)
1.2.Андроидное (абдоминальное, висцеральное, верхний тип)
2.Симптоматическое (вторичное) ожирение:
2.1.С установленным генетическим дефектом (в том числе в составе известных генетических синдромов с полиорганным поражением, синдром Лоренса–Муна–Барде– Бидля, остеодистрофия Олбрайта)
2.2.Церебральное (адипозогенитальная дистрофия, синдромы Бабинского– Пехкранца–Фрелиха, Прадера–Вилли)
2.2.1.Опухоли головного мозга
2.2.2.Диссеминация системных поражений, инфекционные заболевания 2.2.3. На фоне психических заболеваний
2.3.Эндокринное:
2.3.1.Гипотиреоидное
2.3.2.Гипоовариальное
2.3.3.Заболевания гипоталамо-гипофизарной системы (болезнь Иценко– Кушинга, синдром Фрелиха, синдром Лоренса–Муна–Бидля, болезни Барракера–Симонса, послеродовые нейроэндокринно-обменные синдромы, гипоталамический синдром периода полового созревания)
2.3.4.Заболевания надпочечников (синдром Иценко–Кушинга, кортикоэстрома
2.3.5.Инсулинома (опухоль поджелудочной железы) 2.4. Ятрогенное
(обусловленное приемом ряда лекарственных препаратов — ГКС)
Диагностика Норма процентного содержания жировой ткани у здоровых мужчин
составляет около 15–20%, у женщин — 25–30% [25]. Процентное содержание жировой ткани может быть косвенно оценено с помощью уравнения
Deurenberg:
% жировой массы = 1,2 (ИМТ) + 0,23 (возраст) — 10,8 (пол) — 5,4,
где возраст — число полных лет, а пол — коэффициент, равный 1 для мужчин и 0 для женщин [26]. Это уравнение имеет стандартную погрешность 4% и учитывает 13 приблизительно 80% всей массы жировой ткани в организме. Несмотря на эти ограничения, некоторые авторы предлагают внести процент жировой ткани в дефиниции ожирения. Процентное содержание жировой ткани более 25% у мужчин расценивается как ожирение, показатели 21–25% являются пограничными. У женщин соответствующие показатели составляют 33% и 31–33%. Для постановки диагноза: «Ожирение, обусловленное избыточным поступлением энергетических ресурсов» необходимо исключить ожирение, связанное с наследственной, эндокринной и иной патологией (вторичное, симптоматическое).
Индекс висцерального ожирения [533–536] ИВО (VAI) — показатель «функции висцеральной жировой ткани» и чувствительности к инсулину, его увеличение в значительной степени связано с повышением кардиоваскулярного риска. Расчет ИВО:
Мужчины: ИВО(VAI) = (ОТ / 39,68 + (1,88 × ИМТ)) × (ТГ/1.03) × (1,31/ЛПВП)
Женщины: ИВО(VAI) = (ОТ/36.58 + (1,89 × ИМТ)) × (ТГ/0,81) × (1,52/ЛПВП)
VAI = 1 для здоровых пациентов с нормальным ИМТ, распределением жировой массы, уровнями ЛПВП и ТГ.
Повозрастные показатели ИВО, при превышении которых сердечно-сосудистый риск резко возрастает:
<30 лет — 2,52 30–42 лет — 2,23 42–52 года — 1,92 52–66 лет — 1,93 > 66 лет — 2,00
Диагноз ожирения и дальнейшее ведение пациента основывается на данных опроса, внешнего осмотра, физикального, лабораторного и инструментального обследования.
При опросе уточняются время возникновения ожирения, динамика изменений веса, наличие ожирения у родственников, образ жизни, физическая активность, режим и характер питания (объем употребляемой пищи и ее состав; частота приемов пищи; время вечернего приема пищи и его состав; частота различного рода застолий), эффективность предшествующей терапии.
I. Алгоритм обследования женщин с ожирением для исключения СПКЯ
1. Анамнез и оценка жалоб больной
-нарушение менструального цикла (олигоменорея менее 9 месяцев в год, аменорея)
-ановуляторное бесплодие
-андрогензависимая дермопатия (гирсутизм, алопеция, акне)
2.Оценка ИМТ и ОТ
3.Гинекологический осмотр
4.Исследование гормонального спектра на 3–5-й день спонтанного или индуцированного (на фоне аменореи) менструального цикла: ЛГ, ФСГ, пролактин, тестостерон, эстрадиол (Э2), дегидроэпиандростерона сульфат (ДГЭА-С), 17-оксипрогестерона (17-ОП), СССГ
5.Исследование биохимического спектра крови: ГПН, липидный спектр, ИРИ натощак
6.УЗИ органов малого таза: увеличение объема яичников более 9 мл, утолщение и уплотнение белочной оболочки, наличие по периферии более 8 фолликулярных кист диаметром 6–10 мм, возможна гиперплазия эндометрия
II. Алгоритм обследования больных с ожирением для исключения гиперкортицизма
1.Данные физикального обследования: центральное ожирение, худые конечности, лунообразное лицо с багровым румянцем, отложение жировой ткани над ключицами и над лопатками («бычий горб»), истончение кожи, кровоточивость, фиолетовые стрии на коже груди, живота, бедер, слабость проксимальных групп мышц, АГ, отеки, застойная сердечная недостаточность
2.Остеопороз и переломы, нарушения менструального цикла, дисфункция половых желез, плохое заживление ран, повышенная частота инфекций
3.Психические нарушения: раздражительность, депрессия, эмоциональная лабильность, расстройства сна
4.Гиперпигментация в околососковой области, складок ладоней и послеоперационных швов характерна для эктопической опухолевой секреции АКТГ
5.Для дифференциальной диагностики проводят короткую супрессивную пробу с дексаметазоном. В 23:00 больной принимает 1 мг дексаметазона, а в 8 утра следующего дня натощак исследуют кровь для определения кортизола в сыворотке. У здоровых продукция АКТГ, кортикотропин-рилизинг гормона (КРГ) и кортизола подавляется. При любой форме гиперкортицизма продукция кортизола не снижается (остается выше 5 мкг%)
6.Надежный диагностический признак истинного синдрома Кушинга — повышение уровня свободного кортизола в суточной моче более чем в 3 раза от нормы. При меньшем увеличении суточной экскреции свободного кортизола требуются дополнительные исследования в условиях специализированного эндокринологического отделения опытным эндокринологом
III. Алгоритм обследования больных с ожирением для исключения гипотиреоза
1.Данные анамнеза: тиреоидэктомия, радиойодтерапия, хронический аутоиммунный тиреоидит (тиреоидит Хасимото), реже — подострый тиреоидит, наружное облучение шеи
2.Лекарственный анамнез: прием амиодарона, препаратов лития, интерферона, антитиреоидные средства
3.Частые симптомы гипотиреоза (неспецифические): непереносимость холода, сухость кожи, слабость, запоры, боли в суставах, выпадение волос, запоры, нарушения менструального цикла, снижение памяти, сонливость
4.Физикальные данные (частые признаки): АГ (повышение ДАД), брадикардия, желтоватый цвет лица, периорбитальные отеки, синдром запястного канала, замедление глубоких сухожильных рефлексов, снижение температуры тела, умеренная мышечная слабость, медлительность в движениях
5.Лабораторные показатели: повышение ТТГ, снижение свободного Т4, в ОАК нормоили гипохромная анемия, дислипидемия (IIa или IIb по Фридериксену)
IV. Алгоритм обследования больных с ожирением для исключения гиперпролактинемии
1.Особенности клинических проявлений: нарушение менструального цикла и галакторея, снижение либидо и потенции, эректильная дисфункция, гинекомастия, бесплодие
2.Психоэмоциональные расстройства: астения, нарушение памяти, эмоциональная лабильность, повышенная тревожность, склонность к депрессии, психовегетативные реакции
3.При пролактинсекретирующих опухолях гипофиза наблюдается более выраженная степень ожирения (2–3-й ст.)
4.Лабораторные показатели: атерогенная дислипидемия, повышение пролактина (100 нг/мл и выше)
5.Осмотр окулиста (поля зрения, глазное дно)
6.МРТ головного мозга
V. Алгоритм обследования больных для исключения гипоталамического генеза ожирения
1.Особенности клиники: быстрое увеличение массы тела у лиц молодого возраста, связь ожирения с перенесенной инфекцией (вирусный энцефалит), травмой, опухолью церебральных структур, общесоматической инфекцией (ангина, хронический тонзиллит, ревматизм, корь, паротит, скарлатина); головные боли, повышение АД, расстройства сна (чаще бессонница), нарушение потоотделения, вегетативные кризы, склонность к симпатоадреналовым реакциям
2.Характер ожирения: отложение жира в области груди, живота (в виде фартука), ягодиц, бедер
3.Трофические изменения кожи: сухость, полосы растяжения (стрии) белые или розовые, угревая сыпь
4.Сочетание ожирения с различными эндокринными нарушениями (снижением функции половых желез, вторичным гиперкортицизмом, нарушением углеводного, водно-солевого обмена)
5.Осмотр невролога
6.В зависимости от типа гормональных нарушений выделяют следующие нозологии:
-Адипозо-генитальная дистрофия (синдром Бабинского–Фрелиха): ожирение, гипофункция половых желез в детском возрасте или у подростков, гипогенитализм, часто отставание в росте
-синдром Лоренса–Муна–Бидля: ожирение, пигментный ретинит, задержка роста, дебильность, костные аномалии (деформация костей черепа, грудной клетки, полидактилия, синдактилия), врожденный порок сердца
-синдром Морганьи–Стюарта–Мореля (диабет «бородатых женщин»): ожирение у женщин зрелого возраста, вирилизация, высокая гипертензия, гиперостоз (утолщение) внутренней пластинки лобной и затылочной кости черепа, сахарный диабет
-пубертатный базофилизм: ожирение, розовые полосы растяжения, гипертензия, асимметрия АД, высокий рост, ускорение физического и полового развития, дифференцировка скелета, отсутствие остеопороза, более высокое содержание АКТГ и кортизола в плазме и некоторое повышение экскреции 17-ОКС с мочой, нормальный суточный ритм.
Немедикаментозное лечение
Питание
Коррекция диеты рекомендуется всем пациентам.
Для уменьшения калорийности питания рекомендуется [46]:
−ограничение потребления пищи с высокой энергетической плотностью (включая пищу, содержащую животные жиры, другие продукты с высоким содержанием жиров, кондитерские изделия, сладкие напитки и т.д.) и выбор пищи с низкой энергетической плотностью (например, крупы, фрукты, овощи) (Приложение 8);
−прекращение употребления пищи быстрого приготовления и продукции сетей быстрого питания;
−ограничение употребления алкоголя (для пациентов, потребляющих алкоголь, — употребление ≤2 порций для мужчин и ≤1 порции для женщин в сутки). Одна порция алкоголя = 10 мл (8 г) этанола (спирта).
Целевое количество ежедневно потребляемых калорий должно рассчитываться индивидуально для каждого пациента путем определения его энергетического баланса по формуле:
Суточный расход энергии для женщин:
18–30 лет: (0,0621 х вес в кг +2,0357) х 240,
31–60 лет: (0,0342 х вес в кг + 3,5377) х 240,
старше 60 лет: (0,0377 х вес в кг
+ 2,7546) х 240.
Суточный расход энергии для мужчин:
18–30 лет: (0,0630 х вес в кг + 2,8957) х 240,
31–60 лет: (0,0484 х вес в кг + 3,6534) х 240,
старше 60 лет: (0,0491 х вес в кг
+ 2,4587) х 240.
Средние цифры калорийности рациона для поддержания энергетического баланса составляют:
−1200–1500 ккал/сут для женщин
−1500–1800 ккал/сут для мужчин
Для снижения веса должен быть достигнут дефицит калорий в размере 500–750 ккал/сутки или около 30% от общей калорийности, рассчитанной для пациента.
Физическая активность
Для профилактики ожирения и гиподинамии, а также с целью снижения риска сердечнососудистых осложнений взрослым необходимо по крайней мере 150 мин (2 часа 30 мин) в неделю аэробной физической активности умеренной интенсивности или 75 мин (1 час 15 мин) в неделю аэробной физической активности высокой интенсивности [60–61].
Пациентам с ожирением и избыточной массой тела рекомендуется 225–300 мин в неделю физической активности умеренной интенсивности или 150 мин в неделю аэробной физической активности высокой интенсивности, что эквивалентно тратам в 1800–2500 ккал в неделю.
Психотерапия Поведенческая терапия
Поведенческая терапия — это изменение особенностей поведения, которые способствуют чрезмерному потреблению пищи, неправильному питанию, сидячему образу жизни
Косметологические методы коррекции массы жировой ткани
Существует большое количество инвазивных (липосакция) и неинвазивных (криолиполиз, радиочастотное воздействие, инфракрасное облучение, мезотерапия, инъекции
фосфатидилхолина, УЗ воздействие, ударно-волновая терапия и т. д.) косметологических процедур, разработанных для локального уменьшения количества подкожного жира.
Медикаментозное лечение
Орлистат. Производное лейцина, ингибирует желудочно-кишечные липазы, что на 30% уменьшает всасывание триглицеридов в кишечнике. Может применяться в течение длительного времени. Эффективность сохраняется на всем протяжении приема препарата. Степень безопасности сравнима с плацебо. Не имеет неблагоприятных сердечно-сосудистых эффектов.
Препарат в дозе 60 мг 3 раза в сутки относится к безрецептурным препаратам, а в дозе 120 мг 3 раза в сутки — к препаратам, отпускаемым по рецепту.
Сибутрамин. Препарат центрального действия, ингибитор обратного захвата серотонина и норадреналина. Вследствие такого двойного эффекта достигается чувство насыщения и снижается количество потребляемой пищи, увеличивается расход энергии в результате усиления термогенеза. Не может применяться более 1 года. После прекращения приема происходит быстрое восстановление массы тела. Препарат эффективен в дозе 10–15 мг/сутки и малоэффективен в дозе 5 мг/сутки. По данным мета анализа среднее снижение веса на терапии сибутрамином составляет 4.2 кг [90]. Наибольшая эффективность наблюдается в течение первых 1–3 месяцев терапии с последующим ее снижением.
Лираглутид — аналог человеческого глюкагоноподобного пептида-1 (ГПП-1), произведенный методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae, имеющий 97% гомологичности с человеческим ГПП-1, который связывается и активирует рецепторы ГПП-1 у человека. Лираглутид снижает массу тела и уменьшает жировую ткань при помощи механизмов, вызывающих уменьшение чувства голода и снижение расхода энергии. Он действует как гормон насыщения, снижая аппетит и объем потребляемой пищи. Терапию лираглутидом при ожирении начинают с дозы 0,6 мг/сут в виде подкожных инъекций. Затем каждую неделю дозу увеличивают на 0,6 мг/сут до 3,0 мг/сут. При развитии побочных эффектов, например, тошноты, следует приостановить эскалацию дозы до их исчезновения.
Показания к хирургическому лечению
Хирургическое лечение может проводиться при неэффективности ранее проводимых консервативных мероприятий (недостаточное снижение массы тела, повторный набор массы тела после лечения, недостаточная компенсация сопутствующей патологии) у лиц в возрасте
18–60 лет и [105–110]:
•ИМТ > 40 кг/м2 (независимо от наличия сопутствующих заболеваний);
•ИМТ > 35 кг/м2 и наличие тяжелых заболеваний, на течение которых можно воздействовать путем снижения массы тела (IIА).
ДЫХАТЕЛЬНАЯ СИСТЕМА
1.Хронический обструктивный бронхит: этиология, патогенез,
классификация. |
|
Хронический обструктивный бронхит - хроническое прогрессирующее |
|
заболевание, в основе которого лежит дегенеративновоспалительное |
|
неаллергическое поражение слизистой трахеобронхиального дерева, обычно |
|
развивающееся в результате длительного раздражения воздухопроводящих |
|
путей вредными агентами с перестройкой секреторного аппарата и |
|
склеротическими изменениями в бронхиальной стенке характеризуется |
|
кашлем с выделением мокроты не менее 3 мес. в течение более 2 лет подряд; |
|
диагноз ставится после исключения других возможных причин длительного |
|
кашля. Согласно рекомендации ВОЗ, бронхит может считаться |
|
хроническим, если больной откашливает мокроту на протяжении |
|
большинства дней не менее 3 мес подряд в течение более 2 лет подряд. |
|
Классификация: |
|
Хронический бронхит подразделяется на первичный и вторичный. |
|
П е р в и ч н ы й |
ХБ является самостоятельным заболеванием, не |
связанным с какими-то иными бронхолегочными процессами или |
|
поражением других органов и систем. При первичном ХБ наблюдается |
|
диффузное поражение бронхиального дерева. |
|
В т о р и ч н ы й |
ХБ развивается на фоне других заболеваний, как |
легочных (туберкулез, бронхоэктатическая болезнь, ХП и т.д.), так и вне- |
|
легочных (уремия, застойная сердечная недостаточность и т.д.). Чаще |
|
всего вторичный ХБ сегментарный, т.е. носит локальный характер. |
|
В данном разделе рассматриваются только различные формы |
|||||
первичного хронического бронхита, составляющего около 30 % в |
|||||
структуре |
неспецифических |
заболеваний легких среди городского |
|||
населения. |
|
|
|
|
|
Простой |
(катаральный) |
хронический |
обструктивный |
бронхит; |
|
Слизисто-гнойный |
хронический |
обструктивный |
бронхит; |
||
Гнойный хронический обструктивный бронхит. |
|
||||
Этиология. Развитие ХБ в значительной степени определяется внешними воздействиями — экзогенными факторами: табачный дым (при активном и пассивном курении); загрязнение воздушного бассейна; неблагоприятные условия профессиональной деятельности; климатические факторы; инфекционные факторы (вирусная инфекция).
В связи с тем что заболевание возникает не у всех подвергающихся одинаково неблагоприятным воздействиям, выделяют также внутренние причины, обусловливающие развитие ХБ — эндогенные факторы: патология носоглотки, нарушение дыхания через нос и очищения вдыхаемого воздуха, повторные острые респираторные заболевания (ОРЗ), острые бронхиты и очаговая инфекция верхних дыхательных путей, наследственная предрасположенность (нарушение ферментных систем — ои-антитрип-сина и др., местного иммунитета), нарушение обмена веществ (ожирение).
Среди экзогенных факторов главная роль в возникновении хронического бронхита принадлежит поллютантам — примесям различной природы, содержащимся во вдыхаемом воздухе. Инфекция в развитии ХБ играет второстепенную роль, однако она является главной причиной обострения болезни.
Патогенез. Под воздействием экзогенных и эндогенных факторов возникает ряд патологических процессов в трахеобронхиальном дереве
•Изменяются структурно-функциональные свойства слизистой оболочки и подслизистого слоя.Развивается воспаление слизистой оболочки.
•Нарушаются проходимость и дренажная функция бронхов.
▲Изменения структурно-функциональных свойств слизистой оболочки и подслизистого слоя выражаются в гиперплазии и гиперфункции бокаловидных клеток, бронхиальных желез, гиперсекреции слизи и изменении ее свойств (слизистый секрет становится густым, вязким и засасывает реснички мерцательного эпителия), что приводит к нарушению в системе мукоцилиарного транспорта. Снижается выработка секреторного IgA, уменьшается содержание в слизи лизоцима и лактоферрина. Развивается отек слизистой оболочки, а затем — атрофия и метаплазия эпителия.
Усилению слизеобразования и изменению состава слизистого секрета способствуют также наследственная предрасположенность (дефицит протео-литических ферментов, отчетливо проявляющийся в условиях повышенной потребности в них) и воздействие бактериальной и вирусной инфекции.
•Воспаление слизистой оболочки вызывают различные раздражаю щие вещества в сочетании с инфекцией (вирусной и бактериаль ной). Химические вещества, содержащиеся в воздухе, вызывают
повреждение в дыхательных путях, сопровождающееся отеком слизистой оболочки и торможением активности реснитчатого эпителия. Это приводит к нарушению эвакуаторной и снижению барьерной функции слизистой оболочки бронхов. Катаральное содержимое сменяется катарально-гнойным, а затем гнойным.
Распространение воспалительного процесса на дистальные отделы бронхиального дерева нарушает выработку сурфактанта и снижает активность альвеолярных макрофагов, которые осуществляют фагоцитоз бактерий и других чужеродных частиц.
Если бронхоспазм (как проявление воспаления) выражен резко, то говорят о развитии бронхоспастического (неаллергического) компонента. Вместе с тем инфекция при обострении воспаления может способствовать присоединению астматического (аллергического) компонента — одного из осложнений ХБ, позволяющего отнести такой ХБ к предастме.
Исходом воспалительного процесса могут быть коллапс мелких бронхов и облитерация бронхиол.
•Нарушение проходимости и дренажной функции (обструктивный синдром) бронхов развивается как следствие сочетания ряда факторов:
▲спазма гладких мышц бронхов, возникающего в результате непо средственного раздражающего воздействия экзогенных факторов и воспалительных изменений слизистой оболочки;
▲гиперсекреции слизи, изменения ее реологических свойств, при водящих к нарушению мукоцилиарного транспорта и закупорке бронхов вязким секретом;
▲метаплазии эпителия из цилиндрического в многослойный плос кий и его гиперплазии; А нарушения выработки сурфактанта;
▲воспалительного отека и инфильтрации слизистой оболочки; ▲коллапса мелких бронхов и облитерации бронхиол; ▲аллергических изменений слизистой оболочки.
При вовлечении в процесс бронхов преимущественно крупного калибра (проксимальный бронхит) нарушения бронхиальной проходимости не выражены.
Поражение мелких бронхов и бронхов среднего калибра протекает часто с нарушением бронхиальной проходимости.
При изолированном поражении мелких бронхов (дистальный бронхит), лишенных кашлевых рецепторов, одышка может быть единственным симптомом такого бронхита. Кашель появляется позже, при вовлечении в процесс более крупных бронхов.
Различные соотношения изменений слизистой оболочки, проявляющиеся в ее воспалении и(или) бронхообструктивных нарушениях, обусловливают формирование той или иной
клинической формы болезни: при катаральном необструктивном бронхите преобладают поверхностные изменения структурно-функциональных свойств слизистой оболочки; при слизисто-гнойном (или гнойном) бронхите преобладают процессы инфекционного воспаления.
Возможен переход одной клинической формы бронхита в другую. Так, катаральный бронхит, длительно протекая, может вследствие присоединения инфекции стать слизистогнойным и т.п.
При необструктивном варианте всех клинических форм ХБ вентиляционные нарушения выражены, как правило, незначительно.
Обструктивные нарушения при ХБ могут вначале появляться только на фоне обострения заболевания и быть обусловлены воспалительными изменениями бронхов, гипер- и дискринией, бронхоспазмом (обратимыми компонентами обструкции), но затем сохраняются постоянно. Чаще отмечается медленное, постепенное нарастание обструктивного синдрома.
При обструктивном варианте ХБ преобладает утолщение слизистой оболочки и подслизистого слоя, сочетающееся с отеком и гиперсекрецией при развитии его на фоне катарального бронхита или с большим количеством гнойного бронхиального содержимого. Для обструктивной формы ХБ характерны стойкие обструктивные нарушения вентиляции.
Развившаяся обструкция мелких бронхов приводит к эмфиземе легких. Прямой зависимости между выраженностью бронхиальной обструкции и эмфиземы не существует.
В своем течении ХБ претерпевает определенную эволюцию. В результате развития эмфиземы и пневмосклероза отмечается неравномерная вентиляция легких, образуются гипер- и гиповентилируемые участки. В сочетании с местными воспалительными изменениями это приводит к нарушению газообмена, дыхательной недостаточности, артериальной гипоксемии и легочной гипертензии с последующим развитием правожелудочковой недостаточности — основной причины смерти больных ХБ.
2.Хронический обструктивный бронхит: принципы диагностики и лечения.
При обструктивном варианте бронхита (любой его форме) кашель малопродуктивный и надсадный, сопровождается одышкой, мокрота (даже гнойная) выделяется в небольшом количестве – не менее 3 месяцев в течение более 2 лет. Если бронхит начинается с поражения дистальных бронхов, то кашля может не быть, а единственным
симптомом заболевания является нарастающая по времени экспираторная одышка, варьирующая в очень широких пределах – от ощущения одышки при незначительных физических нагрузках до тяжелой дыхательной недостаточности, определяемой даже при незначительных физических упражнениях и в покое
Одышка возникает у всех больных ХБ в различные сроки от начала болезни. Появление у «длительно кашляющих» больных одышки первоначально лишь при значительной физической нагрузке обычно свидетельствует о присоединении бронхиальной обструкции. С увеличением продолжительности болезни одышка становится более выраженной и постоянной, свидетельствуя о развитии дыхательной (легочной) недостаточности. Иногда только появление одышки заставляет больных впервые обратиться к врачу.
На II э т а п е диагностического поиска в начальный период болезни патологические симптомы могут отсутствовать. В дальнейшем появляются изменения при аускультации: жесткое дыхание (при развитии эмфиземы может стать ослабленным) и сухие хрипы рассеянного характера, тембр которых зависит от калибра пораженных бронхов. Свистящие хрипы, особенно хорошо слышимые на выдохе, характерны для поражения мелких бронхов. Если при обычном дыхании хрипы не выслушиваются, то следует проводить аускультацию в положении больного лежа и обязательно при форсированном дыхании.
Изменения данных аускультации будут минимальными при хроническом необструктивном бронхите в стадии ремиссии и наиболее выражены при обострении
процесса, когда можно прослушать и влажные хрипы, калибр которых также зависит от уровня поражения бронхиального дерева. Влажные хрипы при ХБ могут исчезать после хорошего откашливания и выделения мокроты.
При обострении обструктивного бронхита одышка усиливается, нарастают явления дыхательной недостаточности. Гнойный вязкий секрет еще больше затрудняет проходимость бронхов.
Обструктивный компонент может присоединяться к катаральной и слизисто-гнойной формам бронхита в период обострения или в процессе их эволюции. Бронхиальная обструкция значительно «утяжеляет» течение бронхита.
При обследовании больного выявляются признаки бронхиальной обструкции: 1) удлинение фазы выдоха при спокойном и особенно при форсированном дыхании; 2) свистящие хрипы на выдохе, которые хорошо слышны при форсированном дыхании и в положении лежа; 3) симптомы обструктивной эмфиземы легких.
III э т а п диагностического поиска имеет различную степень значимости в диагностике ХБ в зависимости от стадии течения процесса.
Рентгенологическое исследование органов грудной клетки проводится всем больным ХБ. У большинства из них на обзорных рентгенограммах изменения в легких отсутствуют. В ряде случаев наблюдается сетчатая деформация легочного рисунка, обусловленная развитием пневмосклероза. При длительном течении процесса выявляются признаки эмфиземы легких. «Выбухание» ствола легочной артерии на левом контуре тени сердца, расширение прикорневых артерий с последующим конусообразным их сужением и уменьшением диаметра периферических разветвлений отмечается при развитии легочного сердца.
Рентгенологическое исследование органов грудной клетки оказывает помощь в диагностике осложнений (острая пневмония, бронхоэктазы) и в дифференциальной диагностике с заболеваниями, при которых симптомы бронхита могут сопутствовать основному процессу (туберкулез, опухоль бронха и т.д.).
Бронхография чаще используется не для подтверждения наличия ХБ, а для диагностики бронхоэктазов.
Бронхоскопия имеет большое значение в диагностике ХБ и дифференциации его от заболеваний, проявляющихся сходной клинической картиной.
Бронхоскопическое исследование преследует различные цели.
Исследование газов крови и кислотно-основного состояния важно для диагностики различных степеней дыхательной недостаточности. Оценка степени дыхательной недостаточности проводится с учетом уровня РОг и Рсо2 и данных вентиляционных показателей (МОД, МВЛ и ЖЕЛ). Разделение дыхательной недостаточности по степеням см. «Легочное сердце».
Радиопульмонография с использованием радиоактивного изотопа шХе проводится для выявления неравномерности вентиляции, связанной с обструкцией мелких бронхов. Это наиболее ранний диагностический признак такого вида бронхиальной обструкции, когда объем форсированного выдоха (ОФВ() еще не изменен.
Электрокардиография необходима для выявления развивающейся при легочной гипертензии гипертрофии правого желудочка и правого предсердия. Наиболее значимыми являются следующие признаки: выраженное отклонение оси ORS вправо; смещение переходной зоны влево (R/S < 1 в V4 —Ve); 5-тип ЭКГ; высокий острый зубец Р в
отведениях aVF, III , II.
Проба с физической нагрузкой рекомендуется в тех случаях, когда степень одышки не коррелирует с изменениями ОФВ]. Обычно используют простую шаговую пробу.
Клинический анализ крови при хроническом бронхите иногда выявляет вторичный эритроцитоз, возникший вследствие хронической гипоксии при развитии выраженной легочной недостаточности. Активность воспалительного процесса общий анализ крови отражает в меньшей степени, чем при других заболеваниях. «Острофазовые» показатели часто выражены умеренно: СОЭ может быть нормальная или увеличена умеренно (вследствие эритроцитоза иногда отмечается уменьшение СОЭ); лейкоцитоз обычно
небольшой, так же как и сдвиг лейкоцитарной формулы влево. В крови возможна эозинофилия, что, как правило, является свидетельством аллергических проявлений.
Биохимическое исследование крови проводят для уточнения активности воспалительного процесса. Определяют содержание общего белка и его фракций, а также СРВ, сиаловых кислот и серомукоида в сыворотке крови. Повышение их уровня характерно для воспалительного процесса любой локализации. Решающая роль в оценке степени активности воспаления в бронхах принадлежит данным бронхоскопической картины, исследованию содержимого бронхов и мокроты.
При неконтролируемом прогрессировании процесса следует проводить иммунологическое исследование крови и/или бронхиального содержимого.
Исследование мокроты и бронхиального содержимого помогает установить выраженность воспаления. При выраженном воспалении содержимое преимущественно гнойное или гнойнослизистое, содержит много ней-трофилов и единичные макрофаги, скудно представлены дистрофически измененные клетки мерцательного и плоского эпителия.
Для умеренно выраженного воспаления характерно содержимое ближе к слизистогнойному; количество нейтрофилов увеличено незначительно. Растет количество макрофагов, слизи и клеток бронхиального эпителия.
При слабо выраженном воспалении бронхиальное содержимое преимущественно слизистое, преобладают слущенные клетки эпителия бронхов; макрофагов и нейтрофилов мало.
Обнаружение эозинофилов свидетельствует о местных аллергических реакциях. Наличие в мокроте атипических клеток, микобактерий туберкулеза, эластических волокон играет существенную роль в пересмотре существовавшей ранее диагностической концепции соответственно в пользу бронхогенного рака, туберкулеза, абсцесса легкого.
Микробиологическое исследование мокроты и содержимого бронхов важно для выявления этиологии обострения хронического бронхита и выбора антимикробной терапии.
Критерием этиологической значимости возбудителя при количественном микробиологическом исследовании служат:
а) выявление возбудителя (пневмококк или гемофильная палочка) в мокроте в концентрации 106 в 1 мкл и выше при отсутствии антибактери альной терапии;
б) обнаружение в 2 — 3 исследованиях с интервалом в 3 — 5 дней условно-патогенных микроорганизмов в концентрации 106 в 1 мкл и выше;
в) исчезновение или значительное уменьшение количества микроорга низмов при динамическом исследовании на фоне клинически эффективной антибактериальной терапии.
ЛЕЧЕНИЕ
При простом (катаральном) хроническом обструктивном бронхите основным методом лечения является использование откаркивающих средств, направленных на нормализацию мукоцилиарного клиренса и профилактики присоединения гнойного воспаления. В качестве отхаркивающих можно использовать препараты рефлекторного действия термопсис и эпикуана, алтей, багульник или резобтивного действия - йодистый калий, бромгексин; или муколитики и мукорегуляторы - амброксол, ацетилцистеин, карбоцистеин, которые разрушают мукополисахариды и нарушают синтез сиалумуцинов мокроты. При обострении процесса проводят 1-2 недельные антибактериальную терапию с учетом антибиотикограмм. Предпочтение отдается препаратам макролидов новых генераций,
амоксициллин+клавулановая кислота, клиндамицин в сочетании с муколитиками. При обострениях заболевания назначают антибактериальную терапию (спирамицин 3000 000 ЕД х 2 раза, 5-7 дней, амоксициллин+клавулановая кислота 500 мг х 2 раза, 7 дней, кларитромицин 250 мг х 2раза, 5-7 дней, цефтриаксон 1,0 х 1 раз, 5 дней). При гипертермии назначают парацетамол. По получению результатов бактериологического исследования в зависимости от клинического эффекта и выделеннной микрофлоры вносятся коррективы в лечение (цефалоспорины, фторхинолоны
идр.). Важное место в лечении ХБ принадлежит методам лечебной дыхательной гимнастики, направленных на улучшение дренажной функции бронхиального дерева и тренировку дыхательной мускулатуры. Одновременно с этим, определенное значение имеют физиотерапевтические методы лечения и лечебный массаж дыхательной мускулатуры. Для лечения
ипрофилактики возникновения микоза при длительной массивной антибиотикотерапии итраконазол оральный раствор по 200 мг 2 р\сут в течение 10 дней.
Основой симптоматического лечения хронического бронхита являются бронхолитические средства, предпочтительно в ингаляциях - фиксированная комбинация фенотерола и ипротропия бромида. Ингаляционные кортикостероиды регулярно используются только для пациентов с клиническим улучшением и зафиксированным положительным спирометрическим ответом на пробный курс ингаляционных кортикостероидов или • ОФВ1< 50% от должных значений и повторных обострениях (например, 3 раза за последние 3 года).
Показания к госпитализации:
1. Субфебрильная температура более 3 дней и выделение гнойной мокроты; 2. Снижение показателей ФВД более 10 % от исходных ОФВ1, ЖЕЛ,
ФЖЕЛ, Тифно; 3. Нарастание дыхательной недостаточности и признаки сердечной недостаточности.
Перечень основных медикаментов:
1.*Ипратропия бромид аэрозоль 100 доз, ипратропия бромид 21 мкг.
2.*Сальбутамол аэрозоль 100 мкг/доза; таблетка 2 мг, 4 мг; раствор для небулайзера 20 мл
3.*Теофиллин таблетка 200 мг, 300 мг таблетка ретард 350 мг
4.*Фенотерол аэрозоль 200 доз 5. *Салметерол аэрозоль для ингаляции
250мкг/доза
6.**Амброксол сироп 15 мг/5 мл; 30мг/5 мл; раствор 7,5 мг/мл
7.**Амоксициллин пероральная суспензия 250 мг/5 мл
8.** Амоксициллин+клавулановая кислота таблетки, покрытые оболочкой 500 мг/125 мг, 875 мг/125 мг, порошок для приготовления раствора для внутривенного введения во флаконах 500мг/100мг,
1000мг/200мг
9. **Парацетамол сироп 2,4% во флаконе; суспензия; суппозитории 80 мг 10. *Азитромицин 500 мг, капсулы
11.Итраконазол оральный раствор 150 мл – 10 мг\мл
12.*Метронидазол 250 мг, табл. 13. *Ипратропия бромид 21 мкг+фенотерола гидробромид 50 мкг Перечень дополнительных медикаментов:
1.*Аминофиллин раствор для инъекций 2,4% в ампуле 5 мл, 10 мл
2.*Бекламетазон аэрозоль 200 доз
3.*Флютиказон аэрозоль 120 доз
4.*Кларитромицин 500 мг, табл.
5.*Спирамицин 3 млн. ЕД, табл.
3.Пневмонии: этиология, классификация, клиника, диагностика.
Пневмонии – группа различных по этиологии, патогенезу, морфологической характеристике острых инфекционных (преимущественно бактериальных) заболеваний, характеризующихся очаговым поражением респираторных отделов легких с обязательным наличием внутриальвеолярной экссудации.
Э т и о л о г и я : 1) бактериальные (с указанием возбудителя); 2) вирусные (с указанием возбудителя); 3) орнитозные; 4) риккетсиозные; 5) микоплазменные; 6) грибковые (с указанием вида); 7) смешанные; 8) аллергические, инфекционноаллергические; 9) неустановленной этиологии. Большинство случаев заболевания
ассоциируется с относительно небольшим кругом патогенов, к которым относят S.pneumoniae (30-50%), M.pneumoniae и C.pneumoniae (20-30%), H.influenzae, респираторные вирусы, энтеробактерии, S.aureus и L.pneumophila.
внебольничные пневмониии:
•-Streptococcus pneumoniae
•-Mycoplazma pneumoniae
•-Hemophilus influenzae
•-Influenza virus
•-Chlamidia pneumoniae
•-Legionella spp.
•-Staphylococcus aureus - редко
•-Грам отрицательная флора - редко
•-В 20-30% этиология пневмоний не устанавливается госпитальные пневмонии:
•Грам - положительная флора:
•-Staphylococcus aureus
•-Streptococcus pneumoniae
•Грам - отрицательная флора:
•-Pseudomonas aeruginoza
•-Klebsiella pneumoniae
•-Echerichia coli
•-Proteus mirabilis
•-Legionella pneumophila
•-Hemophilus influenzae
•-Анаэробы
•-Вирусы
•-Aspergilus,Candida
•-Pneumocystis carini
Классификация.
Внебольничная пневмония (домашняя, амбулаторная), приобретенная вне лечебного учреждения (МКБ-10; J 15.9).
внутрибольничные (нозокомиальные), возникающие через 48-72 ч после госпитализации по поводу других заболеваний; Аспирационная пневмония.
Пневмония у лиц с тяжелыми дефектами иммунитета (врожденный иммунодефицит, ВИЧ-инфекция, ятрогенная иммуносупрессия).
атипичные (микоплазменные, легионелезные, хламиджийные). (МКБ-10) подразделяет пневмонии по:
этиологии,
локализации и протяженности (односторонние: лево- и правосторонние, тотальные, долевые, сегментарные, субдольковые, центральные, прикорневые, двусторонние),
тяжести клинического течения: тяжелые, средней тяжести, легкие, абортивные,
характеру клинического течения: типичные (бактериальные, вирусные) и атипичные (острый респираторный синдром, «атипичная пневмония»).
Внебольничная |
Нозокомиальная |
Связанная с оказанием |
|
|
медицинской помощи |
|
|
|
|
|
|
I. |
Типичная (у пациентов |
I.Собственно |
|
I.Пневмония |
|
у |
жителей |
|||||||
|
с |
отсутствием |
нозокомиальнаяю |
|
домов престарелых. |
|
|
|
||||||
|
выраженных нарушений |
II.Вентилятор- |
|
II. |
|
|
Прочие |
|
категории |
|||||
|
иммунитета): |
|
|
|
|
|
||||||||
• бактериальная; |
|
ассоциированная |
|
пациентов: |
|
|
|
|
|
|||||
|
III.Нозокомиальная |
|
• антибактериальная терапия |
|||||||||||
• вирусная; |
|
с |
||||||||||||
|
пневмонияу |
пациентов |
в предшество-вавшие 3 мес; |
|||||||||||
• грибковая; |
|
выраженными |
нарушениями |
• |
|
госпитализация |
(по |
|||||||
|
иммунитета: |
|
|
|
||||||||||
• микобактериальная; |
|
|
|
|
любому поводу) в течение 2 сут |
|||||||||
|
• у реципиентов донорских и более |
|
|
|
|
|
|
|
||||||
• паразитарная. |
|
органов; |
|
|
в |
|
|
предшествовавшие |
||||||
|
• у пациентов, получающих |
|
|
|||||||||||
II. |
У |
пациентов |
с |
90 дней; |
|
|
|
|
|
|
||||
цитостатическую терапию |
|
• |
пребывание |
|
в |
других |
||||||||
выраженными |
нарушениями |
|
|
|
|
|||||||||
иммунитета: |
|
|
|
|
|
учреждениях длительного ухода; |
||||||||
•синдром приобретенного |
|
|
|
•хронический гемодиа-лиз в |
||||||||||
иммунодефицита (СПИД); |
|
|
|
|
течение 30 сут и более; |
|
||||||||
• |
прочие |
заболевания |
и |
|
|
|
• |
|
обработка |
|
раневой |
|||
патологические состояния. |
|
|
|
|
поверхности |
в |
|
домашних |
||||||
III. |
Аспирационная |
|
|
|
условиях; |
|
|
|
|
|
|
|||
|
|
|
• |
|
|
иммунодефицитные |
||||||||
пневмония /абсцесс лёгкого |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
состояния/заболевания |
|
||||||
|
Интоксикационный |
(общая |
слабость, |
разбитость, |
головные |
и |
мы |
|
шечные боли, одышка, сердцебиение, бледность, снижение аппетита). |
|
|
||||
• |
Синдром инфекционного воспаления в легких: кашель, лихорадка, лабораторные |
||||||
• |
изменения (СОЭ, СРБ, острофазовые сдвиги, лейкоцитоз и др); |
|
|
|
|||
Синдром инфильтрации лёгочной ткани: отставание пораженной стороны легких |
|||||||
|
при дыхании (если очаг локализуется в нижней доле), уменьшение подвижности |
|
|||||
|
легочного края на стороне поражения, притупление перкуторного звука над очагом |
||||||
|
уплотнения, при аускультации в первые часы - ослабленное дыхание, затем оно |
|
|||||
|
становится жестким, крепитация выслушивается также с первых часов, влажные |
|
|||||
|
мелкопузырчатые хрипы, возможно наличие шума трения плевры.Голосовое |
|
|
||||
|
дрожание над очагом уплотнения усилено. В стадии разрешения подвижность |
|
|||||
|
легочного края постепенно увеличивается, перкуторный легочный звук вновь |
|
|||||
|
становится с тимпаническим оттенком, дыхание жесткое, затем становится |
|
|
||||
|
везикулярным, вновь появляется крепитация и влажные мелкопузырчатые хрипы, |
|
|||||
• |
количество которых постепенно уменьшается. |
|
|
|
|
||
Синдром интоксикации |
|
|
|
|
|
||
• |
Синдром дыхательной недостаточности |
|
|
|
|
||
• |
Синдром гемодинамических изменений |
|
|
|
|
||
• |
Синдром почечной недостаточности |
|
|
|
|
||
• |
Синдром ДВС |
|
|
|
|
|
|
• |
Респираторный дистресс-синдром |
|
|
|
|
||
• |
Синдром вовлечения других органов и систем (сердечно-сосудистой |
|
|
||||
|
системы, пищеварительного тракта, почек, нервной системы). |
|
|
|
|||
Легочные (респираторные симптомы): одышка, кашель, выделение мокроты (слизистая, слизисто-гнойная), ржавая), боли при дыхании, локальные клинические признаки
(притупление перкуторного звука, бронхиальное дыхание, крепитация, шум трения плевры), локальные рентгенологические признаки (сегментарные и долевые затемнения).
• Внелегочные (общие) проявления: лихорадка, ознобы и потливость, миалгии, головная боль, цианоз, тахикардия, герпес лабиалис, кожная сыпь, поражение слизистых (конъюнктивит), спутанность сознания, диарея, желтуха, изменения со стороны периферической крови (лейкоцитоз, сдвиг формулы влево, токсическая зернистость нейтрофилов, повышение СОЭ).
Физическое обследование:
У всех больных ВП рекомендуется провести общий осмотр, измерить показатели жизнедеятельности (ЧДД, ЧСС, АД, температура тела) и выполнить детальное обследование грудной клетки. Данные, получаемые при физическом обследовании, зависят от многих факторов, включая распространенность и локализацию пневмонической инфильтрации, степень тяжести ВП, возраст пациента, наличие сопутствующих заболеваний. Классическими объективными признаками являются отставание пораженной стороны грудной клетки при дыхании, усиление голосового дрожания, укорочение (притупление) перкуторного звука над пораженным участком легкого, появление бронхиального дыхания, наличие фокуса мелкопузырчатых хрипов или крепитации, усиление бронхофонии.
Лабораторная диагностика:
Всем больным ВП рекомендуется развернутый общий анализ крови с определением уровня эритроцитов, гематокрита, лейкоцитов, тромбоцитов, лейкоцитарной формулы. Данные общего анализа крови не являются специфичными и не позволяют высказаться о
потенциальном возбудителе ВП. Однако лейкоцитоз >10-12 109 /л с повышением уровня нейтрофилов и/или палочкоядерный сдвиг >10%, нейтрофильнолимфоцитарное соотношение > 20, указывают на высокую вероятность бактериальной инфекции;
лейкопения <4*109/л, тромбоцитопения <100*1012/л и гематокрит <30% являются неблагоприятными прогностическими признаками при ВП.
Исследование уровня С-реактивного белка (СРБ) в сыворотке крови. Уровень СРБ коррелирует с тяжестью течения, распространенностью воспалительной инфильтрации и прогнозом при ВП. Отсутствие значимого снижения уровня СРБ на фоне АБТ у госпитализированных пациентов с ВП является предиктором более высокой летальности.
Исследование плевральной жидкости (определение рН, активности ЛДГ, содержания белка, цитологическое исследование).
Исследование газов артериальной крови с определением PaO2, PaCO2, pH, бикарбонатов, лактата.
Коагулограмма с определением протромбинового времени, МНО, АЧТВ. Микробиологическая диагностика при ВП включает культуральное исследование мокроты и других респираторных образцов – трахеальный аспират (ТА), бронхоальвеолярный лаваж (БАЛ) и др., венозной крови, экспресс-тесты по выявлению пневмококковой и легионеллезной антигенурии, ПЦР-диагностику для выявления некультивируемых/трудно культивируемых бактериальных возбудителей и респираторных вирусов, иммуносерологические исследования.
Бактериологическое исследование мокроты (или бронхиальных смывов) до назначения антибиотиков помогает обнаружить возбудитель и определить его чувствительность к антибиотикам.
Инструментальная диагностика
Обзорная рентгенография органов грудной полости (ОГП) в передней прямой и боковой проекциях (при неизвестной локализации воспалительного процесса целесообразно выполнять снимок в правой боковой проекции);
Основной рентгенологический признак ВП - локальное снижение воздушности легочной ткани (инфильтрация) за счет накопления воспалительного экссудата в респираторных отделах [76]. Изменения чаще носят односторонний характер, распрост-раняются на один или два бронхолегочных сегмента. Рентгенологическая картина ВП определяется типом инфильтрации легочной ткани и стадией воспалительного процесса.
Альвеолярный тип инфильтрации (консолидация) при пневмонии наблюдается при заполнении воспалительным экссудатом воздухосодержащих альвеол, альвеолярных мешков, альвеолярных ходов и респираторных бронхиол [76]. В результате часть легочной ткани становится безвоздушной. Отличительной особенностью является средняя интенсивность тени уплотненного участка легкого, тканевая плотность при КТ, а также видимость в зоне уплотнения воздушных просветов бронхов (симптом воздушной бронхографии). Такой тип изменений определяется как плевропневмония. Плевро-пневмония чаще встречается при инфицировании бактериальными возбудителями, особенно пневмококком. Интерстициальный тип инфильтрации (матовое стекло) наблюдается при заполнении воспалительным экссудатом межальвеолярных пространств. При рентгеноло-гическом исследовании характеризуется низкой (малой) интенсивностью тени уплотненного участка [76]. Более достоверно симптом матового стекла определяется при высокоразрешающей КТ легких – видимость стенок бронхов и элементов сосудистого рисунка в зоне инфильтрации. Такие пневмонические инфильтраты обычно определяются как интерстициальные. Обычно они не имеют отчетливой симптоматики при физическом обследовании и могут быть не видны при рентгенографии. Чаще интерстициальные пневмонические инфильтраты возникают при небактериальных пневмониях.
Очаговый тип инфильтрации отличается неоднородной структурой, состоящей из многочисленных полиморфных, центрилобулярных очагов с нечеткими контурами, часто сливающихся друг с другом [76]. В основе данного типа инфильтрации лежит переход воспалительного процесса из мелких внутридольковых бронхов в окружающую их легочную ткань. Такие изменения определяются как бронхопневмония. Двухсторонние диффузные изменения могут возникать при небактериальной инфекции нижних дыхательных путей
Пульсоксиметрия с измерением SpO2 для выявления ДН и оценки выраженности гипоксемии; Пульсоксиметрия является простым и надежным скрининговым методом, позволяющим выявлять пациентов с гипоксемией, нуждающихся в респираторной поддержке и оценивать ее эффективность
ЭКГ в стандартных отведениях. Данное исследование не несет в себе какой-либо специфической информации при ВП. Однако, в настоящее время известно, что ВП помимо декомпенсации хронических сопутствующих заболеваний увеличивает риск развития нарушений ритма и острого коронарного синдрома (ОКС), своевременное выявление которых значимо влияет на прогноз [80]. Кроме того, определенные изменения на ЭКГ (например, удлинение интервала QT) повышает кардиотоксичность ряда АМП.
Всем пациентом с ВП в случае подозрения на наличие парапневмонического экссудативного плеврита рекомендуется трансторакальное ультразвуковое исследование грудной полости. Плевральный выпот (как правило, ограниченного характера) осложняет течение ВП в 10-25% случаев [1,2]. УЗИ позволяет с высокой чувствительностью и специфичностью определять наличие плеврального выпота, оценивать его характеристики (вероятный транссудат или экссудат), выявлять
пациентов с подозрением на наличие эмпиемы плевры.
КТ органов грудной полости не является обязательным методом исследования при ВП и выполняется только при наличии определенных показаний:
1.Отсутствие изменений в легких на рентгеновских снимках у пациента с вероятным диагнозом пневмонии.
2.Нетипичные для ВП изменения на рентгенограммах.
3.Рецидивирующая пневмония или затяжная пневмония, при которой длительность существования инфильтративных изменений в легочной ткани превышает один месяц
Бронхография позволяет выявить полости распада в легочной ткани, а также наличие бронхоэктазов, вокруг которых при обострении возможны инфильтративные изменения (так называемая перифокальная пневмония). Дифференциальную диагностику проводят с туберкулезом и раком легкого по результатам бронхоскопии, а при необходимости и плевро-скопии.
В диагностике инфарктной пневмонии определенную роль играет ра-дионуклидное
исследование легочного кровотока, выявляющее его нарушения.
Особенно важно исследование бронхиального смыва в диагностике П пневмоцистной этиологии.
Не всегда выявленный микроорганизм является возбудителем пневмонии. Уточненный этиологический диагноз может быть поставлен с помощью иммунологических исследований, реакции связывания комплемента (РСК) и реакции торможения гемагглютинации (РТГА) с вирусными и бактериальными антигенами.
В диагностике вирусных и вирусно-бактериальных пневмоний имеют значение
вирусологические и серологические исследования (результаты культурального исследования мокроты, включая биологическую пробу на мышах, метод культивирования вирусов в развивающемся курином эмбрионе, метод иммунофлюоресценции, серологический метод с использованием парных сывороток против вирусов и Mycoplasma pneumoniae, причем придают значение лишь 4-кратному нарастанию титра антител).
Все эти сложные иммунологические, вирусологические и серологические методы обязательно применяют при обследовании больных, не поддающихся общепринятой терапии, в случае атипичного течения пневмонии или развития тяжелых осложнений.
Исследование мокроты помогает уточнить природу пневмонии. Большое число эозинофилов свидетельствует об аллергических процессах, наличие атипических клеток — о пневмонии ракового генеза; микобактерии туберкулеза обнаруживают при туберкулезе; эластические волокна являются свидетельством распада легочной ткани (рак, туберкулез, абсцесс). При микозных пневмониях наряду с обнаружением грибов отмечается отсутствие гноеродной флоры вследствие угнетающего действия продуктов жизнедеятельности грибов.
По данным бактериоскопии (микроскопия мазков мокроты, окрашенных по Граму) можно говорить о грамотрицательных или грамположи-тельных микроорганизмах, обитающих в бронхах уже в первые сутки пребывания больного в стационаре (важно учитывать при выборе антибиотиков).
Об остроте воспалительного процесса можно судить по выраженности острофазовых показателей крови и их динамике (лейкоцитоз со сдвигом лейкоцитарной формулы, увеличение СОЭ, повышенное содержание ссг-глобулинов, фибриногена, появление СРБ, повышение уровня сиаловых кислот). Для бактериальных пневмоний более характерен нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы влево; СОЭ увеличена, степень этого увеличения определяется распространенностью и тяжестью процесса. Вирусные пневмонии отличает лейкопения. При микоплазменных и орнитозных пневмониях лейкопения сочетается с очень высокой СОЭ. Как правило, отмечается тенденция к лейкопении при парагриппозных и аденовирусных пневмониях, но СОЭ в этих случаях нормальная.
При затяжном течении пневмонии и развитии осложнений необходимо изучение иммунологической реактивности организма. Снижение показателей гуморального (IgM) и
клеточного (задержка миграции лейкоцитов, изменение тестов, характеризующих систему Т-лимфоцитов) иммунитета требует проведения иммуномодулирующей терапии.
Лабораторные и инструментальные методы имеют дополнительное значение в уточнении степени вовлечения в процесс других органов и систем и развития осложнений:
1) ЭКГ позволяет оценить состояние миокарда; иногда возникает не
обходимость использовать с этой целью и эхокардиографию; 2) эхокардиография помогает обнаружить выпот в перикарде или
бактериальные колонии на клапанах сердца при осложнении инфекцион ным эндокардитом;
3) показатели функции внешнего дыхания позволяют оценить состоя ние бронхиальной проходимости.
4. Атипичные пневмонии (хламидийная, легионеллезная, микоплазменная): особенности диагностики и
лечения.
АТИПИЧНАЯ ПНЕВМОНИЯ – не имеет строго определенного клинического состояния, ввиду широкой популярности термина “атипичные возбудители” сохранен для обозначения соответствующих внутриклеточных микроорганизмов (микоплазмы, хламидии, легионелла) – в настоящее время отдельно не рассматривается
Хламидийная пневмония Каждый из трех известных в настоящее время видов хламидий способен
вызывать воспаление легких: Chlamydia trachomatis – отдельные случаи пневмонии у новорожденных; Chlаmydophila psittaci – поражение легких при пситтакозе (орнитозе); Chlamydophila pneumoniae – весьма распространенный возбудитель пневмонии и острого бронхита у взрослых и детей. СобственноC.pneumoniae, как уже говорилось выше, и рассматривается как один из актуальных возбудителей атипичной пневмонии. Этиологический вклад Chlamydia pneumoniae в развитие внебольничной пневмонии, преимущественно у лиц молодого возраста, составляет 3–10%.
При рентгенографии органов грудной клетки чаще визуализируется мелкоочаговая (размером 2–3 см), нередко многофокусная инфильтрация. Лобарная инфильтрация, образование полостей в легких и плевральный выпот нетипичны для хламидийной пневмонии. Количество лейкоцитов и лейкоцитарная формула в периферической крови обычно нормальные.
Хламидийная пневмония характеризуется, как правило, нетяжелым, но нередко затяжным течением.
настоящее время «золотым стандартом» серологической диагностики этой инфекции является тест микроиммунофлюоресценции (МИФ). МИФ продемонстрировала высокую чувствительность и специфичность в сравнении с референс–методом диагностики (выделение культуры возбудителя). Этот метод позволяет идентифицировать специфические иммуноглобулины G, А и М.
Обычно вначале проводят определение IgG, предваряя этим тестом определение IgM. Таким образом, исключается ложноположительное определение IgM в случаях наличия ревматоидного фактора, особенно у пожилых пациентов. Свидетельствами активной хламидийной инфекции являются четырехкратное нарастание титров IgG или IgA в парных сыворотках крови, взятых с 2–4–недельным интервалом в остром периоде заболевания и в периоде реконвалесценции, или однократно определяемый высокий титр антихламидийных антител (например, IgG>=1:512).
Легионеллезная пневмония («болезнь легионеров») вызывается грамотрицательной палочкойLegionella pneumophila. Спорадическая заболеваемость колеблется от 1,5% до 10% среди всех этиологически верифицированных пневмоний. Эпидемическая заболеваемость связывается с контаминацией возбудителем водных систем и чаще наблюдается в больших зданиях (гостиницы, больницы). Важно отметить, что легионеллезная пневмония наиболее актуальна для лиц среднего и пожилого возраста и практически не встречается у детей.
Клинический дебют болезни характеризуется появлением в первые дни немотивированной общей слабости, анорексии, заторможенности, упорных головных болей. Симптомы поражения верхних дыхательных путей, как правило, отсутствуют. После непродолжительного продромального периода появляются кашель, обычно непродуктивный, фебрильная лихорадка и одышка. Кровохарканье и плеврогенные боли в груди наблюдаются с одинаковой частотой – у каждого третьего больного. В первых публикациях, посвященных «болезни легионеров» (как правило, при описании эпидемических вспышек), в качестве нередкого дебютного признака болезни упоминалась диарея. В настоящее время, однако, этот признак, скорее, относят к категории экзотических, особенно при спорадической заболеваемости. Нередко весьма демонстративны неврологические расстройства – заторможенность, дезориентация, галлюцинации, периферическая нейропатия.
Физическая симптоматика легионеллезной пневмонии, как правило, убедительна: локальная крепитация, признаки консолидации легочной ткани (бронхиальное дыхание, укорочение перкуторного звука). Рентгенологические данные неспецифичны – визуализируется очаговая пневмоническая инфильтрация, локализующаяся обычно в пределах одной доли легких. Нередко одновременно обнаруживается и ограниченный плевральный выпот и, напротив, нечасто, обычно на поздних стадиях болезни, формируются полостные образования в легких. Процесс нормализации рентгеновской картины занимает обычно длительное время, иногда несколько месяцев.
Данные лабораторных исследований, хотя и несут неспецифическую информацию, но, указывая на полисистемность поражения, могут быть использованы, как определенный диагностический критерий. Так, в анализах мочи определяется гематурия и протеинурия; в крови часто выявляются повышенная активность щелочной фосфатазы, креатинфосфокиназы, аминотрансфераз, гипербилирубинемия. В клинической гемограмме обнаруживаются лейкоцитоз с нейтрофилезом и абсолютная лимфопения, значительное увеличение СОЭ. Тест прямой иммунофлюоресценции наиболее популярен в клинической практике. Он очень
быстр в выполнении, но его чувствительность вариабельна и относительно невысока (18–75%). Чувствительность прямой иммунофлюоресценции возрастает до 80%, если этот метод подкрепляется культуральным или если респираторные секреты (трахеальный аспират или жидкость бронхоальвеолярного лаважа) предварительно обработаны. Специфичность теста может достигать 94%. Спустя 4–6 дней после начала адекватной антибактериальной терапии определение антигена становится невозможным. Антиген L.pneumophila может быть также обнаружен в моче радиоиммунологически, с использованием ИФА или в реакции латексной агглютинации. Однако следует иметь в виду, что легионеллезный антиген может
персистировать в течение многих месяцев после выздоровления, а ИФА пригоден только для идентификации L.pneumophila, 1–й серогруппы.
Наиболее популярная сегодня диагностика легионеллеза предполагает идентификацию специфических антител – непрямая иммунофлюоресценция, ИФА и микроагглютинация. В типичных случаях сероконверсия (четырехкратное нарастание титра специфических антител) наблюдается через 4–8 недель, однако у лиц старших возрастных групп этот временной интервал может достигать 14 недель. Следует также учитывать тот факт, что 20–30% пациентов, переносящих острую легионеллезную инфекцию, не демонстрируют нарастания титра антител. ИФА характеризуется высокой специфичностью (95%) и приемлемой чувствительностью (85%) при определении специфических IgG и IgM. Описываются отдельные наблюдения перекрестных реакций с Pseudomonas aeruginosa,
Chlamydia/Chlamydophila spp., Mycoplasma pneumoniae и Campylobacter spp.
Микоплазменная пневмония
Воспаление легких, вызываемое M.pneumoniae, наиболее часто диагностируется у детей и лиц молодого возраста, достигая среди указанных контингентов 20–30% от числа всех этиологически верифицированных внебольничных пневмоний. Напротив, в старших возрастных группах микоплазменная пневмония диагностируется, как исключение (1–3%). Наряду со спорадическими случаями наблюдаются и групповые (эпидемические) вспышки заболевания – в основном в организованных коллективах (школьники, военнослужащие).
Микоплазменная пневмония, как правило, сопровождается ознобом, мышечными и головными болями, симптомами инфекции верхних дыхательных путей. Напротив, кровохарканье и боли в груди весьма нетипичны.
При стетоакустическом обследовании удается получить зачастую весьма скудную информацию: локально выслушиваются мелкопузырчатые хрипы или незвучная инспираторная крепитация при отсутствии укорочения (притупления) перкуторного звука. Нередко определяются шейная лимфаденопатия, полиморфные кожные сыпи, гепатоспленомегалия.
При рентгенографии органов грудной клетки обнаруживается неоднородная инфильтрация легочной ткани, локализующаяся преимущественно в нижних долях легких, причем в 10–40% случаев процесс имеет двусторонний характер. Массивная очагово–сливная инфильтрация, полостные образования, плевральный выпот для микоплазменной пневмонии не характерны. Нередко даже в случаях своевременно назначенной адекватной антибактериальной терапии пневмоническая инфильтрация разрешается спустя многие недели, существенно отставая от клинического выздоровления.
Известно, что M.pneumoniae инициирует выраженную поликлональную пролиферацию лимфоцитов. Именно этим обстоятельством можно объяснить многообразие внелегочных
иммунологически опосредованных проявлений заболевания – кожных, суставных, гематологических, гастроинтестинальных, неврологических и др. В свое время особое внимание в диагностике микоплазменной инфекции уделялось феномену высокого титра холодовых гемагглютининов с субклиническим гемолизом (положительная проба Кумбса, ретикулоцитоз). Однако, как было установлено в последующем, данная лабораторная находка не является специфичной для микоплазмоза и с разной частотой обнаруживается при цитомегаловирусной инфекции, легионеллезе, эпидемическом паротите и особенно при
инфекционном мононуклеозе.
Определение антигена микоплазмы может быть достигнуто несколькими методами. Использование поликлональной антисыворотки характеризуется очень малой специфичностью, поскольку значительное число индивидов являются здоровыми носителями инфекции. Обнаружение антигена в мокроте с использованием реакции иммуноферментного анализа (ИФА) демонстрирует вариабельную чувствительность (40–81%) и специфичность (64–100%), если при этом в качестве референс–метода рассматривается выделение культуры возбудителя. Имеющиеся в арсенале современных лабораторий коммерческие ДНК–РНК– пробы, дающие возможность идентифицировать M.pneumoniae в мазках из зева, характеризуются высокой специфичностью, но низкой чувствительностью. В настоящее время все большее внимание привлекает технология полимеразной цепной реакции (ПЦР), однако для дифференциации активной и персистирующей инфекции необходимо проведение серологических тестов.
Тест холодовой агглютинации ввиду его низкой чувствительности и специфичности в настоящее время в клинической практике не используется. Реакция связывания комплемента демонстрирует вариабельную чувствительность (50–90%) и субоптимальную специфичность. Наиболее приемлемым стандартом серологической диагностики микоплазменной инфекции сегодня является ИФА с обнаружением специфических IgG и IgM. ИФА демонстрирует высокую чувствительность и специфичность – 92% и 95% соответственно. Время сероконверсии, т.е. четырехкратного возрастания титра антимикоплазменных антител при последовательном исследовании проб крови, взятых в остром периоде заболевания и в
периоде реконвалесценции, обычно составляет 3–8 недель.
Лечение атипичной пневмонии
При нетяжелом течении атипичной пневмонии (вероятнее всего, микоплазменной или хламидийной этиологии) макролиды следует назначать внутрь в среднетерапевтических дозах – эритромицин по 250–500 мг каждые 6 часов; кларитромицин по 250 мг каждые 12 часов; азитромицин по 500 мг 1 раз в день в течение 3–х дней или по 250 мг 2 раза в день в 1– й день и по 250 мг 1 раз в день со 2–го по 5–й дни.
При тяжелом течении атипичной пневмонии (как правило, легионеллезной этиологии) макролиды вначале назначаются внутривенно в высоких дозах (эритромицин до 4,0 г в сутки), а затем переходят на оральный прием антибиотика. Весьма популярна комбинированная терапия легионеллезной пневмонии эритромицином и рифампицином, хотя роль последнего в данном случае окончательно не установлена. Эффективны при лечении «болезни легионеров» и другие макролиды, в т.ч. имеющие лекарственные формы для парентерального введения – спирамицин, кларитромицин и др.
В последние годы была показана и высокая клиническая эффективность новых фторхинолонов в лечении легионеллезной пневмонии (левофлоксацин, 500 мг один раз в
сутки в течение 10–14 дней)
Продолжительность антибактериальной терапии атипичной пневмонии составляет не менее 2–3–х недель; минимизация сроков лечения несет в себе реальный риск рецидива инфекции. При этом следует еще раз напомнить, что зачастую клиническое выздоровление при микоплазменной, хламидийной или легионеллезной инфекциях нижних дыхательных путей существенно опережает более позднее рентгенологическое, которое порой затягивается на многие недели или даже месяцы.
5.Современные принципы лечения внебольничных пневмоний.
Алгоритм лечения больного с учетом тяжести заболевания
Пневмония легкого течения Лечение в амбулаторных условиях АБ терапия внутрь
Для пациентов до 50 лет без сопутствующих заболеваний монотерапия амоксициллином или современными макролидами:
1. Аминопенициллины:
Амоксициллин (флемоксин) (табл. 0,125; 0,25 и 0,5 г) внутрь по 0,5 г 3 р/сут. в теч. 7- 10 суток и/или 2. Макролиды:
Азитромицин и его аналоги (Сумамед табл. 500 мг; Азитрокс капс. 250 мг; Хемомицин капс. 250 мг) внутрь по 500 мг 1 р/сут. в теч. 3-х суток;
Кларитромицин (клацид) (табл. 0,25 и 0,5 г) внутрь по 500 мг 2 р/сут. в
теч. 7-14 сут.;
Мидекамицин (макропен) (табл. 0,4 г) внутрь по 400 мг 3 р/сут. в теч. 7- 14 сут.
Пациентам, имеющим факторы риска следует назначать комбинированную терапию βлактам + современный макролид, либо монотерапию респираторными фторхинолонами III-IV поколения: 1. Ингибиторзащищенные пенициллины: Амоксициллин/клавуланат
(амоксиклав) (табл. 375 и 625 мг) внутрь по 625 мг 3 р/сут. в теч. 7-10 суток и/или 2. Макролиды:
Азитромицин и его аналоги (Сумамед табл. 500 мг; Азитрокс капс. 250 мг; Хемомицин капс. 250 мг) внутрь по 500 мг 1 р/сут. в теч. 3-х суток или кларитромицин (см. выше) или 3. Респираторные фторхинолоны:
Спарфлоксацин (спарфло) (табл. 0,2 г) внутрь по 400 мг однократно в 1- й день, затем по 200 мг; Левофлоксацин (таваник) (табл. 0,25 и 0,5 г) внутрь по 500 мг табл. 1 р/сут.
Пневмония среднетяжелого и тяжелого течения Лечение в стационаре Парентеральная АБ терапия в течение 2-3 сут. (1-й этап) Переход на прием антибиотиков внутрь (2-й этап)
Для пациентов до 50 лет без сопутствующих заболеваний: 1. Аминопенициллины в теч. 2-3 суток:
Ампициллин (пор. д/приг. р-ра д/ин.; фл. 0,25; 1 и 2 г): в/в по 1-2 г 4 р/сут. или
2. Цефалоспорины III поколения в теч. 2-3 суток:
Цефотаксим (клафоран) (пор. д/приг. р-ра д/ин.; фл. 1 г) в/в по 1,0-2,0 г с интервалом 8 часов; Цефтриаксон (роцефин) (пор. д/приг. р-ра д/ин.; фл. 0,25; 0,5; 1 г) в/в по 1,0-2,0 г однократно в сут.
3. Амоксициллин (флемоксин) (табл. 0,125; 0,25 и 0,5 г) внутрь по 0,5 г 3 р/сут. в теч. 7- 10 суток или 4. С 1-го дня лечения сочетание 1, 2, а затем 3 с макролидами внутрь.
Для пациентов старше 60 лет или на фоне ХОБЛ: |
|
|
||||||
1. Ингибиторзащищенные пенициллины: |
|
|
||||||
Амоксициллин/клавуланат (амоксиклав) (пор. д/приг. р-ра д/ин.; фл. 0,6 |
||||||||
и 1,2 г) в/в по 1,2 г 3 р/сут в течение 3-х суток |
|
|
||||||
Амоксициллин/клавуланат (табл. 375 и 625 мг) внутрь по 625 мг 3 р/сут |
||||||||
в сочетании с макролидами (Эритромицин, Азитромицин, |
|
|||||||
Кларитромицин) в теч. 7-10 суток или |
|
|
|
|||||
2. Цефалоспорины III поколения: |
|
|
|
|||||
Цефотаксим (клафоран) (пор. д/приг. р-ра д/ин.; фл. 1 г) в/в по 1,0-2,0 г |
||||||||
3 р/сут; |
|
|
|
|
|
|
||
Цефтриаксон (роцефин) (пор. д/приг. р-ра д/ин.; фл. 0,25; 0,5; 1 г) в/в по |
||||||||
2,0 г 1 р/сут в течение 3-х суток в сочетании с макролидами |
|
|||||||
(Эритромицин, Азитромицин, Кларитромицин) |
|
|
||||||
Амоксициллин/клавуланат (табл. 375 и 625 мг) внутрь по 625 мг 3 р/сут |
||||||||
в теч. 7-10 суток или |
|
|
|
|
|
|||
3. Респираторные фторхинолоны: |
|
|
|
|||||
Левофлоксацин (таваник) (р-р д/инф.; флак. 0,5 г/100 мл) в/в по 500 мг 1 |
||||||||
р/сут в течение 2-3-х суток |
|
|
|
|
||||
Левофлоксацин (табл. 0,25 и 0,5 г) внутрь по 500 мг 1 р/сут; |
|
|||||||
Спарфлоксацин (спарфло) (табл. 0,2 г) внутрь по 400 мг однократно в 1- |
||||||||
й день, затем по 200 мг в течение 7-10 суток. |
|
|
||||||
Длительность АБ-терапии неосложненной пневмонии 7-10 дней. При |
||||||||
пневмонии, вызванной Mycoplasma, Legionella, а также в случае |
|
|||||||
осложнений (абсцесс и пр.) продолжительность лечения может |
|
|||||||
достигать 21 дняI. Лечебный режим и рациональное питание. |
|
|||||||
II. Лекарственную терапию: |
1) этиотропную, |
2) патогенетическую, 3) |
|
|||||
симптоматическую. |
|
|
|
|
|
|
||
III. |
Физиотерапевтическое воздействие. |
|
|
|
||||
IV. Диспансерное наблюдение. |
|
|
|
|
|
|||
• |
|
П а т о г е н е т и ч е с к а я |
т е р а п и я . При |
тяжелых и |
затяжных |
|||
пневмониях |
используют |
препараты |
иммуномодулирующего |
дейст |
||||
вия |
(интерферон, |
левамизол, |
зимозан, |
диуцифон, |
Т-активин, |
тима- |
||
лин). |
|
|
|
|
|
|
|
|
Больным вирусной пневмонией показаны введение противогриппозного у-глобулина, противовирусных препаратов (рибоварин, интерферон), ингаляции фитонцидов [сок чеснока и(или) лука, приготовленные ex tem-рогае, в изотоническом растворе хлорида натрия].
При стафилококковой пневмонии проводят пассивную иммунизацию гипериммунной антистафилококковой плазмой или стафилококковым антитоксином.
Для восстановления неспецифической резистентности организма назначают витамины А, С, Е, группы В, используют биогенные стимуляторы и адаптогенные средства (алоэ, настойки женьшеня и лимонника, жидкий экстракт элеутерококка).
Для восстановления бронхиальной проходимости применяют бронхо-литические средства (эуфиллин, теопэк и пр.) и средства, разжижающие бронхиальный секрет (внутрь мукалтин, ацетилцистеин, бромгексин, горячее щелочное питье). Если наблюдается надсадный кашель как проявление бронхоспазма, сопутствующего П, назначают адреномиметические средства: фенотерол (беротек), сальбутамол.
При затяжном течении пневмонии иногда решающую роль играет восстановление бронхиального дренажа с помощью бронхоскопической санации.
•С и м п т о м а т и ч е с к а я т е р а п и я . При непродуктивном сухом кашле назначают противокашлевые средства (кодеин, либексин, тусупрекс, глауцина гидрохлорид и пр.); при затрудненном отхождении мокроты — отхаркивающие (настой травы термопсиса, корень алтея и пр.). В случае плохой переносимости высокой тем-
пературы тела показаны жаропонижающие средства (анальгин, ацетилсалициловая кислота). Больным с сопутствующей патологией сердечно-сосудистой системы, особенно пожилым, а также при тяжелом течении пневмонии назначают инъекции камфоры, сульфо-камфокаина, кордиамина, при недостаточности кровообращения — сердечные гликозиды.
Наличие одышки и цианоза служит показанием к проведению кислородной терапии. При выраженной интоксикации и деструкции легочного инфильтрата проводят дезинтоксикационную терапию (внутривенное введение реополиглюкина, гемодеза и других растворов).
Больным с тяжелой формой пневмонии, с выраженной интоксикацией, инфекционнотоксическим шоком показано внутривенное введение кортикостероидов. Небольшие дозы кортикостероидов (1 0 — 15 мг в день) внутрь назначают при вялом рассасывании инфильтрата или сопутствующем аллергическом бронхоспазме.
III. Физиотерапевтическое воздействие. При лечении больных П используют отвлекающие процедуры: банки, горчичники, горчичные обер тывания, которые при невысокой температуре тела принимают с первых дней болезни. После снижения температуры тела для ликвидации воспа лительных изменений назначают диатермию, индуктотермию, СВЧ, УВЧ и т.д. Рассасыванию очага пневмонии способствуют массаж грудной клет ки и ЛФК.
Аэрозольтерапия с использованием бронхолитических смесей отдельно или в комбинации с различными антибактериальными препаратами применяется в стадии разрешения.
6.Современные принципы лечения внутрибольничных пневмоний.
I. Лечебный режим и рациональное питание.
II. Лекарственную терапию: 1) этиотропную, 2) патогенетическую, 3) симптоматическую.
V. Физиотерапевтическое воздействие. VI. Диспансерное наблюдение.
Дозы антимикробных препаратов для внутривенного введения для лечения НП у взрослых пациентов с нормальной функцией почек
и печени Цефалоспорины без антисинегнойной активности Цефотаксим 2 г 3–4 раза в сутки Цефтриаксон 2 г 1–2 раза в сутки Цефтаролин 0,6 г 2 раза в сутки
Цефалоспорины с антисинегнойной активностью Цефтазидим 2 г 3 раза в сутки Цефепим 2 г 2–3 раза в сутки
Карбапенемы Меропенем 1–2 г 3–4 раза в сутки (3-часовая инфузия)
Имипенем 1 г 3–4 раза в сутки Дорипенем 0,5–1 г 3 раза в сутки (4-часовая инфузия) Эртапенем 1 г 1 раз в сутки
Ингибиторозащищенные бета-лактамы Ампициллин/сульбактам 3 г 3–4 раза в сутки Амоксициллин/клавуланат 1,2 г 3–4 раза в сутки Амоксициллин/сульбактам 3 г 3–4 раза в сутки Пиперациллин/тазобактам 4,5 г 3–4 раза в сутки Цефоперазон/сульбактам 4 г 2 раза в сутки
Аминогликозиды Амикацин 15–20 мг/кг 1 раз в сутки
Гентамицин 5–7 мг/кг 1 раз в сутки Тобрамицин 3–5 мг/кг 1 раз в сутки
Фторхинолоны без антисинегнойной активности Моксифлоксацин 400 мг 1 раз в сутки
Фторхинолоны с антисинегнойной активностью Ципрофлоксацин 600 мг 2 раза в сутки или 400 мг 3 раза в сутки Левофлоксацин 500 мг 1–2 раза в сутки
Полимиксины Полимиксин В 1–1,25 мг/кг 2 раза в сутки или 10000– 12500 МЕ/кг 2 раза в сутки
Глицилциклины Тигециклин 50 мг 2 раза в сутки (первая доза 100 мг)
Оксазолидиноны Линезолид 600 мг 2 раза в сутки
Гликопептиды и липогликопептиды Ванкомицин 15–20 мг/кг 2 раза в сутки Телаванцин 10 мг/кг 1 раз в сутки
Другие антибактериалные препараты Фосфомицин 3–4 г 2–3 раза в сутки
Ко-тримоксазол 15 мг/кг в сутки по триметроприму в 2–3 введения
Противогрибковые препараты Вориконазол Начинают с в/в введения по 6 мг/кг 2 раза в 1-е сутки,
затем по 4 мг/кг 2 раза в сутки. После стабилизации состояния пациента возможен переход на пероральный прием. Внутрь — насыщающая доза: у пациентов с массой тела ниже 40 кг 0,2 г 2 раза в сутки, а при массе больше 40 г — 0,4 г 2 раза в сутки; поддерживающая доза у пациентов с массой тела меньше 40 кг — 0,1 г 2 раза в сутки, а при массе больше 40
г — 0,2 г 2 раза в сутки Каспофунгин В первые сутки — 70 мг, затем по 50 мг 1 раз в сутки
Анидулафунгин В первые сутки 200 мг, затем по 100 мг 1 раз в сутки Микафунгин 150 мг 1 раз в сутки Амфотерицин В:
-обычный 0,3–1,5 мг/кг/сут
-липидные формы 1–5 мг/кг/сут
•П а т о г е н е т и ч е с к а я т е р а п и я . При тяжелых и затяжных пневмониях используют препараты иммуномодулирующего дейст вия (интерферон, левамизол, зимозан, диуцифон, Т-активин, тималин).
Больным вирусной пневмонией показаны введение противогриппозного у-глобулина, противовирусных препаратов (рибоварин, интерферон), ингаляции фитонцидов [сок чеснока и(или) лука, приготовленные ex tem-рогае, в изотоническом растворе хлорида натрия].
При стафилококковой пневмонии проводят пассивную иммунизацию гипериммунной антистафилококковой плазмой или стафилококковым антитоксином.
Для восстановления неспецифической резистентности организма назначают витамины А, С, Е, группы В, используют биогенные стимуляторы и адаптогенные средства (алоэ, настойки женьшеня и лимонника, жидкий экстракт элеутерококка).
Для восстановления бронхиальной проходимости применяют бронхо-литические средства (эуфиллин, теопэк и пр.) и средства, разжижающие бронхиальный секрет (внутрь мукалтин, ацетилцистеин, бромгексин, горячее щелочное питье). Если наблюдается надсадный кашель как проявление бронхоспазма, сопутствующего П, назначают адреномиметические средства: фенотерол (беротек), сальбутамол.
При затяжном течении пневмонии иногда решающую роль играет восстановление бронхиального дренажа с помощью бронхоскопической санации.
•С и м п т о м а т и ч е с к а я т е р а п и я . При непродуктивном сухом кашле назначают противокашлевые средства (кодеин, либексин, тусупрекс, глауцина гидрохлорид и пр.); при затрудненном отхождении мокроты — отхаркивающие (настой травы термопсиса, корень алтея и пр.). В случае плохой переносимости высокой тем-
пературы тела показаны жаропонижающие средства (анальгин, ацетилсалициловая кислота). Больным с сопутствующей патологией сердечно-сосудистой системы, особенно пожилым, а также при тяжелом течении пневмонии назначают инъекции камфоры, сульфо-камфокаина, кордиамина, при недостаточности кровообращения — сердечные гликозиды.
Наличие одышки и цианоза служит показанием к проведению кислородной терапии. При выраженной интоксикации и деструкции легочного инфильтрата проводят дезинтоксикационную терапию (внутривенное введение реополиглюкина, гемодеза и других растворов).
Больным с тяжелой формой пневмонии, с выраженной интоксикацией, инфекционнотоксическим шоком показано внутривенное введение кортикостероидов. Небольшие дозы кортикостероидов (1 0 — 15 мг в день) внутрь назначают при вялом рассасывании инфильтрата или сопутствующем аллергическом бронхоспазме.
III. Физиотерапевтическое воздействие. При лечении больных П используют отвлекающие процедуры: банки, горчичники, горчичные обер тывания, которые при невысокой температуре тела принимают с первых дней болезни. После снижения температуры тела для ликвидации воспа лительных изменений назначают диатермию, индуктотермию, СВЧ, УВЧ и т.д. Рассасыванию очага пневмонии способствуют массаж грудной клет ки и ЛФК.

Аэрозольтерапия с использованием бронхолитических смесей отдельно или в комбинации с различными антибактериальными препаратами применяется в стадии разрешения.
7.Современные принципы лечения пневмоний у пожилых лиц и при иммунодефицитных состояниях.
I.Лечебный режим и рациональное питание.
II.Лекарственную терапию: 1) этиотропную, 2) патогенетическую, 3) симптоматическую.
VII. Физиотерапевтическое воздействие. VIII.Диспансерное наблюдение.
IX. Антибактериальная терапия пневмонии у лиц пожилого и старческого возраста
|
|
|
|
Группа |
Препараты |
|
|
|
|
|
|
|
выбора |
альтернативные |
|
|
|
|
|
Нетяжёлая |
Амоксициллин внутрь |
Респираторные |
|
пневмония у |
или макролиды внутрь. |
фторхинолоны |
|
пациентов в |
Макролиды являются |
(левофлоксацин, |
|
возрасте до 60 лет |
препаратами выбора |
моксифлоксацин, |
|
без сопутствующих |
при подозрении на |
гемифлоксацин) |
|
заболеваний |
атипичную этиологию |
внугр |
|
|
пневмонии. |
|
|
|
|
|
|
Нетяжёлая |
Амоксициллин/ |
Респираторные |
|
пневмония у |
клавуланат внутрь |
фторхинолоны |
|
пациентов в |
|
(левофлоксацин, |
|
возрасте 60 лет и |
|
моксифлок - сацин, |
|
старше с |
|
гемифлоксацин) |
|
сопутствующими |
|
внутрь |
|
заболеваниями |
|
|
|
В этих случаях предпочтение отдается цефтриаксону внутримышечно (в/м) по 1 г (реже 2 г) 1 раз в сутки. Амоксициллин назначают по 0,5-1 г, амоксиклав и аналогичный ему препарат панклав - по 625 мг 3 раза в сутки в течение 7-10 дней. Из макролидов чаще используют азитромицин (хемомицин, сумамед), который назначают по 0,5 г 1 раз в сутки в течение 3 дней. При неэффективности препаратов первой линии назначают респираторные фторхинолоны, например, левофлоксацин по 0,5 г 1 раз в сутки в течение 7-10 дней.
Выбор антибактериальных препаратов при неэффективности стартового режима терапии у лиц пожилого и старческого возраста

Комментарии |
Препараты |
|
|
|
|
|
|
|
на 1-м этапе |
на 2-м этапе лечения |
|
|
лечения |
|
|
|
|
|
|
Возможны атипичные |
Амоксициллин |
Макролиды |
|
микроорганизмы (С. |
|
|
|
pneumoniae, M. |
|
|
|
pneumoniae) |
|
|
|
|
|
|
|
Возможны атипичные |
Амоксициллин/ |
Макролиды, |
|
микроорганизмы (С. |
клавуланат |
респираторные |
|
pneumoniae, M. |
|
фторхинолоны |
|
pneumoniae) |
|
|
|
|
|
|
|
Возможная причина |
Макролиды |
Бензилпенициллин, |
|
неэффективности |
|
амоксициллин, |
|
макролидов - |
|
амоксициллин / |
|
резистентные |
|
клавуланат, |
|
пневмококки или |
|
респираторные |
|
грамотрицательные |
|
фторхинолоны |
|
бактерии |
|
|
|
Предпочтительна ступенчатая терапия. При стабильном состоянии пациента допускается сразу назначение АМП внутрь. Примеры АМТ стационарных больных:
-амоксиклав по 1,2 г 3-4 раза в сутки в/в или в/м (в зависимости от тяжести течения) + азитромицин по 0,5 г 1 раз в сутки внутрь (в течение 3-5 дней). Через 3 дня амоксиклав парентерально отменяют и назначают амоксиклав или панклав внутрь по 625 мг 3 раза в сутки в течение 4-7 дней.
-цефуроксим по 0,75-1,5 г 3 раза в сутки в/в или в/м + азитромицин по 0,5 г 1 раз в сутки в течение 3-5 дней (доза и путь введения зависят от тяжести состояния). У цефалоспоринов цефуроксима (II поколение), цефотаксима и цефтриаксона (III поколение) нет пероральных форм препарата, поэтому ступенчатая схема лечения этими антибиотиками не применяется.
Убольных с иммунодефицитными состояниями выбор антибактериальной терапии еще в большей степени зависит от природы возбудителя. Наиболее распространенной схемой является назначение аминогли-козидов и современных цефалоспоринов. У больных СПИДом при развитии пневмонии, вызванной Pneumocystis carinii, принятой схемой лечения является парентеральное введение пентамидина и бактрима, сеп-трима.
•П а т о г е н е т и ч е с к а я т е р а п и я . При тяжелых и затяжных пневмониях используют препараты иммуномодулирующего дейст вия (интерферон, левамизол, зимозан, диуцифон, Т-активин, тималин).
Больным вирусной пневмонией показаны введение противогриппозного у-глобулина, противовирусных препаратов (рибоварин, интерферон), ингаляции фитонцидов [сок чеснока и(или) лука, приготовленные ex tem-рогае, в изотоническом растворе хлорида натрия].
При стафилококковой пневмонии проводят пассивную иммунизацию гипериммунной антистафилококковой плазмой или стафилококковым антитоксином.
Для восстановления неспецифической резистентности организма назначают витамины А, С, Е, группы В, используют биогенные стимуляторы и адаптогенные средства (алоэ, настойки женьшеня и лимонника, жидкий экстракт элеутерококка).
Для восстановления бронхиальной проходимости применяют бронхо-литические средства (эуфиллин, теопэк и пр.) и средства, разжижающие бронхиальный секрет (внутрь мукалтин, ацетилцистеин, бромгексин, горячее щелочное питье). Если наблюдается надсадный кашель как проявление бронхоспазма, сопутствующего П, назначают адреномиметические средства: фенотерол (беротек), сальбутамол.
При затяжном течении пневмонии иногда решающую роль играет восстановление бронхиального дренажа с помощью бронхоскопической санации.
•С и м п т о м а т и ч е с к а я т е р а п и я . При непродуктивном сухом кашле назначают противокашлевые средства (кодеин, либексин, тусупрекс, глауцина гидрохлорид и пр.); при затрудненном отхождении мокроты — отхаркивающие (настой травы термопсиса, корень алтея и пр.). В случае плохой переносимости высокой тем-
пературы тела показаны жаропонижающие средства (анальгин, ацетилсалициловая кислота). Больным с сопутствующей патологией сердечно-сосудистой системы, особенно пожилым, а также при тяжелом течении пневмонии назначают инъекции камфоры, сульфо-камфокаина, кордиамина, при недостаточности кровообращения — сердечные гликозиды.
Наличие одышки и цианоза служит показанием к проведению кислородной терапии. При выраженной интоксикации и деструкции легочного инфильтрата проводят дезинтоксикационную терапию (внутривенное введение реополиглюкина, гемодеза и других растворов).
Больным с тяжелой формой пневмонии, с выраженной интоксикацией, инфекционнотоксическим шоком показано внутривенное введение кортикостероидов. Небольшие дозы кортикостероидов (1 0 — 15 мг в день) внутрь назначают при вялом рассасывании инфильтрата или сопутствующем аллергическом бронхоспазме.
III. Физиотерапевтическое воздействие. При лечении больных П используют отвлекающие процедуры: банки, горчичники, горчичные обер тывания, которые при невысокой температуре тела принимают с первых дней болезни. После снижения температуры тела для ликвидации воспа лительных изменений назначают диатермию, индуктотермию, СВЧ, УВЧ и т.д. Рассасыванию очага пневмонии способствуют массаж грудной клет ки и ЛФК.
Аэрозольтерапия с использованием бронхолитических смесей отдельно или в комбинации с различными антибактериальными препаратами применяется в стадии разрешения.
8.Бронхиальная астма: этиология, патогенез, классификация, диагностика.
Бронхиальная астма (БА) – гетерогенное заболевание, характеризующееся хроническим воспалением дыхательных путей, наличием респираторных симптомов, таких как свистящие хрипы, одышка, заложенность в груди и кашель, которые варьируют по времени и интенсивности и проявляются вместе с вариабельной
обструкцией дыхательных путей.
ЭТИОЛОГИЯ
В развитии болезни играют роль внутренние и внешние факторы. В н у т р е н н и е |
|||
ф а к т о р ы — это биологические дефекты иммунной, эндокринной систем, вегетативной |
|||
нервной системы, чувствительности и реактивности бронхов, мукоцилиарного клиренса, |
|||
эндотелия сосудов легких, системы быстрого реагирования (тучные клетки и др.), |
|||
метаболизма арахидоновой кислоты и т.д. |
|
|
|
В н е ш н и е |
ф а к т о р ы , способствующие клинической |
реализации |
биологических |
дефектов, включают: 1) аллергены (пыльцевые, пылевые, пищевые, лекарственные, |
|||
производственные, аллергены клещей, насекомых, животных и пр.); 2) инфекцию (вирусы, |
|||
грибы; некоторые |
виды бактерий); 3) механические и |
химические |
раздражители |
(металлическая, древесная, силикатная, хлопковая пыль; пары кислот, щелочей; дымы и пр.); 4) метеорологические и физико-химические факторы (изменение температуры и влажности воздуха, колебания барометрического давления, магнитного поля земли, физические усилия и пр.); 5) стрессовые нервно-психические воздействия и физическую нагрузку; 6) фармакологические воздействия (р-адреноблокаторы, нестероидные противовоспалительные препараты и т.д.)
Инфекционные агенты, помимо их аллергизирующего действия, могут играть также иную роль: а) снижать порог чувствительности организма к неинфекционным (атопическим) аллергенам, повышать проницаемость для них слизистой оболочки органов дыхания; б) формировать неиммунологическим путем изменение реактивности клеток-мишеней
Патогенез:
БА у детей и взрослых зачастую обнаруживает связь с атопией, которая определяется как выработка чрезмерного количества иммуноглобулина Е (IgE), предназначенного для связывания аллергенов из окружающей среды. Возникновение аллергической сенсибилизации и возможность перехода ее в воспаление с появлением обструкции происходит под действием многих факторов в ранний период жизни, включая вдыхание табачного дыма, вирусные респираторные инфекции, частый и неконтролируемый прием антибиотиков, контакт с домашней пылью, аллергенами насекомых, животных, пыльцы растений, плесени. К распространенным астматическим триггерам относят также определенные продукты питания, химические раздражители, физическую нагрузку, сильные эмоциональные потрясения.
Современная трактовка БА предполагает персистирующий характер воспаления вне зависимости от степени тяжести заболевания. В воспалительном процессе участвуют эозинофилы, тучные клетки, лимфоциты, дендритные клетки, макрофаги, нейтрофилы, эпителиальные клетки. Основными клетками управления воспалительной реакцией путем высвобождения цитокинов считаются Т-лимфоциты. Т-лимфоциты 2-го типа (Th2 –лимфоциты) высвобождают специфическские цитокины: IL-4, IL-5, IL-9, IL-13, которые стимулируют выработку IgE В-лимфоцитами и увеличивают число эозинофилов в дыхательных путях. Также в усилении воспаления при БА участвуют фактор некроза опухоли α (TNF α), IL-1β и гранулоцитарномакрофагальный колониестимулирующий фактор (GM-CSP).
В воспалении принимает участие более 100 различных медиаторов. Это хемокины, привлекающие клетки воспаления в дыхательные пути, гистамин, цистеиниловые лейкотриены, простагландин D2.
Результатом воспаления является структурное изменение дыхательных путей, называемое ремоделированием. Поэтому чем тяжелее бронхиальная астма протекает у больного, тем выражение у него будут эти структурные изменения, тем хуже будет обратимость бронхиальной обструкции.
Классификация БА по степени тяжести
Классификация БА по степени тяжести проводится на основании клинической картины до начала терапии:
Ступень 1: Интермиттирующая БА Симптомы реже 1 раза в неделю
Короткие обострения Ночные симптомы не чаще двух раз в месяц
ОФВ1 или ПСВ ≥ 80% от должного Разброс ПСВ или ОФВ1 < 20%
Ступень 2: Легкая персистирующая БА Симптомы чаще 1 раза в неделю, но реже 1 раза в день
Обострения могут снижать физическую активность и нарушать сон Ночные симптомы чаще двух раз в месяц ОФВ1 или ПСВ ≥ 80% от должного Разброс ПСВ или ОФВ1 20—30%
Ступень 3: Персистирующая БА средней тяжести Ежедневные симптомы
Обострения могут приводить к ограничению физической активности и нарушению сна Ночные симптомы чаще 1 раза в неделю Ежедневное использование ингаляционных β2-агонистов короткого действия ОФВ1 или ПСВ 60—80% от должного Разброс ПСВ или ОФВ1 > 30%
Ступень 4: Тяжелая персистирующая БА Ежедневные симптомы
Частые обострения Частые ночные симптомы
Ограничение физической активности
ОФВ1 или ПСВ ≤ 60% от должного Разброс ПСВ или ОФВ1 > 30%
Диагностика.
Жалобы, анамнез, физикальное обследование
Первичное обследование:
Диагностика БА основана на обнаружении характерных симптомов и признаков при отсутствии альтернативного объяснения их возникновения. Главным является получение точной клинической картины (истории). Проводя первичную диагностику, основывайтесь на тщательной оценке симптомов и степени обструкции дыхательных путей.
Клинические признаки, повышающие вероятность наличия БА:
Наличие более одного из следующих симптомов: хрипы, удушье, чувство заложенности в грудной клетке и кашель, особенно в случаях:
ухудшения симптомов ночью и рано утром;
возникновения симптомов при физической нагрузке, воздействии аллергенов и холодного воздуха;
возникновения симптомов после приема аспирина или бета-блокаторов. Наличие атопических заболеваний в анамнезе;
Наличие БА и/или атопических заболеваний у родственников;
Распространенные сухие свистящие хрипы при выслушивании (аускультации) грудной клетки;
Низкие показатели пиковой скорости выдоха или объёма форсированного выдоха за 1 секунду (ретроспективно или в серии исследований), необъяснимые другими причинами;
Эозинофилия периферической крови, необъяснимая другими причинами.
Инструментальная диагностика Спирометрия и тесты на обратимость. Спирометрия является предпочтительным
начальным исследованием для оценки наличия и тяжести обструкции дыхательных путей. Если при исходном спирометрическом исследовании регистрируются признаки бронхиальной обструкции, то выполняется тест на обратимость (бронходилатационный тест) с целью выявления степени обратимости обструкции под влиянием бронхорасширяющих препаратов. Для исследования обратимости обструкции проводится проба с короткодействующим β2агонистом (сальбутамолом) в разовой дозе 400 мкг. Дозированные аэрозольные ингаляторы должны использоваться со спейсером. Повторное спирометрическое исследование необходимо провести через 15–30 мин после ингаляции β2-агониста.
Бронходилатационный тест считается положительным, если после ингаляции бронходилататора коэффициент бронходилатации (КБД) по ОФВ1 составляет не менее 12%, и при этом абсолютный прирост составляет 200 мл и более (сила рекомендаций 2 +).
Формула для расчета КБД: |
× 100% |
КБД = |
|
ОФВ1 после (мл) - ОФВ1 исх (мл)
ОФВ1 исх (мл)
Исследование бронхиальной гиперреактивности. Обычно выявление БГР основано на измерении ответа показателя ОФВ1 в ответ на ингаляцию повышающихся концентраций метахолина. Ответ рассчитывается в виде концентрации (или дозы) провокационного агента, вызывающих 20% падение показателя ОФВ1 (ПК20 илиПД20) с использованием линейной интерполяции логарифма концентрации кривой доза-ответ.
Другие применяемые бронхоконстрикторные тесты – с непрямыми провокационными агентами (маннитол, тест с физической нагрузкой). Положительный ответ на эти стимулы (т.е. падение ОФВ1 более, чем на 20%) – специфический индикатор БА.
Мониторирование пиковой скорости выдоха. Регистрируется лучший показатель пиковой скорости выдоха (ПСВ) после 3 попыток выполнения форсированного маневра с
паузой, не превышающей 2 сек после вдоха. Маневр выполняется сидя или стоя. Большее количество измерений выполняется в том случае, если разница между двумя максимальными показателями ПСВ превышает 40 л/мин.
Наиболее характерный признак БА — наличие приступов удушья. Однако клинический диагноз БА может быть поставлен с учетом оценки результатов всех трех этапов диагностического поиска, так как удушье встречается как симптом и при других заболеваниях. В связи с этим возникает на каждом из трех этапов необходимость ее дифференциации от заболеваний, составной частью которых является бронхоспастический синдром с развитием приступов удушья.
На I э т а п е диагностического поиска устанавливают: а) наличие приступов удушья, их особенности и связь с определенными факторами; б) аллергический анамнез (наследственную предрасположенность, непереносимость пищевых и лекарственных веществ); в) наличие предшествую-
щих заболеваний легких; г) влияние метеорологических факторов, физических усилий, дизовариальных расстройств и других причин на возникновение приступов удушья; д) эффективность проводимой ранее терапии; е) течение болезни, появление осложнений.
Больные жалуются на приступы удушья (затрудненное дыхание, преимущественно на выдохе), одышку и кашель. Характер кашля может быть разнообразным: чаще кашель сухой, надсадный, приступообразный или с выделением вязкой, трудноотделяемой мокроты. При развитии легочной недостаточности одышка беспокоит и в межприсгупный период. Повышение температуры тела может свидетельствовать об активности бронхоле-гочной инфекции. Затрудненное носовое дыхание, как правило, служит проявлением аллергической риносинусопатии (вазомоторный ринит, полипоз) — частого спутника или предшественника Б А (предастма). При расспросе больного необходимо уточнить частоту возникновения симптомов Б А в неделю, обратив особое внимание на ночные симптомы. Эти данные особенно важны для оценки тяжести течения болезни на момент обследования больного.
Данные анамнеза помогают установить связь развития приступов с воздействием определенных аллергенов и других факторов. Наиболее частой причиной обострения и развития БА является инфекция дыхательных путей; особенно велика ее роль в обострении болезни. Из анамнеза узнают о влиянии физического усилия (быстрая ходьба, смех и пр.), изменений метеорологических факторов (холод, повышенная влажность и др.), дизовариальных расстройств на возникновение приступов удушья. Знакомство с условиями труда помогает обнаружить профессиональную астму.
Изучение аллергологического анамнеза способствует диагностике ато-пического варианта БА. В подобных случаях можно получить сведения о поллинозе: обострения болезни имеют сезонный характер (чаще весной и летом), сопровождаются ринитом, конъюнктивитом. У таких больных бывают крапивница, отек Квинке; выявляется непереносимость пищевых продуктов, ряда лекарственных веществ; отмечается наследственная предрасположенность к аллергическим заболеваниям.
Ориентируясь на данные анамнеза, можно предположительно, а в ряде случаев и с уверенностью высказаться о так называемой аспириновой астме. Эти больные не страдают наследственной формой аллергических заболеваний. Их беспокоит нарушенное носовое дыхание (полипозные разрастания). Наиболее характерный симптом у таких больных — непереносимость нестероидных противовоспалительных препаратов (ацетилсалициловая кислота, индометацин и пр.), вызывающих астматические приступы. На этом этапе уже можно предположить простагландиновый механизм БА.
Указание в анамнезе на прием кортикостероидных препаратов свидетельствует о тяжести болезни, а эффективность приема — об иммунной форме Б А или кортикостероидозависимом ее варианте. Отсутствие эффекта от приема кортикоидных препаратов, особенно у больных с тяжелым течением Б А, делает предположение об аллергическом генезе Б А менее достоверным и практически исключает наличие у больного глюкокортикоид-ной недостаточности. Глюкокортикоиды неэффективны также при астме физического усилия.
Данные о развитии в прошлом астматического статуса свидетельствуют о тяжести течения заболевания и указывают на необходимость проведения терапии кортикостероидами. Наличие предшествующих заболеваний
органов дыхания (ХБ, ХП) предопределяет обычно тяжесть течения БА, отсутствие «светлых» промежутков.
Б А может протекать монотонно, с постоянно нарушенным дыханием и потребностью принимать ежедневно противоастматические средства.
Другой тип течения БА характеризуется периодическими обострениями с заметно усиливающимися признаками бронхиальной обструкции и ремиссиями, когда нарушения бронхиальной проходимости резко уменьшаются или исчезают. Такое течение БА наиболее характерно для атопи-ческого варианта заболевания.
Значение I этапа диагностического поиска особенно велико для диагностики Б А в начальном периоде заболевания, когда все проявления астмы имеют эпизодический характер, а физикальное исследование не дает достаточной информации для постановки диагноза.
На II э т а п е диагностического поиска в развернутой стадии болезни выявляют: а) внелегочные проявления аллергии; б) признаки бронхо-обструктивного синдрома; в) осложнения БА; г) другие заболевания, сопровождающиеся приступами бронхоспазма.
При обследовании кожных покровов иногда можно выявить изменения, характерные для аллергических проявлений: крапивницу, папулезные и эритематозные высыпания. Эти изменения могут свидетельствовать об иммунологическом варианте БА. При аллергических формах БА могут быть конъюнктивиты (особенно часто у больных поллинозами). Сочетание Б А с экземой, нейродермитом, псориазом предрасполагает к тяжелому течению астмы. Грибковое поражение кожи, ногтевых лож может сопровождаться гиперчувствительностью к грибковым аллергенам.
Часто можно выявить нарушение носового дыхания. Риниты и поли-поз рассматриваются как предастма. Гаймориты и другие синуситы служат очагом инфекции, который может провоцировать удушье.
При физикальном исследовании легких могут быть выявлены признаки эмфиземы. Появлению эмфиземы легких, а затем хронической дыхательной недостаточности и легочного сердца часто способствует хронический бронхит. Он может присоединиться к БА, если она затяжная, а также может служить фоном, на котором развивается инфекционнозависимая Б А.
Аускультация легких помогает обнаружить признаки бронхиальной обструкции, для которой характерны изменение дыхания (удлиненный выдох), сухие, преимущественно свистящие, хрипы. Иногда при обследовании вне приступа удушья сухих хрипов может быть немного или они не прослушиваются. Форсированный выдох позволяет выявить скрытый бронхоспазм (появление или нарастание сухих хрипов).
Обязательно проводят аускультацию легких в положении больного лежа: количество сухих хрипов увеличивается при «вагусном» их механизме.
Постоянно выслушиваемые на определенном участке влажные звонкие («трескучие») мелкопузырчатые хрипы могут свидетельствовать о развившемся пневмосклерозе.
В случае астматического статуса отмечается уменьшение количества сухих хрипов при аускультации вплоть до развития «немого» легкого, несмотря на резкое нарастание удушья и одышки.
Объективное обследование больного помогает выявить симптомы других заболеваний («бабочка» на коже лица, лимфоаденопатия в сочетании с увеличением печени и селезенки, стойкое повышение артериального дав-
ления, упорная лихорадка и пр.), при которых возникают приступы брон-хоспазма, проявляющиеся удушьем (системная красная волчанка, узелковый периартериит, реже другие диффузные заболевания соединительной ткани). В таких случаях предполагаемый диагноз Б А становится маловероятным.
На III э т а п е диагностического поиска выявляют: а) нарушение бронхиальной проходимости; б) измененную реактивность бронхов;
в) характерные изменения при проведении аллергологического обсле дования;
г) наличие очагов инфекции и признаков воспаления; д) осложнения БА.
Спирография выявляет снижение объема форсированного выдоха за первую секунду (OOBi), уменьшение коэффициента Тиффно (соотношения ОФВ] к ЖЕЛ в процентах) и процентного отношения OOBi к ФЖЕЛ — характерные признаки нарушения бронхиальной проходимости по обструктивному типу. При обострении БА значительно возрастают (на 100 % и более превышают исходный уровень) остаточный объем легких (ООЛ) и функциональная остаточная емкость (ФОЕ). Анализ спирограм-мы позволяет обнаружить признаки трахеобронхиальной дискинезии по наличию зазубрины в верхней части нисходящего колена спирограммы (симптом Колбета— Висса). Эта дискинезия также способствует нарушению бронхиальной проходимости.
Пикфлоуметрия — определение пиковой объемной скорости выдоха — является непременным условием контроля за состоянием больного. Ее проводят утром (до приема лекарств) и вечером с помощью индивидуального карманного прибора — пикфлоуметра. Желательно, чтобы разброс утренних и вечерних значений ПСВ не превышал 20 %.
Пневмотахометрия выявляет преобладание мощности вдоха над мощностью выдоха, что служит ранним признаком бронхиальной обструкции.
Пневмотахография с построением кривой «поток —объем» позволяет диагностировать нарушение бронхиальной проходимости раздельно на уровне крупных, средних и мелких бронхов по данным экспираторного потока при легочном объеме, равном 75, 50, 35 % ФЖЕЛ. Для периферической обструкции характерно значительное снижение кривой «поток — объем» на участке 50 — 75 % ФЖЕЛ, т.е. снижение максимальной объемной скорости на уровне 5075 % ФЖЕЛ (МОС50 , МОС75 ).
По увеличению мощности выдоха при проведении пневмотахометрии и приросту показателей МОС75, MOCso, МОС25 по данным пневмотахометрии, проводимым после предварительного вдыхания больным бронхоли-тических (симпатомиметических и/или холинолитических) веществ определяют роль бронхоспазма в нарушении бронхиальной проходимости и степень его выраженности.
С помощью этих же методов подбирают наиболее активный для данного больного ингаляционный бронхолитический (симпатомиметический или холинолитический) препарат.
Появление повышенного бронхиального сопротивления, зарегистрированного с помощью спирографии, пневмотахометрии и пневмотахогра-фии в ответ на физическую нагрузку, вдыхание холодного воздуха, раз-
дражающих газов, пылей и ацетилхолина, свидетельствует об измененной реактивности бронхов.
Аллергологическое тестирование осуществляется только вне обострения заболевания и проводится с помощью набора разнообразных неинфекционных и инфекционных аллергенов.
Проводят кожные аллергические пробы (аппликационный, скарифи-кационный и внутрикожный способы нанесения аллергена). Выявленный аллерген можно наносить на конъюнктиву глаза, слизистую оболочку носа для оценки его провоцирующего действия. Наиболее достоверным методом специфической диагностики БА считают выявление специфической гиперреактивности бронхов с помощью ингаляционных провокационных тестов. Ингаляционно аллерген вводят с большой осторожностью, так как такой путь введения может спровоцировать тяжелый приступ БА или развитие астматического статуса. Установление аллергена и уточнение его провоцирующего действия — прямое доказательство аллергической природы БА.
Для специфической диагностики БА применяют также радиоиммуно-сорбентный тест, позволяющий количественно оценить IgE-антитела. Повышение уровня общего IgE подтверждает при соответствующих данных анамнеза атопический механизм развития БА (этот тест применяют при невозможности проведения аллергологического тестирования).
Лабораторные исследования помогают подтвердить предполагаемый диагноз, оценить эволюцию заболевания и эффективность проводимого лечения.
Появление эозинофилов в мокроте является одним из основных диагностических критериев Б А. Кроме того, диагностическое значение имеет обнаружение в мокроте спиралей Куршмана и кристаллов Шарко —Лейдена. Эозинофильный лейкоцитоз представляет собой неспецифический признак и может служить проявлением общей аллергической реакции организма.
Лабораторные исследования помогают решать вопрос о наличии активного воспалительного процесса и степени его выраженности (увеличение острофазовых показателей).
При обострении БА и астматическом статусе особое значение имеет исследование кислотно-основного состояния и газового состава крови (изменяющихся при увеличении дыхательной недостаточности).
Рентгенологическое исследование помогает выявить очаги инфекции (в придаточных пазухах, зубах, желчном пузыре) и установить наличие острого (пневмония) или обострения хронического воспалительного процесса в легких, эмфиземы легких и пневмосклероза.
По данным ЭКГ обнаруживают признаки развития компенсированного легочного сердца — гипертрофию правых отделов сердца (подробнее см. «Легочное сердце»). При подозрении на симптоматический характер бронхоспазма проводят дополнительное обследование по программе, определяемой предполагаемым заболеванием.
9.Бронхиальная астма: клиника, современные подходы к лечению.
Клиническая картина. Наиболее характерный признак БА — наличие приступов удушья. Однако клинический диагноз БА может быть поставлен с учетом оценки результатов всех трех этапов диагностического поиска, так как удушье встречается как симптом и при других заболеваниях. В связи с этим возникает на каждом из трех этапов необходимость ее дифференциации от заболеваний, составной частью которых является бронхоспастический синдром с развитием приступов удушья.
На I э т а п е диагностического поиска устанавливают: а) наличие приступов удушья, их особенности и связь с определенными факторами; б) аллергический анамнез (наследственную предрасположенность, непереносимость пищевых и лекарственных веществ); в) наличие предшествую-
щих заболеваний легких; г) влияние метеорологических факторов, физических усилий, дизовариальных расстройств и других причин на возникновение приступов удушья; д) эффективность проводимой ранее терапии; е) течение болезни, появление осложнений.
Больные жалуются на приступы удушья (затрудненное дыхание, преимущественно на выдохе), одышку и кашель. Характер кашля может быть разнообразным: чаще кашель сухой, надсадный, приступообразный или с выделением вязкой, трудноотделяемой мокроты. При развитии легочной недостаточности одышка беспокоит и в межприсгупный период. Повышение температуры тела может свидетельствовать об активности бронхоле-гочной инфекции. Затрудненное носовое дыхание, как правило, служит проявлением аллергической риносинусопатии (вазомоторный ринит, полипоз) — частого спутника или предшественника Б А (предастма). При расспросе больного необходимо уточнить частоту возникновения симптомов Б А в неделю, обратив особое внимание на ночные симптомы. Эти данные особенно важны для оценки тяжести течения болезни на момент обследования больного.
Данные анамнеза помогают установить связь развития приступов с воздействием определенных аллергенов и других факторов. Наиболее частой причиной обострения и развития БА является инфекция дыхательных путей; особенно велика ее роль в обострении болезни. Из анамнеза узнают о влиянии физического усилия (быстрая ходьба, смех и пр.), изменений метеорологических факторов (холод, повышенная влажность и др.), дизовариальных расстройств на возникновение приступов удушья. Знакомство с условиями труда помогает обнаружить профессиональную астму.
Изучение аллергологического анамнеза способствует диагностике ато-пического варианта БА. В подобных случаях можно получить сведения о поллинозе: обострения болезни имеют сезонный характер (чаще весной и летом), сопровождаются ринитом, конъюнктивитом. У таких больных бывают крапивница, отек Квинке; выявляется непереносимость пищевых
продуктов, ряда лекарственных веществ; отмечается наследственная предрасположенность к аллергическим заболеваниям.
Ориентируясь на данные анамнеза, можно предположительно, а в ряде случаев и с уверенностью высказаться о так называемой аспириновой астме. Эти больные не страдают наследственной формой аллергических заболеваний. Их беспокоит нарушенное носовое дыхание (полипозные разрастания). Наиболее характерный симптом у таких больных — непереносимость нестероидных противовоспалительных препаратов (ацетилсалициловая кислота, индометацин и пр.), вызывающих астматические приступы. На этом этапе уже можно предположить простагландиновый механизм БА.
Указание в анамнезе на прием кортикостероидных препаратов свидетельствует о тяжести болезни, а эффективность приема — об иммунной форме Б А или кортикостероидозависимом ее варианте. Отсутствие эффекта от приема кортикоидных препаратов, особенно у больных с тяжелым течением Б А, делает предположение об аллергическом генезе Б А менее достоверным и практически исключает наличие у больного глюкокортикоид-ной недостаточности. Глюкокортикоиды неэффективны также при астме физического усилия.
Данные о развитии в прошлом астматического статуса свидетельствуют о тяжести течения заболевания и указывают на необходимость проведения терапии кортикостероидами. Наличие предшествующих заболеваний
органов дыхания (ХБ, ХП) предопределяет обычно тяжесть течения БА, отсутствие «светлых» промежутков.
Б А может протекать монотонно, с постоянно нарушенным дыханием и потребностью принимать ежедневно противоастматические средства.
Другой тип течения БА характеризуется периодическими обострениями с заметно усиливающимися признаками бронхиальной обструкции и ремиссиями, когда нарушения бронхиальной проходимости резко уменьшаются или исчезают. Такое течение БА наиболее характерно для атопи-ческого варианта заболевания.
Значение I этапа диагностического поиска особенно велико для диагностики Б А в начальном периоде заболевания, когда все проявления астмы имеют эпизодический характер, а физикальное исследование не дает достаточной информации для постановки диагноза.
На II э т а п е диагностического поиска в развернутой стадии болезни выявляют: а) внелегочные проявления аллергии; б) признаки бронхо-обструктивного синдрома; в) осложнения БА; г) другие заболевания, сопровождающиеся приступами бронхоспазма.
При обследовании кожных покровов иногда можно выявить изменения, характерные для аллергических проявлений: крапивницу, папулезные и эритематозные высыпания. Эти изменения могут свидетельствовать об иммунологическом варианте БА. При аллергических формах БА могут быть конъюнктивиты (особенно часто у больных поллинозами). Сочетание Б А с экземой, нейродермитом, псориазом предрасполагает к тяжелому течению астмы. Грибковое поражение кожи, ногтевых лож может сопровождаться гиперчувствительностью к грибковым аллергенам.
Часто можно выявить нарушение носового дыхания. Риниты и поли-поз рассматриваются как предастма. Гаймориты и другие синуситы служат очагом инфекции, который может провоцировать удушье.
При физикальном исследовании легких могут быть выявлены признаки эмфиземы. Появлению эмфиземы легких, а затем хронической дыхательной недостаточности и легочного сердца часто способствует хронический бронхит. Он может присоединиться к БА, если она затяжная, а также может служить фоном, на котором развивается инфекционнозависимая Б А.
Аускультация легких помогает обнаружить признаки бронхиальной обструкции, для которой характерны изменение дыхания (удлиненный выдох), сухие, преимущественно свистящие, хрипы. Иногда при обследовании вне приступа удушья сухих хрипов может быть немного или они не прослушиваются. Форсированный выдох позволяет выявить скрытый бронхоспазм (появление или нарастание сухих хрипов).
Обязательно проводят аускультацию легких в положении больного лежа: количество сухих хрипов увеличивается при «вагусном» их механизме.
Постоянно выслушиваемые на определенном участке влажные звонкие («трескучие») мелкопузырчатые хрипы могут свидетельствовать о развившемся пневмосклерозе.
В случае астматического статуса отмечается уменьшение количества сухих хрипов при аускультации вплоть до развития «немого» легкого, несмотря на резкое нарастание удушья и одышки.
Объективное обследование больного помогает выявить симптомы других заболеваний («бабочка» на коже лица, лимфоаденопатия в сочетании с увеличением печени и селезенки, стойкое повышение артериального дав-
ления, упорная лихорадка и пр.), при которых возникают приступы брон-хоспазма, проявляющиеся удушьем (системная красная волчанка, узелковый периартериит, реже другие диффузные заболевания соединительной ткани). В таких случаях предполагаемый диагноз Б А становится маловероятным.
На III э т а п е диагностического поиска выявляют: а) нарушение бронхиальной проходимости; б) измененную реактивность бронхов;
в) характерные изменения при проведении аллергологического обсле дования;
г) наличие очагов инфекции и признаков воспаления; д) осложнения БА.
Спирография выявляет снижение объема форсированного выдоха за первую секунду (OOBi), уменьшение коэффициента Тиффно (соотношения ОФВ] к ЖЕЛ в процентах) и процентного отношения OOBi к ФЖЕЛ — характерные признаки нарушения бронхиальной проходимости по обструктивному типу. При обострении БА значительно возрастают (на 100 % и более превышают исходный уровень) остаточный объем легких (ООЛ) и функциональная остаточная емкость (ФОЕ). Анализ спирограм-мы позволяет обнаружить признаки трахеобронхиальной дискинезии по наличию зазубрины в верхней части нисходящего колена спирограммы (симптом Колбета— Висса). Эта дискинезия также способствует нарушению бронхиальной проходимости.
Пикфлоуметрия — определение пиковой объемной скорости выдоха — является непременным условием контроля за состоянием больного. Ее проводят утром (до приема лекарств) и вечером с помощью индивидуального карманного прибора — пикфлоуметра. Желательно, чтобы разброс утренних и вечерних значений ПСВ не превышал 20 %.
По увеличению мощности выдоха при проведении пневмотахометрии и приросту
Появление повышенного бронхиального сопротивления, зарегистрированного с помощью спирографии, пневмотахометрии и пневмотахогра-фии в ответ на физическую нагрузку, вдыхание холодного воздуха, раз-
дражающих газов, пылей и ацетилхолина, свидетельствует об измененной реактивности бронхов.
Аллергологическое тестирование осуществляется только вне обострения заболевания и проводится с помощью набора разнообразных неинфекционных и инфекционных аллергенов.
Проводят кожные аллергические пробы (аппликационный, скарифи-кационный и внутрикожный способы нанесения аллергена). Выявленный аллерген можно наносить на конъюнктиву глаза, слизистую оболочку носа для оценки его провоцирующего действия. Наиболее достоверным методом специфической диагностики БА считают выявление специфической гиперреактивности бронхов с помощью ингаляционных провокационных тестов. Ингаляционно аллерген вводят с большой осторожностью, так как такой путь введения может спровоцировать тяжелый приступ БА или развитие астматического статуса. Установление аллергена и уточнение его провоцирующего действия — прямое доказательство аллергической природы БА.
Для специфической диагностики БА применяют также радиоиммуно-сорбентный тест, позволяющий количественно оценить IgE-антитела. Повышение уровня общего IgE
подтверждает при соответствующих данных анамнеза атопический механизм развития БА (этот тест применяют при невозможности проведения аллергологического тестирования).
Лабораторные исследования помогают подтвердить предполагаемый диагноз, оценить эволюцию заболевания и эффективность проводимого лечения.
Появление эозинофилов в мокроте является одним из основных диагностических критериев Б А. Кроме того, диагностическое значение имеет обнаружение в мокроте спиралей Куршмана и кристаллов Шарко —Лейдена. Эозинофильный лейкоцитоз представляет собой неспецифический признак и может служить проявлением общей аллергической реакции организма.
Рентгенологическое исследование помогает выявить очаги инфекции (в придаточных пазухах, зубах, желчном пузыре) и установить наличие острого (пневмония) или обострения хронического воспалительного процесса в легких, эмфиземы легких и пневмосклероза.
По данным ЭКГ обнаруживают признаки развития компенсированного легочного сердца — гипертрофию правых отделов сердца (подробнее см. «Легочное сердце»). При подозрении на симптоматический характер бронхоспазма проводят дополнительное обследование по программе, определяемой предполагаемым заболеванием.
ЛЕЧЕНИЕ
Ступенчатый подход к лечению бронхиальной астмы
• |
I с т у п е н ь |
(лечение легкой персистирующей БА): ингаляцион |
|
|
ные Рг-агонисты короткого действия применяют «по требованию» |
||
|
не более 3 раз в неделю; игаляционное введение хромогликата на |
||
|
трия (интала), или хромогликата натрия недокромила (тайледа), |
||
|
или рг-агониста короткого действия рекомендуется перед предпола |
||
• |
гаемым контактом с аллергеном или перед физической нагрузкой. |
||
II с т у п е н ь |
(лечение Б А средней тяжести): ежедневная ингаля |
||
|
ционная противовоспалительная терапия — хромогликат натрия |
||
|
(интал) или кортикостероидные препараты в дозе 200 — 500 мкг. |
||
|
При необходимости увеличивают дозу кортикостероидов до 400 — |
||
|
700 мкг (или при ночных приступах добавляют пролонгированные |
||
|
бронходилататоры). Ингаляционные р2-агонисты короткого дейст |
||
• |
вия (используют не чаще 3 — 4 раз в день). |
||
III |
с т у п е н ь (лечение Б А средней тяжести): ингаляционные |
||
|
кортикостероидные препараты по 800 — 1000 мкг ежедневно; приме |
||
|
няют пролонгированные теофиллины или пероральные рг-агонис |
||
|
ты, |
или ингаляционные р2-агонисты пролонгированного действия |
|
|
(особенно при ночных приступах); можно назначать антихолинер- |
||
|
гические препараты; в случае необходимости применяют ингаляци |
||
• |
онные рг-агонисты короткого действия, но не чаще 3 — 4 раз в день. |
||
IV |
с т у п е н ь (лечение БА тяжелого течения): ингаляционные |
||
|
кортикостероидные препараты по 800—1000 мкг в день; пролонги |
||
|
рованные теофиллины и/или пероральные или пролонгированные |
||
Рг-агонисты; при необходимости назначают р2-агонисты короткого действия (как правило, утром) ингаляционно, но не чаще 3 — 4 раз в день. Можно применять антихолинергические препараты. В тера пию включаются кортикостероидные препараты (перорально еже дневно или по альтернирующей схеме).
•Ступень 1
•[А] (взрослые и подростки), [B] (дети в возрасте от 5 до 12 лет),[D] (дети до 5 лет)
•ингаляционные β2 агонисты короткого действия применяются в качестве неотложной облегчающей терапии у всех пациентов с симптомами БА на всех ступенях терапии.
•[B] Регулярная терапия низкими дозами ИГКС (табл. 7, 8) в дополнение к КДБА по потребности должна быть рассмотрена для пациентов с риском обострений.
•У детей до 5 лет регулярная терапия может начинаться с низких доз ИГКС, с 2 лет – монотерапия антигонистами лейкотриеновых рецепторов, кромонов. Предпочтение в доставке ИГКС отдается небулайзерной терапии у детей (с 6мес – будесонид суспензия, с 6 лет – также беклометазона дипропионат), с 1года – флутиказона пропионат со спейсером.
•Ступень 2
•[A] Предпочтительный выбор: регулярное применение низких доз ИГКС плюс КДБА по потребности
•[A] Лечение низкими дозами ИГКС редуцирует симптомы БА, повышает функцию легких, улучшает качество жизни, уменьшает риск обострений, госпитализаций и смертельных исходов из-за БА.
•Антилейкотриеновые препараты или кромоны
•A. (дети с двух лет) – рекомендуются как предотвращающие обострение при БА в сочетании с аллергическим ринитом, при вирусиндуцированной БА, астме физического усилия.
•[A] Антагонисты лейкотриеновых рецепторов менее эффективны, чем ИГКС.
•ИГКС
•[А] (взрослые и подростки); [А] (дети в возрасте от 5 до 12 лет); [А] (дети до 5 лет) - ингаляционные стероиды рекомендуются как превентивные препараты для взрослых и детей для достижения целей лечения.
•Начальная доза ИГКС выбирается согласно тяжести заболевания.
•У взрослых стартовая доза, как правило, эквипотентна дозе беклометазона дипропионата
(БДП) 400 мкг в день, у детей эквипотентна БДП 200 мкг в день. У детей в возрасте до пяти лет могут быть необходимы более высокие дозы, если есть проблемы с доставкой лекарственных средств.
• По достижении и поддержании контроля БА, по крайней мере на протяжении 3-х месяцев, дозы ИГКС титруются до самой низкой дозы, при которой сохраняется эффективный контроль БА.
Частота дозирования ИГКС (взрослые и подростки); [А] (дети в возрасте от 5 до 12 лет); [А ](дети до 5 лет) - ИГКС первоначально назначаются два раза в день, за исключением некоторых современных стероидов, назначаемых однократно в день.
[А] (взрослые и подростки); [А] (дети в возрасте от 5 до 12 лет) [А] (дети в возрасте до 5 лет) – после достижения хорошего контроля ИГКС можно применять один раз в день в той же суточной дозе.
Для детей, получающих ≥ 400 мкг в день беклометазона дипропионата (БДП) или эквивалент: в плане должны быть конкретные письменные рекомендации в случае присоединения интеркуррентного заболевания; ребенок должен быть под наблюдением педиатра и специалиста аллерголога/пульмонолога в период длительного лечения.
Ступень 3
[А] Предпочтительный выбор (взрослые): комбинация низких доз ИГКС/ДДБА как поддерживающая терапия плюс КДБА по потребности ИЛИ комбинация низких доз ИГКС/формотерол (будесонид или беклометазон) в качестве поддерживающей терапии и для купирования симптомов (в режиме единого ингалятора)
[А] Предпочтительный выбор (дети старше 5 лет): низкие/средние дозы ИГКС или в комбинации с ДДБА или антагонистами лейкотриеновых рецепторов.
[B] Предпочтительный выбор (дети до 5 лет): антагонисты лейкотриеновых рецепторов в качестве дополнения к терапии ИГКС.
[A] Добавление ДДБА к той же самой дозе ИГКС обеспечивает дополнительное улучшение симптомов и легочной функции с редукцией риска обострений, по сравнению с увеличением дозы ИГКС.
[A] У пациентов групп риска ИГКС/формотерол в качестве единого ингалятора значительно редуцирует обострения и обеспечивает такой же уровень контроля БА на относительно низких дозах ИГКС, по сравнению с фиксированными дозами ИГКС/ДДБА в качестве поддерживающей терапии + КДБА по потребности или по сравнению с высокими дозами ИГКС + КДБА по потребности. Режим единого ингалятора (для поддерживающей терапии и купирования симптомов) зарегистрирован у пациентов 18-ти лет и старше для препаратов будесонид/формотерол (фиксированная комбинация) в виде ДПИ и беклометазон/формотерол
ввиде ДАИ.
•[A] Ингаляторы, содержащие фиксированные комбинации, гарантируют применение ДДБА только вместе с ИГКС и могут улучшать комплайнс.
•При уменьшении объема терапии, включающей комбинацию ИГКС/ДДБА, вероятность сохранения контроля выше при уменьшении дозы ИГКС в составе комбинации и отмене ДДБА после перехода на низкие дозы ИГКС.
•[B] При наличии у пациента с БА, получающего терапию ИГКС, ограничений по применению ДДБА (нежелательных эффектов, противопоказаний или индивидуальной непереносимости) в качестве альтернативы ДДБА может быть использован тиотропий Респимат. Кроме того, тиотропий Респимат может быть добавлен к терапии ИГКС/ДДБА у пациентов с частыми (≥2 в год) и/или тяжелыми обострениями БА (хотя бы 1 обострение в течение года, потребовавшее назначения системных ГКС или госпитализации).
•Ступень 4
•[А] Предпочтительный выбор (взрослые): комбинация низких доз ИГКС/формотерол
(будесонид или беклометазон) в качестве поддерживающей терапии и для купирования симптомов (в режиме единого ингалятора) ИЛИ комбинация средних доз ИГКС/ДДБА как поддерживающая терапия плюс КДБА по потребности
•[А] У взрослых и подростков с БА, имеющих≥ 1 обострений в предшествующий год, комбинация низких доз ИГКС/ формотерол в качестве поддерживающей терапии и для купирования симптомов (в режиме единого ингалятора) является более эффективной для уменьшения обострений, чем поддерживающая терапия ИГКС/ДДБА в тех же дозах или лечение ИГКС в более высоких дозах.
•[А] У взрослых пациентов, получающих терапию ступеней 3–4 (ИГКС/ДДБА, или в сочетании с другими базисными препаратами, или монотерапия ИГКС в высоких дозах), недостигнутый контроль БА или наличие частых (≥2 в год) и/или тяжелых обострений БА (хотя бы 1 обострение в течение года, потребовавшее назначения системных ГКС или госпитализации) служат показаниями к назначению тиотропия Респимат.
•[D] (взрослые и подростки); [D] (дети в возрасте от 5 до 12 лет) – если контроль остается недостаточным на дозе 800 мкг БДП день (взрослые и подростки) и 400 мкг в день (дети от 5 до 12 лет) ингаляционных стероидов в комбинации с длительно действующим β2агонистом (ДДБА), рассматриваются следующие варианты:
•повышение дозы ИГКС до максимальных + ДДБА
•добавление антилейкотриеновых препаратов
•добавление теофиллина замедленного высвобождения
больным с тяжелой аллергической БА, некотролируемой приемом высоких доз ИГКС в комбинации с ДДБА, начиная с 6 летнего возраста, рассмотреть назначение омализумаба Высокие дозы ИГКС могут применяться с помощью дозированных аэрозольных ингаляторов (ДАИ) со спейсером или через небулайзер.
Если дополнительное лечение неэффективно, следует прекратить прием препаратов (в случае увеличения дозы ингаляционных стероидов – уменьшить до первоначальной дозы).
Прежде чем перейти к 5 ступени, направить пациентов с неадекватно контролируемой астмой, особенно детей, в отделение специализированной помощи для обследования.
У детей всех возрастов, которые получают специализированную медицинскую помощь, можно применить более высокие дозы ингаляционных кортикостероидов (более 800 мкг/сутки), прежде чем перейти к 5 ступени (нет контролируемых исследований).
Ступень 5
[D] Все пациенты с персистирующими симптомами или обострениями БА, несмотря на правильную технику ингаляции и хорошую приверженность лечению, соответствующему ступени 4, должны быть направлены к специалисту, занимающемуся экспертизой и лечением тяжелой БА.
Дополнительная терапия к максимальной дозе ИГКС ≥ 1000 мкг в эквиваленте БДП: Тиотропий
Омализумаб Минимально возможная доза пероральных ГКС
[А] У взрослых пациентов, получающих терапию ступени 4 (ИГКС/ДДБА, или в сочетании с другими базисными препаратами, или монотерапия ИГКС в высоких дозах), недостигнутый контроль БА или наличие частых (≥2 в год) и/или тяжелых обострений БА (хотя бы 1 обострение в течение года, потребовавшее назначения системных ГКС или госпитализации) служат показаниями к назначению тиотропия Респимат.
[A] Терапия омализумабом (анти-IgE) может быть рассмотрена у взрослых, подростков и детей старше 6 лет с тяжелой аллергической БА, которая не контролируется лечением, соответствующим ступени 4.
Пациенты на пероральных ГКС, которые ранее не получали ингаляционной терапии
А (взрослые и подростки); D (дети в возрасте от 5 до 12 лет) - у взрослых рекомендуется метод элиминации или уменьшения дозы СГКС при применении ИГКС в дозах до 2000 мкг/сутки, если потребуется. У детей в возрасте от 5 до 12 лет необходима очень осторожная тактика при превышении дозы ИГКС 800 мкг/сутки.
• D (взрослые и подростки); D (дети в возрасте от 5 до 12 лет), D (дети до 5 лет) – возможно пробное лечение с пролонгированными β2агонистами, антагонистами лейкотриеновых рецепторов и теофиллинами в течение примерно шести недель. Они должны быть отменены, если нет уменьшения дозы стероидов, улучшения симптомов или функции легких.
А Лекарственная противовоспалительная терапия.
Глюкокортикоидные препараты в настоящее время являются наиболее эффективными противовоспалительными средствами при лечении Б А. Их можно применять местно (ингаляционно) или системно (внутрь или парентерально). Способ введения во многом определяется особенностью течения заболевания.
Ингаляционное введение кортикостероидных препаратов оказывает местный эффект и дает минимум побочных эффектов. К числу короткодействующих препаратов относятся бекотид и бекломет (беклометазон дипропионат); их следует применять 4 раза в день. Такие препараты, как ингакорт (флунисолид), фликсотид (флютиказон пропионат) и пульми-корт турбухалер (будезонид), характеризуются большей продолжительностью действия, что позволяет использовать их для надежного контроля за течением БА 2 раза в сутки.
Бронхолитическая терапия: 1) бронхолитические препараты парентерально, в свечах или перорально. Препаратом выбора остается эуфиллин (10 мл 2,4 % раствора внутривенно струйно или капель-но) или теофиллин (по 0,3 г в свечах предпочтительнее на ночь), эуфиллин по 0,15 г в таблетках после еды 3 — 4 раза в день. Применяют препараты эуфиллина пролонгированного действия (теопек, теодур и др.). Эти препараты являются базисными и назначаются всем больным (при условии хорошей переносимости); 2) симпато-миметические и(или) холинолитические препараты назначаются в дозированном аэрозоле, как правило, при появлении предвестников приступа удушья. Постоянное применение этих препаратов в ингаляторах не рекомендуется во избежание побочных эффектов (тахикардия, повышение АД, нарушения ритма сердца); р2-адреностиму-ляторы эффективны при Б А, вызываемой физической нагрузкой, точно так же как и блокаторы медленных кальциевых каналов
Дополнительная патогенетическая терапия:
1) муколитические препараты в виде ингаляции (ацетилцистеин) или таблеток (мукалтин, лазолван), настои и отвары термопсиса назначают при вязкой, трудноотделяемой мокроте. Хорошее секретолитическое действие оказывают горячее щелочное питье и йодистые препараты (3 % раствор йодида калия по 1 столовой ложке 3 — 4 раза в день; следует помнить о возмож-
ной непереносимости препарата: слезотечение, ринорея, усиление бронхоспазма);
2)антибактериальную терапию проводят при обострении воспа лительного процесса в бронхолегочной системе у больных с инфекционнозависимой БА;
3)лечебная бронхоскопия под наркозом проводится в случае отсутствия эффекта от лекарственной терапии у больных при сопутствующем катарально-гнойном и гнойном эндобронхите (местно вводят антибактериальные средства, предпочтение оказывается 1 % раствору диоксидина). При необходимости эндобронхиально вводят кортикостероиды (гидрокортизон);
4)антагонисты кальция (нифедипин, изоптин, финоптин) ингибируют трансмембранный поток кальция, что ведет к уменьше нию выхода медиаторных веществ из тучных клеток. Препара ты показаны больным при сочетании БА с ишемической болез нью сердца и при астме «физического усилия»;
5)антимедиаторы имеют небольшое значение в лечении Б А: а) антигистаминные препараты блокируют Нгрецепторы, уменьшая действие гистамина на гладкую мускулатуру брон хов; б) антисеротониновые препараты (циннаризин) применя ют лишь при лечении больных БА с четкими клиническими признаками гиперсеротонинемии (тахикардия, наклонность к поносам, гиперемия лица), в) ингибиторы калликреина — трасилол, контрикал (по 10 000 ЕД) — вводят внутривенно капельно при затянувшихся приступах Б А. Используют также гепарин, улучшающий микроциркуляцию. В настоящее время применяют две генерации антагонистов Hi-рецепторов. Пре параты первого поколения (димедрол, тавегил, супрастин, пипольфен, диазолин) оказывают ряд нежелательных воздей ствий (снотворное, вызывает сухость во рту, тахикардию, задержку мочи и т.д.), что резко ограничивает их применение. Препараты второго поколения — астемизол, кларитин и др. — лишены этих недостатков. Кроме того, помимо блокады Нгрецепторов, в высоких дозах они уменьшают выделение медиато ров из тучных клеток и базофилов. Комбинацию сосудосужи вающего средства с лоратадином (псевдоэфедрин сульфат 120 мг и лоратадин 5 мг) — клариназе — с успехом применяют (по 1 таблетке 2 раза в день) для лечения аллергических ринитов;
6)новое направление в лечении Б А — применение антагонистов лейкотриеновых рецепторов — препарата аколата (зафирулакста) по 20 мг внутрь 2 раза в день;
7)физиотерапевтические методы воздействия (массаж грудной клетки, специальный комплекс дыхательной гимнастики). Иглорефлексотерапия оказывает благоприятный эффект в ком плексной терапии БА.
10.Астматический статус: причины, клиническая картина, объем
неотложных мероприятий.
Астматический статус – не купирующийся приступ бронхиальной астмы длительностью 6 часов и более с развитием резистентности к симпатомиметическим препаратам, нарушением дренажной функции бронхов и возникновением гипоксемии и гиперкапнии
А с т м а т и ч е с к и й с т а т у с . Факторы, предрасполагающие к его развитию, почти всегда являются результатом неадекватной терапии. Чаще всего причинами его служат:
1) бесконтрольный прием симпатомиметических и кортикостероид-ных препаратов;
2)резкое прерывание длительно проводимой кортикостероидной те рапии;
3)обострение хронического или возникновение острого воспалитель ного процесса в бронхолегочном аппарате неэффективно леченного;
4)неудачно проведенная специфическая гипосенсибилизация;
5)злоупотребление снотворными и седативными средствами.
Критерии астматического (метаболического) статуса:
1) прогрессирующее нарушение дренажной функции бронхов;
2) развернутая клиническая картина удушья, которая может ослож няться легочной обструкцией, гипоксемической комой, острым легочным
сердцем; 3) резистентность к симпатомиметическим и бронхолитическим пре
паратам; 4)гиперкапния; 5) гипоксия тканей.
Жалобы:
·многочасовое, а иногда и продолжающееся более суток удушье с прекращением выделения мокроты;
·выраженная слабость;
·страх смерти;
·отсутствие бронхорасширяющего эффекта или даже усиление бронхоспазма
(«синдром рикошета») в условиях многократного (до 15-20 раз в сутки) использования ингаляций симпатомиметиков и приема препаратов пуринового рядов;
Классификация: [1].
По форме астматического состояния:
·Анафилактическая форма (немедленно развивающийся форма АС) характеризуется превалированием неиммунологических или псевдоаллергических реакции с высвобождением большого количества медиаторов аллергических реакций. При этой форме гипоксия может прогрессивно нарастать и поэтому все клинические проявления развиваются интенсивно и бурно, быстро сменяя друг друга. Возникновению коматозного состояния предшествует острый и тяжелейший приступ удушья.
·Метаболическая форма (медленно развивающийся форма АС) – ведущее место занимает функциональная блокада β-адренергических рецепторов. Эта форма астматического состояния формируется исподволь, иногда в течение нескольких дней и даже недель. Больные могут сохранять в определенном объеме двигательную активность (передвижение по комнате, туалет), однако она затруднена и всегда сопровождается резкой одышкой и ухудшением общего состояния.
По степени тяжести выделены стадии АС:
I стадия – стадия относительной компенсации:
·длительный, некупируемый приступ бронхиальной астмы, резистентный к терапии симпатомиметиками и другими бронходилятаторами.
Выявляют следующие клинические симптомы и синдромы:
·тахипноэ с частотой дыханий 30 и выше в минуту с резко выраженным затруднением вдоха и выдоха, дистанционными хрипами;
·вынужденное сидячее положение больного с фиксированным верхним плечевым поясом, участие вспомогательных мышц;
·распространенный цианоз кожи и слизистых оболочек;
·перкуторно-коробочный звук;
·аускультативно в нижних отделах выслушивается резко ослабленное везикулярное дыхание, а верхних отделах
·с жестким оттенком, рассеянные сухие хрипы;
·тахикардия умеренная;
·артериальное давление нормальное или повышенное;
·на ЭКГ - признаки перегрузки правого предсердия и правого желудочка;
·продолжающаяся гипервентиляция приводит к увеличению вязкости мокроты, которая полностью обтурирует просвет бронхов, и приводит к возрастанию гиперкапнии и гипоксемии.
II стадия – стадия декомпенсации или «немого» легкого:
·несоответствие между выраженностью дистанционных хрипов и их отсутствием при аускультации легких («немое легкое»);
·это тяжелые больные, которым очень трудно говорить, каждое движения сопровождается резким ухудшением общего состояния;
·больные обычно сидят, опираясь руками о край кровати;
·сознание сохранено, но иногда наступает возбуждение, сменяющееся апатией;
·кожные покровы влажные, вследствие обильного потоотделения, диффузный цианоз;
·грудная клетка эмфизематозно вздута, экскурсия её почти не заметно, легочный звук коробочный;
·дыхание ослаблено, хрипы выслушиваются лишь в верхних отделах, местами дыхательные шумы вообще не прослушиваются, вследствие полной обтурации бронхов («немого легкого»);
·парадоксальный пульс – снижение наполнения пульса на вдохе (pulsus paradozus) число сердечных сокращений превышает 120 в минуту;
·на ЭКГ перегрузки правых отделов сердца, возможны аритмии;
·артериальное давление повышено;
·нарастание болей в правом подреберье из-за растяжения фиброзной капсулы печени;
·изменяется газовый состав артериальной крови – выраженная гипоксия (Ро 5060 мм.рт.ст.) и гиперкапния (Рсо2 50-70 мм.рт.ст.) формируется респираторный или смешанный тип ацидоза.
III стадия – стадия гипоксической гиперкапнической комы.
Если разрешение синдрома «немого легкого» не наступает, то появляется гипоксическое возбуждение, активный отказ от внутривенных введений:
·состояние больных крайне тяжелое, преобладают нервно – психические нарушения, потере сознания могут предшествовать судороги;
·дыхание аритмичное, редкое, поверхностное;
·серый диффузный цианоз, потливость, слюнотечение;
·нитевидный пульс, гипотония, коллапс;
·в артериальной крови – гипоксемия (РО2 40-50 мм.рт.ст.), высокая гиперкапния (РСО2 80-90 мм.рт.ст.). Значительно выражены вентиляционные нарушения. Происходит сдвиг кислотно-основного состояния в сторону метаболического алкалоза, а при нарастании тяжести астматического состояния развивается метаболический ацидоз;
·снижение объема циркулирующей крови и внеклеточной жидкости (признак дегидратации). Дегидратация, а также хронически существующая гипоксемия приводят к сгущению крови и увеличению гематокрита. Характерная для астматического состояния гиповолемия с уменьшением внутрисосудистого объема предрасполагает к циркуляторному коллапсу, что в свою очередь, усугубляет астматическое состояние. У некоторых больных повышается секреция антидиуретического гормона, формируются гиперволемия, гипернатриемия. Увеличивается количество жидкости в легких, что ведет к дальнейшей обструкции мелких бронхов и ухудшает газообмен. Этим изменениям способствует значительное снижение функции надпочечников.
Тактика лечения
При анафилактической форме:
·0,3-0,5мл 0,18 % раствора эпинефрина на 0,9 % растворе хлорида натрия внутривенно;
·увлажненный кислород через маску;
·внутривенное введение кортикостероидов: глюкокортикоидные гормоны – преднизолон (В) внутривенно суточная доза: 500 – 1200 мг с последующим
уменьшением до 300 мг и переходом на поддерживающие дозы;
·ингаляционное введение β2-адреномиметиков – сальбутамол (А) в/в первоначально 10 мкг/мин, скорость постепенно увеличивается в соответствии с ответом, с интервалом в 10 минут. Максимальная скорость введения 45 мкг/мин до 48 часов.
·аминофиллин (В) вводят медленно по 240 – 480 мг (10-20 мл 2,4% раствора), которые предварительно разводят в 10-20 мл изотонического раствора натрия хлорида. Максимальная разовая доза для взрослых – 250 мг; суточная – 200 мг;
·инфузионная терапия, с целью восполнения дефицита жидкости, устранения гемоконцентрации, разжижение бронхиального содержимого – внутривенно вводят 0,9% раствор хлорида натрия (В) средняя доза 1000 мл в сутки в качестве внутривенной продолжительной капельной инфузии при скорости введения 540 мл/час (до 180 капель/минуту). При больших потерях жидкости и выраженной интоксикации возможно введение до 3000 мл в сутки. Длительное введение больших доз изотонического раствора натрия хлорида необходимо проводить под контролем лабораторных исследований. 5% раствор глюкозы (В) внутривенно капельно со скоростью 7 мл/мин (150 капель/мин), максимальная суточная доза 2000 мл.
·при прогрессирующем нарушений легочной вентиляции показана искусственная вентиляция легких (ИВЛ).
При коматозном состоянии:
·срочная интубация трахеи при спонтанном дыхании;
·искусственная вентиляция легких;
·при необходимости - сердечно-легочная реанимация.
Гемолитические заболевания
1.Анемии: классификация. Методы диагностики гематологических заболеваний).
АНЕМИИ
Анемия — состояние, характеризующееся уменьшением гемоглобина в единице объема крови за счет снижения его общего количества в организме. В большинстве случаев анемия сопровождается и снижением концентрации эритроцитов в единице объема крови, за исключением отдельных видов анемии (железодефицитная анемия, талассемия). От истинной анемии следует отличать гидремию — разжижение крови за счет тканевой жидкости.
Поскольку в основе развития анемий лежат различные патологические процессы, с патогенетической точки зрения предложено разделять все анемии на следующие группы.
•Анемии, обусловленные нарушением синтеза гемоглобина: - железодефицитная анемия (нарушение синтеза гема);
- сидероахрестическая анемия (нарушение синтеза порфирина); - анемия хронических заболеваний.
•Анемии вследствие нарушения образования и созревания эритроцитов (дисэритропоэтические анемии):
- В12-дефицитная анемия; - фолиеводефицитная анемия.
•Анемии, обусловленные нарушениями пролиферации клеток костного мозга (гипопролиферативные анемии):
- идиопатическая гипопластическая (апластическая) анемия; - вторичная гипопластическая (апластическая) анемия (вследствие действия лекарственных средств, токсинов, ионизирующей радиации и др.); - миелофиброз (первичный или вторичный);
- замещение клеток костного мозга опухолевыми клетками (миелофтизис);
- миелодисплазия.
•Анемии вследствие усиленного разрушения эритроцитов (гемолитические анемии): - аутоиммунные гемолитические анемии; - наследственная микросфероцитарная гемолитическая анемия (болезнь МинковскогоШоффара); - талассемия;
- пароксизмальная ночная гемоглобинурия.
•Анемии вследствие дефицита эритропоэтина.
•Анемии со смешанным механизмом развития.
Согласно классификации ВОЗ, в зависимости от тяжести выделяют:
•анемии легкой степени тяжести (концентрация гемоглобина не ниже 90 г/л);
•анемии средней степени тяжести (концентрация гемоглобина в пределах 90-70 г/л);
•анемии выраженной степени тяжести или тяжелые (концентрация гемоглобина менее 70 г/л).
Взависимости от насыщения эритроцитов гемоглобином все анемии можно разделить:
• на нормохромные (цветовой показатель от 0,8 до 1,1 либо МСН от 30 до 36 г/дл);
• гипохромные (цветовой показатель менее 0,8 либо МСН ниже 30 г/дл);
• гиперхромные (цветовой показатель выше 1,1 либо МСН превышает 36 г/дл).
Взависимости от величины среднего объема эритроцитов, все анемии можно разделить:
• на нормоцитарные (средний объем эритроцитов от 80 до 100 мкм3);
• микроцитарные (средний объем эритроцитов менее 80 мкм3);
• макроцитарные (средний объем эритроцитов более 100 мкм3).
Проявления анемий чрезвычайно разнообразны и определяются: 1) патогенетическим вариантом анемии; 2) этиологией; 3) изменениями в организме, обусловленными реакцией организма на гипоксию тканей, вызванную нарушением дыхательной функции крови (доставка кислорода тканям) — циркуляторно-гипоксическим синдромом. Этот синдром проявляется слабостью, повышенной утомляемостью, одышкой при физической нагрузке, сердцебиениями, «анемическим» шумом в крупных сосудах, увеличением объема циркулирующей крови, ускорением кровотока. Цир-куляторно-гипоксический синдром наблюдается в большей или меньшей степени при всех видах анемических состояний; выраженность его зависит от степени гипоксии тканей, что в свою очередь определяется кислородной емкостью крови (иначе говоря, выраженностью анемического состояния).
ДИАГНОСТИКА
Расширенный клинический анализ крови, который дает возможность проведения тщательной оценки формы и размеров элементов крови, выявить наличие аномальных клеток и определить удельный вес патологических клеток крови;
Выявление патологических видов гемоглобина используется для диагностики наследственных гемолитических анемий и гемоглобинопатий, а также с целью объективной оценки тяжести течения таких заболеваний и определения прогноза;
Выявление патологии строения эритроцитарной мембраныпозволяет диагностировать наследственные заболевания, которые сопровождаются нарушением строения и формы мембраны эритроцитов;
Анализ обмена железа выполняется для диагностики анемий, а также при подозрении на наличие наследственных дефектов в обмене железа. Анализ позволяет оценить объем запасов железа в организме, определить причины анемий, а также возможный риск перегрузки тканей излишком железа вследствие частого переливания крови или наследственного гемохроматоза;
Электрофорез белков сыворотки крови, который проводится для диагностики опухолей лимфатической системы (например, плазмоцитомы), клетки которых продуцируют патологические белки – парапротеины;
Ультразвуковое исследовании (УЗИ) органов брюшной полости, проведение которого дает возможность определить с высокой точностью многие показатели: размеры и структуру печени и селезенки, наличие увеличенных лимфатических узлов в брюшной полости, свободной жидкости, а также визуализировать камни в желчном пузыре, образование которых часто наблюдается при гемолитических анемиях;
Ультразвуковое исследование периферических лимфатических узлов. Очень важно объективно оценить размеры и структуру увеличенных лимфатических узлов,
которые может обнаружить гематолог при широком круге заболеваний, так как это позволит следить за динамикой патологического процесса на фоне лечения.
Рентгенография органов грудной клетки. Проводится для оценки состояния органов средостения, диагностики увеличения тимуса и лимфатических узлов, наличия патологического процесса в ткани легкого.
Сцинтиграфия костей скелета. Проводится для обнаружения очагов патологического накопления диагностического вещества.
Компьютерная и магнитно-резонансная томография. Помогает обнаружить увеличенные лимфатические узлы и патологические очаги, не доступные другим методам визуализации, например, локализованные внутри или около позвоночного столба, в черепе и др.
Генетические тесты. Проводятся для подтверждения наследственного характера заболевания и точной верификации диагноза. Могут быть полезны для прогностической и предимплатационной диагностики. Материал для исследования: наиболее часто кровь из вены, но может проводиться на биоптате тканей и околоплодной жидкости.
Пункционная биопсия костного мозга и подсчет миелограммы. Выполняется для точной диагностики многих патологических процессов, нарушающих течение гемопоэза. Является исследованием первой линии при цитопенических состояниях, подозрении на лейкоз и другие опухоли системы крови.
Трепанобиопсия и гистологическое исследование костного мозга. Выполняется из гребня подвздошной кости специальной иглой, позволяющей получить маленький кусочек костной ткани с костным мозгом. Проводится под местной или общей анестезией. Необходимое исследование при широком спектре заболеваний системы крови и лимфатических опухолей.
Биопсия и гистологическое исследование лимфатического узла. Проводится при подозрении на опухолевое поражение лимфатических узлов. Предпочтение отдается открытой биопсии, при которой удаляется целый лимфатический узел через разрез кожи. Этот вид биопсии позволяет получить достаточное количество материала для гистологического исследования, что
делает диагноз высоко достоверным. Однако возможна и пункционная биопсия, когда клетки лимфатического узла насасывают при помощи шприца через прокол тканей.
Иммунофенотипирование лимфоцитов периферической крови и тканей. Метод диагностики, позволяющей точно идентифицировать клетки лимфоидной
природы, циркулирующие в крови или составляющие ткань лимфатического узла. Применяется для разграничения реактивных и опухолевых состояний, а также для постановки точного диагноза при различных лимфопролиферациях.
2.Хронические железодефицитные анемии: этиология, клиника, диагностика, лечение.
ЖДА — полиэтиологичное заболевание, возникновение которого связано с дефицитом железа в организме из-за нарушения его поступления, усвоения или повышенных потерь, характеризующееся микроцитозом и гипохромной анемией.
Этиология. Выделяют основные причины дефицита железа:
•Кровотечения: а) маточные (дисфункция яичников, фибромиома матки, рак шейки матки, эндометриоз и др.); б) желудочно-кишеч ные (язвенная болезнь, геморрой, рак, диафрагмальная грыжа, не специфический язвенный колит, полипоз); в) легочные (рак, бронхоэктазы, изолированный легочный гемосидероз).
•Повышенный расход железа: а) беременность, лактация; б) период роста и полового созревания; в) хронические инфекции, опухоли.
•Нарушение всасывания железа: а) резекция желудка; б) энтерит, спру.
•Нарушение транспорта железа.
•Врожденный дефицит железа (этот механизм возможен при ЖДА у матери во время беременности).
Патогенез. ЖДА возникает прежде всего в результате нарушения синтеза гемоглобина, так как железо входит в состав гема. Недостаточное образование гемоглобина служит причиной гипоксии тканей и развития циркуляторно-гипоксического синдрома. Дефицит железа способствует также нарушению синтеза тканевых ферментов, что приводит к изменению тканевого метаболизма. При этом прежде всего поражаются быстро обновляющиеся эпителиальные ткани — слизистая оболочка пищеварительного тракта, кожа и ее дериваты. Патогенез ЖДА представлен на схеме 25.
Клиническая картина. Проявление болезни, как это вытекает из схемы патогенеза, складывается из следующих синдромов:
1)циркуляторно-гипоксического (при достаточной выраженности анемии и кислородного голодания тканей);
2)поражения эпителиальных тканей (гастроэнтерологические рас стройства, трофические нарушения кожи и ее дериватов);
3)гематологического (анемия гипохромного типа и признаки дефици та железа).
Кроме этих синдромов, клиническая картина определяется также заболеванием, на основе которого развилась ЖДА (например, язвенная болезнь желудка или двенадцатиперстной кишки с повторными кровотечениями, мено- и метроррагии, какая-либо хроническая инфекция и пр.). Имеет значение стадия течения:
1)скрытого дефицита железа, проявляющегося снижением уровня сывороточного железа при отсутствии уменьшения содержания гемогло бина;
2)тканевый сидеропенический синдром (проявляется гастроэнтеро логическими расстройствами, трофическими изменениями кожи и ее дери ватов);
3)анемия (снижение уровня гемоглобина).
Клиническая картина ЖДА включает сочетание сидеропенического и анемического синдромов.
Сидеропенический синдром обусловлен снижением активности ферментов, содержащих железо. Его основными проявлениями являются:
изменения кожи (пигментации цвета кофе с молоком) и слизистых оболочек (заеды в углу рта);изменения ногтей (ломкость, мягкость, поперечная исчерченность, вогнутость);
изменения волос (ломкость, тусклость, раздваивание кончиков, алопеция);гипотония (мышечная, артериальная);изменения обоняния (пристрастие к запахам лака, красок, ацетона, выхлопных газов автомобиля);
изменения вкуса (пристрастие к мелу, глине, сырым продуктам).
Считается, что наличие большого количества симптомов (4 и более) является клиническим подтверждением дефицита железа. Анемический синдром обусловлен развитием анемической гипоксии. Его клинические проявления включают:
слабость, головную боль, головокружение;плохую переносимость физических нагрузок;
снижение аппетита;
снижение работоспособности, внимания, обучаемости;
бледность кожных покровов и видимых слизистых оболочек;
тахикардию, систолический шум.
В общем анализе крови, выполненном «ручным» методом, ориентируются на снижение концентрации гемоглобина — Hb (менее 110 г/л), снижение гематокрита (Ht), небольшое снижение количества эритроцитов (менее 3,8 × 1012/л), снижение цветового показателя — ЦП (менее 0,85), увеличение скорости оседания эритроцитов (более 10—12 мм/ч), несколько сниженное или нормальное количество ретикулоцитов (норма 1—2%). Дополнительно врачлаборант описывает морфологические изменения эритроцитов — анизоцитоз и пойкилоцитоз. ЖДА — это микроцитарная, гипохромная, нормоили реже гипорегенераторная анемия. Изменяются показатели обмена железа:
снижается содержание свободного железа в сыворотке крови и насыщение трансферрина железом;
повышается ОЖСС (общая железосвязывающая способность сыворотки — общий трансферрин).. Для изучения резервов железа в организме применяется десфераловая проба. В норме взрослый человек теряет 0,6—1,3 мг железа с мочой после введения 500 мг десферала; при ЖДА содержание железа в моче после введения десферала значительно ниже (0,2 — 0,4 мг), что указывает на снижение запасов железа в организме. Десферал — продукт метаболизма актиномицетов, способный связывать железо. Известное представление о снижении запасов железа в организме можно получить, изучая всасывание радиоактивного железа. При ЖДА всасывание радиоактивного железа повышается.
Вбиохимическом анализе крови ориентируются на снижение концентрации сывороточного железа — СЖ (менее 12,5 мкмоль/л), повышение общей железосвязывающей способности сыворотки — ОЖСС (более 69 мкмоль/л), снижение коэффициента насыщения трансферрина железом — НТЖ (менее 17%), снижение концентрации сывороточного ферритина — СФ (менее 30 нг/мл или мкг/л). В последние годы появилась возможность определения растворимых трансферриновых рецепторов (рТФР), концентрация которых в условиях дефицита железа увеличивается (более 2,9 мкг/мл).
Вкостном мозге при ЖДА отмечается уменьшение количества сиде-робластов —
эритрокариоцитов, содержащих железо (как известно, в норме 20 — 40 % эритрокариоцитов костного мозга содержат единичные гранулы железа). В ряде случаев гранулы выявить не удается.
При исследовании пищеварительного тракта достаточно часто выявляют снижение желудочной секреции (базальной и стимулированной), а также атрофические изменения слизистой оболочки пищевода и желудка.
При выраженном гипоксически-циркуляторном синдроме могут наблюдаться признаки поражения миокарда (миокардиодистрофия вследствие анемии) в виде умеренного расширения сердца (определяется при рентгенологическом исследовании) и изменений конечной части ЭКГ (снижение амплитуды или негативизации зубцов Т, преимущественно в грудных отведениях).
Критериями дефицита железа и анемии являются: гемоглобин ниже 120 г/л у мужчин и ниже 116 г/л у женщин, снижение цветового показателя (ниже 0,86), среднего содержания гемоглобина в эритроцитах (24 пг), средней концентрации гемоглобина в эритроцитах (ниже 30 %), повышение количества микроцитов (эритроцитов диаметром менее 6 мкм) более 20 %, снижение сывороточного железа — менее 11,6 мкмоль/л; повышение свободного трансферрина — более 35,8 мкмоль/л и общего трансферрина (ОЖСС) — более 71,6 мкмоль/л; снижение насыщения трансферрина железом (менее 25 %); повышение всасывания радиоактивности железа; положительная десфераловая проба (уменьшение содержания железа в моче после введения десферала).
Лечение.
К основным принципам лечения железодефицитной анемии препаратами Fe для перорального приема относятся:
назначение препаратов Fe с достаточным содержанием в них двухвалентного Fe2+ (200–300 мг/сутки);
при использовании новых форм следует ориентироваться на среднетерапевтическую дозу;
назначение препаратов Fe совместно с веществами, усиливающими их всасывание (аскорбиновая и янтарная кислота);
избегать одновременного приема веществ, уменьшающих всасывание Fe (антациды, танин, оксалаты);
использовать препараты, не содержащие витаминные компоненты (особенно В6, В12);
удобный режим дозирования (1–2 раза/сутки);
хорошая биодоступность, всасываемость, переносимость препаратов Fe;
достаточная продолжительность терапии не менее 6–8 недель до нормализации уровня гемоглобина;
продолжить прием в половинной дозе еще в течение 4–6 недель после нормализации уровня гемоглобина;
целесообразно назначать короткие ежемесячные курсы терапии (3–5 дней) в среднетерапевтической дозе женщинам с полименоррагиями.
Критерий эффективности лечения препаратами железа — прирост ретикулоцитов (ретикулоцитарный криз) в 3–5 раз на 7–10-й день от начала терапии (при однократном контроле регистрируют не всегда).
3.В12-фолиево-дефицитная анемия (этиология, патогенез, клиника, диагностика, лечение.
Сущность В12-дефицитной анемии (В12ДА) состоит в нарушении образования ДНК и РНК в связи с нехваткой в организме витамина В12 (цианокобаламина), что приводит к нарушению кроветворения, появлению в костном мозге мегалобластов, внутрикостномозговому разрушению эритрокариоцитов, снижению количества эритроцитов и гемоглобина, лейкопении, нейтропении и тромбоцитопении, а также к изменениям в ряде органов и систем (ЖКТ, ЦНС).
Этиология.
1)нарушением секреции гастромукопротеина («внутренний фактор») при наследственно обусловленной атрофии желез желудка (пернициозная анемия, или болезнь Аддисона — Бирмера), при органических заболева ниях желудка (полипоз, рак), после гастрэктомии;
2)повышением расхода витамина Bi2 (инвазия широкого лентеца, ак тивация кишечной микрофлоры при дивертикулезах тонкой кишки);
3)нарушением всасывания витамина Bi2 (органические заболевания кишечника — спру, илеит, рак, состояние после резекции кишки, наслед ственное нарушение всасывания — болезнь Имерслунд—Гресбека);
4)нарушением транспорта витамина Вп (дефицит транскобаламина);
5)образованием антител к «внутреннему фактору» или комплексу
«внутренний фактор» + витамин В12-
Сходную с В12ДА гиперхромную анемию вызывает дефицит фолиевой кислоты, который возникает при: 1) повышенном расходе (беременность); 2) вскармливании детей козьим молоком; 3) нарушении всасывания (органические заболевания кишечника, алкоголизм); 4) приеме некоторых лекарственных препаратов (противосудорожные, противотуберкулезные препараты, фенобарбитал, контрацептивы и др.).
Патогенез. Витамин B12 состоит из двух коферментов - метилкобаламина и дезоксиаденозилкобаламина. Дефицит первого кофермента обусловливает нарушение синтеза ДНК, вследствие чего нарушается деление и созревание клеток красного ряда и происходит их избыточный рост без утраты ядра. Большие клетки, содержащие ядра, называют мегалобластами. Они не созревают до мегалоцитов (гигантские эритроциты без ядер) и легко гемолизируются, еще находясь в костном мозге. Дефицит витамина B12 вызывает нарушение роста клеток лейкоцитарного и тромбоцитарного ряда, но это не так заметно сказывается на их морфологии и количестве клеток, как нарушения эритропоэза.
При недостатке второго кофермента нарушается обмен жирных кислот, вследствие чего в организме происходит накопление токсичных продуктов - пропионовой и метилмалоновой кислоты: развивается поражение заднебоковых канатиков спинного мозга - фуникулярный миелоз.
Клиническая картина. Клиническая картина В12ДА, как это вытекает из схемы патогенеза, складывается из следующих синдромов:
•циркуляторно-гипоксического (при достаточной выраженности анемии и кислородного голодания тканей);
•гастроэнтерологического;
•неврологического;
•гематологического (анемия гиперхромного типа).
Кроме этих синдромов, клиническую картину также определяет заболевание, на основе которого развилась В12ДА.
Для В12-дефицитной анемии характерна триада: поражение крови; поражение ЖКТ; поражение нервной системы.
Анемия проявляется слабостью, быстрой утомляемостью, одышкой, сердцебиением. В результате повышенного разрушения эритроидных клеток (неэффективный эритропоэз) развивается умеренная желтуха за счет непрямого билирубина. Поражение ЖКТ проявляется анорексией, глосситом, «лакированным» языком. Выявляется снижение желудочной секреции, атрофический гастрит. В результате поражения периферической нервной системы (фуникулярный миелоз) появляются атаксия, парестезии, гипорефлексия, рефлекс Бабинского, в тяжелых случаях клонус и кома. У детей раннего возраста развиваются гипотрофия, отставание в росте, раздражительность, хроническая диарея, склонность к инфекциям.
Лабораторная диагностика Для фолиеводефицитной анемии характерны:
гиперхромия, макроцитоз*
низкий уровень ретикулоцитов**
высокий уровень сывороточного железа
высокий уровень ферритина
умеренное повышение непрямого билирубина
низкий уровень фолиевой кислоты (норма более 3 нг/мл)
нормальный уровень витамина В12 в крови
картина мегалобластического кроветворения в костном мозге***
*При сочетании дефицита железа и фолиевой кислоты могут наблюдаться сочетания лабораторных признаков, что приводит к неопределенной картине и затруднению диагностики; в этом случае надо ориентироваться на клинические симптомы и анамнез.
**Высокий ретикулоцитоз может являться признаком продолжающегося кровотечения, гемолиза, а также наблюдается при фолиеводефицитной анемии через неделю после назначения фолиевой кислоты.
Для выявления причины анемии следует проводить рентгенологическое и эндоскопическое исследование пищеварительного тракта (опухоль желудка, дивертикулез тонкой кишки), гельминтологическое исследование (инвазия широким лентецом), функциональное исследование печени с биопсией (хронический гепатит, цирроз), исследование нейтрального жира в кишечнике (спру).
В12ДА следует дифференцировать от фолиеводефицитной анемии. При дефиците фолиевой кислоты наблюдается макроцитарная гиперхром-ная анемия, а в костном мозге могут обнаруживаться мегалобласты. Следует отметить, что дефицит фолиевой кислоты встречается значительно реже. В отличие от В12ДА при фолиеводефицитной анемии содержание фолиевой кислоты в сыворотке, а также в эритроцитах снижено. Кроме того, при окраске препарата костного мозга ализарином красным окрашиваются только мегалобласты, связанные с дефицитом В^, и не окрашиваются мегалобласты, связанные с дефицитом фолиевой кислоты.
Лечение.
Витамин В12 назначается в дозе 5 мг/кг в день детям в возрасте до одного года, 100—200 мкг в день детям после года, 200—400 мкг в день подросткам. Курс лечения составляет 4 нед, Поддерживающая терапия: еженедельное введение препарата в той же дозе в течение 2 мес, затем последующие 6 мес препарат вводится 2 раза в месяц. При невозможности устранить причину развития анемии противорецидивные курсы лечения витамином В12 проводятся ежегодно, на один курс 10—15 инъекций. Как правило, пациенты не нуждаются в переливании эритроцитной массы. Показания к переливанию эритроцитной массы возникают при снижении уровня гемоглобина ниже 50 г/л, тяжелых инфекциях, сердечно-сосудистых нарушениях. У отдельных пациентов на фоне лечения витамином В12 и активизации эритропоэза может проявиться дефицит железа, который препятствует полной нормализации показателей крови и требует стандартного лечения препаратами железа. Пероральный прием эффективен даже в случае мальабсорбции, однако в этом случае дозу следует увеличить до 5-15 мг/сутки.
Комплекс лечебных мероприятий при В12ДА следует проводить с учетом этиологии, выраженности анемии и наличия неврологических нарушений. При лечении следует ориентироваться на следующие положения:
•Непременным условием лечения В12ДА при глистной инвазии явля ется дегельминтизация (для изгнания широкого лентеца назначают фенасал по определенной схеме или экстракт мужского папоротни ка).
•При органических заболеваниях кишечника и поносах следует при менять ферментные препараты (панзинорм, фестал, панкреатин), а также закрепляющие средства (карбонат кальция в сочетании с дерматолом).
•Нормализация кишечной флоры достигается приемом ферментных препаратов (панзинорм, фестал, панкреатин), а также подбором диеты, способствующей ликвидации синдромов гнилостной или бродильной диспепсии.
•Сбалансированное питание с достаточным содержанием витаминов белка, безусловным запрещением алкоголя — непременное условие лечения Bir и фолиеводефицитной анемии.
•Патогенетическая терапия осуществляется с помощью парентерального введения витамина Bi2 (ликвидация его дефицита), а также нормализации измененных показателей центральной гемодинамики и нейтрализации антител к гастромукопротеину («внутреннему фактору») или комплексу гастромукопротеин + витамин В^ (корти-костероидная терапия). Цианкобаламин (витамин Вп) вводят ежедневно внутримышечно в дозе 200 — 500 мкг 1 раз в день в течение 4 — 6 нед до наступления гематологической ремиссии. Критериями гематологической реакции являются резкое увеличение количества ретикулоцитов в периферической крови — ретикулоцитарный криз, трансформации мегалобластического кроветворения в нормобластическое. Появление ретикулоцитарного криза на 5 —б-й день лечения является ранним критерием эффективности его. В процессе лечения цианкобаламином количество эритроцитов нарастает быстрее, чем содержание гемоглобина, в связи с этим цветовой показатель обычно снижается. После нормализации костномозгового кроветворения и состава крови (обычно через 1,5 — 2 мес) витамин вводят 1 раз в неделю в течение 2 — 3 мес, затем в течение полугода 2 раза в месяц в тех же дозах, что и в начале курса). В дальнейшем больных ставят на диспансерный учет; профилактически им вводят витамин Bi2 1 — 2 раза в год короткими курсами по 5 — 6 инъекций или ежемесячно по 200 — 500 мкг (пожизненно).
При симптомах фуникулярного миелоза витамин Вп вводят в значительных дозах — 500 — 1000 мкг ежедневно в течение 10 дней, а затем 1—3 раза в неделю до исчезновения неврологической симптоматики.
4.Гипо- и апластические анемии: этиология, клиника, диагностика, лечение.
Апластическая анемия — заболевание системы крови, характеризующееся глубокой панцитопенией, развивающейся в результате угнетения костномозгового кроветворения.
Этиология.
К резкому угнетению костномозгового кроветворения приводят различные причины:
•внешние факторы, оказывающие миелотоксическое действие (инфекционные заболевания, ионизирующая радиация, цитостатические препараты и другие лекарственные средства, различные химические вещества);
•внутренние (эндогенные) причины (влияние токсических веществ при уремии, гипотиреозе и др.);
•аутоагрессия и образование антител к кроветворным клеткам;
• идиопатические формы, когда не удается обнаружить никаких причин развития анемии (у 50% больных)..
Патогенез.
Механизм развития гипоплазии (аплазии) костного мозга окончательно не выяснен. Предполагают несколько механизмов развития АА:
•поражение полипотентной стволовой клетки костного мозга;
•подавление кроветворения, связанное с воздействием иммунных механизмов (клеточных, гуморальных);
•нарушения функционирования элементов микроокружения;
•дефицит факторов, стимулирующих кроветворение.
Содержание веществ, непосредственно участвующих в процессе кроветворения (железо, витамин B12, протопорфирин)
Клиническая картина болезни чрезвычайно разнообразна и связана в основном с цитопенией и зависит от степени ее выраженности. Соответственно этому проявления болезни чрезвычайно разнообразны: существуют переходные формы от частичного угнетения кроветворения до выраженной аплазии костного мозга.
Можно выделить три основных синдрома: цитопенический, септико-некротический и геморрагический. Их различная выраженность обусловливает пестроту данных, получаемых на различных этапах диагностического поиска.
Впериферической крови определяется выраженная анемия, обычно нормохромная. Содержание гемоглобина снижается до 20 — 30 г/л. Содержание ретику-лоцитов снижено, что свидетельствует о гипорегенераторном состоянии костного мозга. Характерны выраженные лейкопения, гранулоцитопения. Содержание лимфоцитов не изменено. Число тромбоцитов снижается иногда до нуля. В большинстве случаев значительно увеличивается СОЭ (до 30-50 мм/ч).
Вкостном мозге уменьшено содержание миелокариоцитов, увеличено число лимфоцитов, тучных и плазматических клеток. Мегакариоциты могут полностью отсутствовать. При гистологическом исследовании костного мозга обращает внимание почти полное исчезновение костномозговых элементов и замещение их жировой тканью.
Содержание железа сыворотки у большинства больных увеличено, насыщение трансферрина железом практически 100 %.
Диагностика.
Физикальное обследование
Позволяет заподозрить генетические синдромы, характеризующиеся апластической анемией (анемия Фанкони, врожденный дискератоз), выявить изменения, характерные для острых лейкозов и солидных опухолей, а также оценить степень выраженности геморрагического синдрома и наличие инфекционных поражений, т.е. оценить непосредственную угрозу жизни пациента. Необходимо обратить особое внимание на:
•Аномалии строения лица (треугольное лицо, маленькие глаза, эпикант, мелкие черты лица, микроцефалия) и конечностей (аномалии 1-го пальца кистей, форму tenar, шестипалость, синдактилия, клинодактилия)
•Наличие особенностей пигметация кожи (пятна цвета «кофе с молоком», ретикулярная гиперпигментация, гиперпигментация) Наличие дистрофии ногтей, особенно на пальцах ног
•Цвет и строение волос (преждевременное поседение, поредение, ломкость, тонкость)
•Признаки геморрагического синдрома (кожа, слизистые полости рта, конъюнктива глаз)
•Наличие лейкоплакии слизистых рта
•Слезотечение
• Размеры печени и селезенки
•Степень увеличения, количество, локализация и характеристики лимфатических узлов
• Наличие гипоспадии
Лабораторная диагностика Общий клинический анализ крови: уровень гемоглобина; количество
эритроцитов; количество лейкоцитов; ручной (!) подсчет лейкоцитарной формулы; количество тромбоцитов; ретикулоцитоз
•Морфологическое исследование костного мозга. Аспирация костного мозга выполняется под общей анестезией
•Иммунофенотипирование, цитохимическое, цитогенетическое и молекулярногенетическое исследование клеток костного мозга. Выполняются только при наличии данных морфологического исследования, позволяющих заподозрить острый лейкоз или миелодиспластический синдром.
•Иммунофенотипирование лейкоцитов периферической крови. Является обязательным при повышении уровня лактатдегидрогеназы, билирубина и наличии клинических признаков гемолиза. В этом случае выполняется исследование маркеров синдрома пароксизмальной ночной гемоглобинурии.
•Трепанобиопсия костного мозга. Выполняется из верхнего заднего гребня подвздошной кости под общей анестезией одновременно с пункциями костного мозга. Трепанобиоптат после получения помещается в 4% раствор формалина с буфером.
•Биохимический анализ крови. Обязательно исследуются уровни мочевины, креатинина, общего билирубина и его фракций, АлАТ, АсАТ, ЛДГ, щелочной фосфатазы, глюкозы, К+, Na+, Ca++.
•Определение группы крови и Резус-фактора
•Коагулограмма: фибриноген, АЧТВ, ПИ и МНО
• HLA-типирование пациента, сиблингов и родителей (серологическое или молекулярное)
•Серологическое исследование маркеров гепатитов гепатитов А, С, В, D (при наличии HBsAg).
Неинвазивная инструментальная диагностика:
• Ультразвуковое исследование органов брюшной полости, забрюшинного пространства и малого таза.
• Рентгенография грудной клетки в прямой проекции, при необходимости - отдельных участков скелета
•Компьютерная рентгеновская томография грудной клетки (при наличии кашля, тахипноэ, симптомов бронхообструкции и болей в грудной клетке)
•Электрокардиография
•Эхокардиография
Распознавание болезни основывается на данных цитологического исследования периферической крови и цитоморфологическо-го исследования костного мозга. При подозрении на АА обязательно выполнение трепанобиопсии. Необходимо провести дифференциальную диагностику с рядом заболеваний, протекающих с цитопенией: дебютом острого лейкоза, метастазами рака в костный мозг, костномозговой формой хронического лимфолейкоза. Панцитопения у пожилых людей может быть также проявлением В^-дефицитной анемии (однако при этом в костном мозге обнаруживаются мегалобласты, при патоморфологическом изучении трепаната выявляется гиперплазия костного мозга в противоположность аплазии при АА). Следует подчеркнуть, что диагноз АА является «диагнозом исключения» и устанавливается лишь в случае, если перечисленные причины развития аплазии полностью исключены.
Течение. Согласно международным критериям, принято выделять две основные формы АА. Критериями тяжелой формы являются: содержание нейтрофилов в периферической крови менее 0,5109/л, тромбоцитов — менее 20109/л, ретикулоцитов — менее 10 %о; при исследовании костного мозга отмечается выраженное снижение клеточности или умеренная гипоплазия с количеством гемопоэтических клеток менее 30 %. Если показатели периферической крови соответствуют хотя бы двум критериям, а результаты исследования костного мозга — одному, то можно поставить диагноз тяжелой формы АА. При нетяжелой форме болезни прогноз намного лучше (все перечисленные показатели изменены существенно меньше).
Лечение
Этапы комбинированной иммуносупрессивной терапии больных апластической анемией (рис. 1).
I этап. Антитимоцитарный глобулин ( лошадиный АТГ) назначается на первом этапе лечения ( А-В). Через 2—3 недели от начала курса АТГ (после купирования симптомов сывороточной болезни) начинается терапия циклоспорином А (А-В). Стартовая суточная доза циклоспорина A - 10 мг/кг. Коррекция суточной дозы проводится с учетом индивидуальной переносимости препарата и содержания циклоспорина А в сыворотке крови. II этап. Через 3—6 месяцев от начала иммуносупрессивной терапии при отсутствии положительной клинико-гематологической динамики в программу лечения включается второй курс терапии АТГ (А-В), при нетяжелой АА может быть проведена спленэктомия (С-D).. Терапия циклоспорином А должна быть продолжена.
III этап. Через 6—12 месяцев от начала иммуносупрессивной терапии при рефрактерном течении АА и сохраняющейся зависимости больного от трансфузий донорских эритроцитов и тромбоцитов проводится второй или третий курс АТГ или оперативное вмешательство (спленэктомия), если оно не было выполнено на предшествующих этапах лечения. Курс терапии циклоспорином А у больных апластической анемией продолжается 18—24
месяца и более (не менее 12 месяцев после достижения ремиссии). Лечение рецидива АА проводят по тому же протоколу, по которому проводилась индукция ремиссии (А-В). В лечении рефрактерной АА используются индивидуальные протоколы, включающие повторные курсы АТГ, другие препараты с иммуносупрессивным действием (алемтузумаб, циклофосфан), хелаторную терапию, неродственную ТКМ, спленэктомию.
Лечение АА — непростая задача, она должна включать:
•ликвидацию (или хотя бы ограничение) контакта больного с лица ми, страдающими инфекционными заболеваниями (в том числе и неспецифическими );
•устранение воздействия этиологического фактора (например, лекарственных или химических средств, если доказана связь между их приемом и развитием болезни);
•трансфузионную терапию;
•спленэктомию;
•введение антилимфоцитарного глобулина;
•трансплантацию костного мозга.
Объем перечисленных мероприятий несколько различен при разном течении болезни, однако проведение части из них обязательно для всех больных.
Больного АА, особенно при содержании гранулоцитов менее 0,5-109/л, изолируют в специально выделенную палату с боксом (где медицинский персонал меняет обувь и одежду); кожа больного обрабатывается антисептическим мылом, обязательна санация ротовой полости. Для ликвидации кишечной флоры назначают неадсорбируемые антибиотики. Для уменьшения менструальных кровопотерь на длительный срок рекомендуются препараты, уменьшающие кровопотерю или полностью прекращающие менструации (гормональные комбинированные средства).
При глубокой анемии переливают эритроцитную массу или отмытые эритроциты. При количестве тромбоцитов 20-109/л или при наличии геморрагического синдрома осуществляют трансфузии тромбоцитной массы.
При нетяжелой форме эффективна спленэктомия (селезенка является органом, в котором образуются антитела, участвующие в цитотоксических реакциях). Эффект спленэктомии проявляется не сразу.
При тяжелой форме АА эффективен антилимфоцитарный (антимоно-цитарный) глобулин; препарат вводят внутривенно в течение 5 — 8 дней.
Пятилетняя выживаемость после лечения глобулином составляет 50 — 70 %. Антилимфоцитарный глобулин сочетают с циклоспорином А (сан-диммуном), представляющим собой препарат, воздействующий на функцию лимфоцитов путем подавления образования и секреции лимфокинов (возможно, иммуносупрессорный эффект циклоспорина А обусловливает подавление продукции антител против клеток костного мозга и периферической крови). Циклоспорин А назначают внутривенно, а затем внутрь.
При тяжелой форме АА показана трансплантация костного мозга от HLA-совместимого донора; показания к трансплантации ограничиваются возрастом (не старше 40 лет).
5.Острые лейкозы: классификация, клиника, диагностика, принципы терапии.
Острый лейкоз (ОЛ) — опухолевое заболевание кроветворной системы, при котором субстрат опухоли составляют бластные клетки. Опухолевая трансформация осуществляется на самых ранних этапах дифференцирования стволовой кроветворной клетки и дальнейшего ее созревания не происходит. Термин «острый лейкоз» отражает не временной фактор (длительность течения болезни), а морфологические и цитохимические особенности опухолевых клеток.
Этиология. Этиология заболевания неизвестна. Тем не менее признается существование ряда факторов, способствующих развитию ОЛ: 1) хромосомные аномалии; 2) облучение; 3) токсические влияния вследствие загрязнения внешней среды, лекарственной терапии; 4) предшествующие заболевания системы кроветворения (рефрактерные формы анемий, пароксизмальная ночная гемоглобинурия, так называемые миелодисплазии).
Классификация. Опухолевая трансформация при ОЛ происходит на стадиях дифференцировки родоначальных кроветворных клеток. В связи с этим О Л в первую очередь разделяют на лимфобластные, т.е. относящиеся к клеткам-предшественницам лимфопоэза и составляющие 15 % всех ОЛ, и на нелимфобластные, относящиеся к клеткам-предшественницам миелопоэза и составляющие основную массу О Л у взрослых. Каждая из этих двух больших групп ОЛ неоднородна, и в них выделяют различные формы:
1)острый лимфобластный лейкоз (ОЛЛ):
а) общая форма («ни Т ни В» форма) — до 70 % ОЛЛ; б) Т-форма - до 25 %; в) В-форма — до 3 — 5 %;
2)острый миелобластный лейкоз (ОМЛ) — до 60 %;
3)острый миеломонобластный лейкоз (ОММЛ) — до 20 %;
4)острый монобластный лейкоз (ОМнЛ) — 3 — 7 %;
5)острый промиелоцитарный лейкоз (ОПрЛ) — 2 — 5 %;
6)острый эритромиелоз (ОЭМ) — 2 — 5 %;
7)острый недифференцируемый лейкоз (ОНЛ) — 2 —3 %. В течении ОЛ выделяется несколько стадий:
I. Начальная оценивается чаще всего ретроспективно.
II. Развернутая — с четкими клиническими и гематологическими про явлениями болезни, в ней в свою очередь различают:
1) первую «атаку»; 2) ремиссию (полную или неполную); 3) рецидив болезни; 4) второй рецидив и т.д.
III. Терминальная — отсутствие эффекта от цитостатической тера пии, выраженное угнетение нормального кроветворения, язвенно-некроти ческие процессы.
Клиническая картина. Проявления ОЛ могут быть весьма многообразными, в связи с чем их можно представить в виде следующих «больших» синдромов:
I. Гиперпластический синдром (называемый также синдромом лейке-мической пролиферации), обусловленный опухолевым ростом как в костном мозге, так и вне его (метастазирование):
1)увеличение селезенки, печени, лимфатических узлов (перифери ческие, в средостении, брюшной полости), миндалин;
2)поражения кожи (кожные лейкозные инфильтраты — неспеци фическая гемодермия, или лейкемиды), мозговых оболочек (нейролейкоз, или нейролейкемия), почек, миокарда, легких.
II. Анемический синдром.
III. Геморрагический синдром — от мелкоточечных и мелкопятнис
тых единичных или редких высыпаний на коже и слизистых оболочках до обширных кровоизлияний и профузных кровотечений (носовые, маточ ные, почечные, желудочно-кишечные и пр.).
IV. Интоксикационный синдром — снижение массы тела, лихорадка, поты, выраженная слабость.
У 10 % больных заболевание начинается профузными кровотечениями (носовые, маточные, желудочно-кишечные); некоторые больные впервые обращаются по поводу гиперпластического гингивита и язвенного стоматита. Примерно в 20 % случаев начальная стадия ОЛ проходит мимо внимания врача и самого больного, что обусловлено неспецифическими симптомами, выраженными в весьма незначительной степени. Тем не менее при ретроспективной оценке развития болезни удается установить, что еще до обращения к врачу у больного отмечались нарастающая слабость, повышенная утомляемость, боли в костях, мышцах и суставах, незначительное увеличение лимфатических узлов или единичные кровоизлияния в кожу, на которые больные не обращали внимания, объясняя их мелкими травмами, и лишь при нарастании числа «синяков» обращались к врачу. Боли в костях и суставах иногда носят упорный характер, и такие больные могут находиться под наблюдением врача с диагнозом остеоар-троз, ревматоидный артрит (однако, к сожалению, анализ крови таким больным своевременно не производится).
в развернутой стадии болезни можно обнаружить проявления указанных выше синдромов.
Гиперпластический синдром проявляется: 1) увеличением лимфатических узлов, чаще шейных, с одной или с обеих сторон, плотноватой консистенции, безболезненных (характерно для ОЛЛ); 2) нерезко выраженным увеличением селезенки: плотноватая, безболезненная или слегка чувствительная, выступает из-под реберного края на 3 — 6 см); 3) увеличением печени: плотноватая, чувствительная, пальпируется на 2 — 4 см ниже реберного края.
Эти физикальные данные необязательны при ОЛ и могут наблюдаться при других гемобластозах, лимфомах. Поражение других органов проявляется разнообразными симптомами.
При исследовании периферической крови число лейкоцитов может колебаться от низких цифр до высоких — гиперлейкоцитоз (в настоящее время благодаря современной диагностике установлено, что оно составляет 20 —50109/л, весьма часто (в 50 % случаев) может наблюдаться лейкопения. Основным признаком ОЛ является наличие в крови опухолевых бластных клеток (бластемия). Эти клетки обнаруживаются в мазках крови в количестве от 5— 10 до 80 —90 %. Характерно так называемое лей-кемическое зияние — очень малое количество зрелых гранулоцитов — сегментоядерных и практически полное отсутствие палочкоядерных, юных, метамиелоцитов. При алейкемической фазе болезни бласты в периферической крови единичные или же вообще отсутствуют. В этих случаях диагноз ставят по результатам исследования пунктата костного мозга, при котором обнаруживается значительное повышение содержания бластных клеток (увеличение в стернальном пунктате бластных клеток более 30 % полностью подтверждает диагноз ОЛ).
Обнаружение бластных клеток в пунктатах, а также в спинномозговой и плевральной жидкостях указывает на соответствующее органное поражение и исключает полную ремиссию после проведенной терапии.
Существует ряд правил, которые следует помнить любому врачу, чтобы не пропустить ОЛ. Является обязательным динамическое исследование крови при всех рефрактерных к лечению и рецидивирующих ангинах, респираторных заболеваниях, гриппе, особенно если эти заболевания сопровождаются лимфаденопатией, геморрагическими проявлениями, а
также артралгиями. Особая гематологическая настороженность должна быть при всех случаях лимфаденитов и гиперпластических гингивитов. Назначение таким больным различных физиотерапевтических и тепловых процедур без предварительного исследования крови может принести вред.
Лечение.
При ОЛ руководствуются определенными принципами лечения.
•Его начинают сразу же после постановки диагноза.
•Оно должно быть дифференцированным и зависеть от морфологи ческого и цитохимического типа ОЛ.
•Одновременно назначают несколько препаратов (полихимиотера пия).
•Следует стремиться к достижению лейкопении.
•В стадии ремиссии необходимо проводить поддерживающую тера пию.
Существуют определенные этапы при проведении химиотерапии:
•вызывание ремиссии (индукция) проводится при первой «атаке» О Л и рецидивах болезни;
•закрепление (консолидация) ремиссии — 2 — 3 курса лечения пре паратами, вызвавшими ремиссию (реже — иными);
•противорецидивная терапия (поддерживание ремиссии) проводится в течение всего периода ремиссии;
•профилактика нейролейкемии.
Невыполнение одного из этапов такого программного лечения, необоснованные изменения в схемах химиотерапии приводят к неизбежному развитию рецидива и лишают больного шансов на полное выздоровление. Следует также отчетливо представлять, на основании каких признаков можно говорить о наступлении ремиссии или рецидива.
Ремиссия характеризуется следующими показателями, сохраняющимися на протяжении не менее 1 мес:
▲в костном мозге число бластных клеток не превышает 5 %, пред ставлены все ростки кроветворения с нормальными признаками со зревания, мегакариоциты обнаруживаются, клеточность костного мозга более 20 %;
▲в периферической крови — абсолютное число нейтрофилов не менее 1,5109/л, тромбоцитов не менее 100-109/л, бластные клетки не обнаруживаются;
▲не имеется очагов экстрамедуллярного лейкемического роста (включая отсутствие нейролейкемии).
Рецидив диагностируется при обнаружении в пунктате костного мозга 5 —20 % бластов (повторное обнаружение бластов в костном мозге более 5 % подтверждает рецидив), а также любого экстрамедуллярного лейкемического поражения (даже без вовлечения в патологический процесс костного мозга).
При остром нелимфобластном лейкозе индукция ремиссии проводится с помощью цитозинарабинозида (цитозара) с рубомицином (курс длится 7 дней). Цитозар комбинируют также с митоксантроном; возможно сочетание рубомицина, цитозара и тиогуанина. Индукционная терапия предполагает проведение двух аналогичных курсов полихимиотерапии.
Консолидация ремиссии осуществляется с помощью цитозара в комбинации с другими препаратами (митоксантрон).
Поддерживающая терапия проводится цитозаром и рубомицином. Существуют и другие варианты поддерживающей терапии. На фоне поддерживающей терапии должны проводиться контрольные стернальные пункции (1 раз в 3 мес). Профилактика нейролейкемии осуществляется эндолюмбальным введением цитостатиков (метотрексат, цитозар) в сочетании с преднизолоном. Вместо этого осуществляют также облучение головы.
Инфекционные осложнения ОЛ являются весьма грозными, в связи с чем активная терапия антибиотиками широкого спектра действия должна проводиться своевременно и в достаточных дозах. Профилактикой инфекционных осложнений, особенно у больных с гранулоцитопенией, является тщательный уход за кожей и слизистой оболочкой рта, помещение больных в специальные асептические палаты, стерилизация кишечника с помощью неадсорбируемых антибиотиков (канамицин, неоми-цин).
При развитии геморрагического диатеза необходимо переливание тромбоцитной массы (1 — 2 раза в неделю) или свежей цельной крови.
6.Хронические лейкозы: классификация, клиника, диагностика, лечение.
Cреди хронических лейкозов выделяют миело-пролиферативные и лимфопролиферативные заболевания. К числу хронических миелопролиферативных процессов относят хронический миелолейкоз, эритремию (истинную полицитемию), идиопатический миелофиброз (сублейкемический миелоз), эссенциальную тромбоцитемию (хронический мегакариоцитарный лейкоз, геморрагическая тромбоцитемия).
Хронический миелолейкоз (ХМЛ) — миелопролиферативное хроническое заболевание, при котором наблюдается повышенное образование гранулоцитов (преимущественно нейтрофилов, а также про-миелоцитов, миелоцитов, метамиелоцитов), являющихся субстратом опухоли.
Классификация.
Стадия I — начальная — миелоидная пролиферация костного мозга + небольшие изменения в крови без явлений интоксикации.
Стадия II — развернутая — выраженные клинико-гематологические проявления (интоксикация продуктами распада лейкозных клеток, увеличение печени и селезенки, миелоидная пролиферация костного мозга + изменения в крови).
Стадия III — терминальная (соответствует развитию поликлоновой опухоли) — рефрактерность к проводимой цитостатической терапии, истощение, значительное увеличение селезенки и печени, дистрофические изменения внутренних органов, выраженные изменения крови (анемия, тромбоцитопения).
Клиническая картина. Клинические проявления ХМЛ могут выражаться большими синдромами:
Миелопролиферативный синдром, в основе которого лежит миелоидная пролиферация костного мозга, включает:
а)общие симптомы, вызванные интоксикацией, разрастаниями лейкозных клеток в костном мозге, селезенке и печени (потливость, слабость, снижение массы тела, тяжесть и боль в области селезенки и печени), оссалгии;
б) увеличение печени и селезенки; в) лейкемические инфильтраты в коже;
г) характерные изменения в костном мозге и периферической крови.
Синдром, обусловленный осложнениями:
а) геморрагический диатез (геморрагии и тромбозы вследствие нару шения прокоагулянтного и тромбоцитарного звеньев гемостаза);
б) гнойно-воспалительные (пневмонии, плевриты, бронхиты, гной ные поражения кожи и подкожной жировой клетчатки), обусловленные резким снижением активности иммунитета;
в) мочекислый диатез (гиперурикемия вследствие повышенного рас пада гранулоцитов).
Диагностика. Выявление ХМЛ в развернутой стадии болезни не представляет трудностей и основывается на характерных данных анализа крови, результатах исследования костного мозга, увеличении печени и селезенки.
Диагностическими критериями заболевания являются:
•лейкоцитоз более 20109/л;
•появление в лейкоцитарной формуле пролиферирующих форм (миелобласты и промиелоциты) и созревающих гранулоцитов (миелоциты, метамиелоциты );
•миелоидная пролиферация костного мозга (по данным миелограммы и трепанобиопсии);
•снижение активности щелочной фосфатазы нейтрофилов (менее 25
ед.);
•обнаружениеPh-хромосомы в кроветворных клетках;
•расширение «плацдарма» кроветворения (по данным сцинтиграфии костей);
•увеличение размеров селезенки и печени.
Лечение. Основная задача лечения любого гемобластоза (в том числе и ХМЛ) — ликвидация или подавление роста патологического клона клеток.
• В начальной стадии болезни (при хорошем самочувствии, но несо мненных изменениях в периферической крови и костном мозге) не обходимы общеукрепляющая терапия, правильное питание, соблю дение режима труда и отдыха (очень важно избегать инсоляции).
Больной должен находиться под наблюдением врача; периодически (1 раз в 3 — 6 мес) необходимо исследовать периферическую кровь.
При появлении симптомов прогрессирования болезни необходимо проводить цитостатическую терапию, при этом объем такого лече ния зависит от стадии заболевания.
В развернутой стадии проводится курсовая химиотерапия. Используют тот же препарат, но в больших дозах (ежедневно 2 — 3 приема) под гематологическим контролем: при снижении количества лейкоцитов и тромбоцитов дозу препарата уменьшают, а при содержании лейкоцитов 10 —20109/л и тромбоцитов 100-109/л препарат отменяют. Если ранее эффективные препараты не оказывают действия в течение 3 — 4 нед, то следует провести курс лечения другим цитостатиком. Так, если гид pea оказывается неэффективной, то назначают миелосан (бусульфан, милеран), миелобромол.
•После курсовой химиотерапии проводится поддерживающая тера пия по схеме, близкой к схеме первично-сдерживающей терапии. Применяют препараты, оказавшие терапевтический эффект при курсовой химиотерапии.
•Полихимиотерапия проводится курсами при высокой степени риска, а также в терминальной стадии ХМЛ; при бластном кризе — в объеме, соответствующем терапии при ОЛ. Используют препара ты, оказывающие цитостатическое действие на пролиферирующие элементы (цитозар, метотрексат, циклофосфан, 6-меркаптопурин, противоопухолевый антибиотик — рубомицина гидрохлорид). Курсы полихимиотерапии короткие — 5 —14 дней с перерывами в
7 — 10 дней.
•В настоящее время появились принципиально новые методы лече ния ХМЛ — использование такого цитокина, как альфа-интерфе рон (а-ИФН). Дело в том, что в процессе миелоидной пролифера ции мегакариоциты и тромбоциты выделяют большое количество ростовых факторов, которые сами по себе способствуют дальней шей пролиферации мутантных полипотентных и олигопотентных стволовых клеток, а кроме того, и стромальных клеток. Все это ведет к дальнейшему прогрессированию болезни, а также развитию фиброзных изменений костного мозга. Между тем доказано, что а-ИФН по своему химическому строению и функциональным дей ствиям является антагонистом ростовых факторов. а-ИФН выде ляет субстанции, которые тормозят стимулирующее действие мегакариоцитов на кроветворение и обладают антипролиферативной активностью по отношению к родоначальным клеткам кроветворе ния, так что эти клетки выводятся из пролиферации. а-ИФН также стимулирует противоопухолевый иммунитет. Следовательно, созда ются условия сохранения нормального кроветворения (во всяком случае, его преобладание), при этом а-ИФН не обладает цитостатическим действием, что является весьма привлекательным его свой ством, так как отсутствует депрессивное влияние на нормальные клетки костного мозга.
7.Геморрагические диатезы: классификация, типы кровоточивости.
Геморрагические диатезы (Г Д) — группа врожденных или приобретенных болезней и синдромов, основным клиническим проявлением которых является повышенная кровоточивость
— наклонность к повторным кровотечениям или кровоизлияниям, возникающим спонтанно или после незначительных травм.
Повышенная кровоточивость в клинике внутренних болезней может быть:
1)основным проявлением заболевания (например, тромбоцитопенической пурпуры, гемофилии, синдрома Ослера — Рандю и пр.);
2)синдромом, являющимся частью какого-либо определенного забо левания (например, цирроза печени, системной красной волчанки, инфек ционного эндокардита и пр.);
3)осложнением проводимой терапии (прямые и непрямые антикоагу лянты, фибринолитические препараты).
Выраженность кровоточивости может варьировать в больших пределах — от незначительных кровоизлияний в кожу или слизистые оболочки до массивных кровоизлияний в полость сустава, межмышечные пространства, а также фатальных кровотечений из внутренних органов (кишечник, желудок, матка и пр.).
В развитии кровоточивости принимают участие следующие факторы:
1.Тромбоцитарное звено гемостаза.
2.Плазменное звено гемостаза.
3.Состояние сосудистой стенки.
4.Фибринолитическая активность крови.
При различных ГД ведущая роль какого-либо из перечисленных факторов весьма различна, в ряде случаев главным является какой-либо один
механизм, в то же время может наблюдаться и комбинация тех или иных факторов.
Классификация. В соответствии с ведущим механизмом кровоточивости среди наиболее часто встречающихся ГД выделяют несколько больших групп.
•Тромбоцитопении (снижение количества тромбоцитов) и тромбоцитопатии (нарушение функциональных свойств тромбоцитов).
•Коагулопатии (гемофилии), развивающиеся при:
а) недостаточном количестве прокоагулянтов, участвующих в плаз менном звене гемостаза;
б) недостаточной функциональной активности прокоагулянтов; в) наличии в крови ингибиторов отдельных прокоагулянтов.
• Ангиопатии (вазопатии) — повреждение сосудистой стенки врожденного характера или развивающееся в результате им-
муноаллергического или инфекционно-токсического воздействия.
• Избыточный фибринолиз, возникающий при:
а) лечении тромболитическими препаратами;
б) дефекте ингибитора плазмина или избытке тканевого активатора плазминогена (наследственного происхождения).
• Синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром), представляющий
сочетание нарушений различных компонентов гемостаза (тромбоцитопения, коагулопатия и пр.).
Клиническая картина. Проявления ГД чрезвычайно разнообразны, что зависит от формы и выраженности геморрагического синдрома, вовлечения в патологический процесс различных органов и систем и осложнений. В связи с этим целесообразно клиническую картину ГД представить как сочетание различных видов самой кровоточивости, синдрома поражения органов и систем, неспецифического синдрома, синдрома нарушений гемостаза, выявляемых с помощью лабораторных методов исследования.
В настоящее время выделяют пять типов кровоточивости [Баркаган З.С., 1975], наблюдающихся при различных ГД: 1) гематомный; 2) пят-нисто-петехиальный, или микроциркуляторный; 3) смешанный микроцирку ляторно-гематомный; 4) васкулитно-пурпурный; 5) ангиоматозный.
•При гематомном типе преобладают массивные, глубокие, напряжен ные и весьма болезненные кровоизлияния в крупные суставы, мышцы, в подкожную жировую и забрюшинную клетчатку. Они вызывают расслоение и деструкцию тканей, развитие деформирую щих артрозов, контрактур, патологических переломов, костных псевдоопухолей, атрофию мышц. Наблюдаются профузные спон танные, посттравматические и послеоперационные кровотечения. Характерен почти исключительно для наследственных коагулопа тии (в частности, гемофилии А и В).
•Пятнисто-петехиальный (микроциркуляторный) тип характеризу ется безболезненными ненапряженными, не сдавливающими окру жающие ткани поверхностными кровоизлияниями в кожу и слизис тые оболочки, петехиями, синяками, десневыми, носовыми и маточ-
ными кровотечениями. Кровоизлияния возникают при незначительной травматизации микрососудов — при измерении АД, в местах пальпации, при растирании кожи рукой и т.д. Для данного типа кровоточивости нехарактерно образование гематом, мышцы, суставы и другие части опорно-двигательного аппарата интактны. Кровотечения при полостных оперативных вмешательствах редки и не имеют наклонности к рецидивированию. Этот тип кровоточивости наблюдается при тромбоцитопениях, тромбоцитопатиях.
• Смешанный микроциркуляторно-гематомный тип кровоточивости характеризуется не просто сочетанием признаков двух перечислен ных выше вариантов геморрагического синдрома, но и рядом прису щих только ему качественных особенностей: в клинической картине преобладает петехиально-пятнистая кровоточивость; гематомы не многочисленны, но достигают очень больших размеров, располага ются преимущественно в подкожной жировой или забрюшинной клетчатке; кровоизлияния в суставы редки, не ведут к развитию де формирующих артрозов и атрофии мышц; гематомы в зависимости от локализации могут имитировать картину острого живота, непро ходимости кишечника и острого аппендицита. Наблюдается при наиболее тяжелых формах коагулопатий (гемофилии А), ДВС-син- дроме и передозировке антикоагулянтов.
•Васкулитно-пурпурный тип кровоточивости объединяет все гемор рагии, обусловленные воспалительным процессом в микрососудах. Геморрагии возникают на фоне локальных экссудативно-воспали- тельных явлений и общих иммуноаллергических или инфекционнотоксических нарушений. Геморрагические высыпания на коже, как правило, симметричны (как на конечностях, так и на туловище), несколько приподняты вследствие воспалительной инфильтрации и отека. Часто появлению геморрагии предшествуют зудящие высы пания, имеющие вид небольших уплотнений; эти элементы затем приобретают пурпурный вид из-за пропитывания кровью. Харак терной чертой является длительно сохраняющаяся после исчезнове ния геморрагии бурого цвета сыпь. При других типах кровоточи вости такой остаточной пигментации не бывает. Наблюдается при геморрагическом васкулите.
•Ангиоматозный тип кровоточивости характеризуется отсутствием спонтанных и посттравматических кровоизлияний в кожу, подкож ную жировую клетчатку и в другие ткани и органы, но имеются весьма упорные кровотечения 1 — 2 локализаций (носовые, реже — гематурия, легочные и желудочно-кишечные). Данный тип крово точивости наблюдается при различных формах телеангиэктазии.
Кроме геморрагического синдрома, в ряде случаев наблюдается неспецифический синдром в виде «общих» симптомов (лихорадка, потеря массы тела, слабость).
Суставной синдром проявляется отечностью болезненного сустава и наблюдается при геморрагическом васкулите и гемофилии. В последнем случае суставной синдром обусловлен кровоизлиянием в суставы — гемартрозом.
Абдоминальный синдром в виде схваткообразных болей в животе, тошноты, иногда рвоты, картины острого живота наблюдается нередко при геморрагическом васкулите, гемофилии.
Почечный синдром проявляется гематурией, протеинурией, дизури-ческими явлениями и приступами почечной колики. Наблюдается при гемофилии (гематурия упорная), геморрагическом васкулите.
Анемический синдром: слабость, головокружения, тахикардия, систолический шум в точках выслушивания сердца, артериальная гипотония — все эти симптомы могут сопутствовать любой форме ГД и зависят от выраженности геморрагического синдрома.
8.Гемофилии: классификация, этиология, клиника, диагностика, лечение.
Гемофилия – это сцепленное с Х-хромосомой врожденное нарушение свёртываемости крови, вызванное недостаточностью или отсутствием фактора свертывания крови VIII (гемофилия А) или фактора IX (гемофилия В). Подавляющее большинство больных гемофилией – мужчины. Женщина
заболевает лишь в случае брака между больным гемофилией и женщиной-кондуктором.
Причина кровоточивости заключается в дефиците или недостаточной активности факторов VIII, IX или XI. Заболевание, обусловленное дефицитом фактора VIII, обозначают гемофилией А, дефицитом фактора IX — гемофилией В, дефицитом фактора XI — гемофилией С. Наиболее часто встречается гемофилия А — 85 — 90 %, гемофилия В — существенно реже (10—15 %), точная частота гемофилии С неизвестна.
Классификация гемофилии по степени тяжести
Степень тяжести Активность фактора свертывания крови, % Случаи кровотечения Тяжелая* 1 - ≤5% Спонтанные кровотечения, главным образом в суставы и мышечные ткани
Средняя > 1 - ≤5% Возможны спонтанные кровотечения. Сильное кровотечение при травме или хирургическом вмешательстве Легкая >5% - < 40% Сильное кровотечение при серьезной травме или хирургической операции
Клиническая картина. Проявления болезни определяются гематом-ным типом кровоточивости, характерны кровоизлияния в крупные суставы, внутримышечные гематомы, обильные и длительные кровотечения при травмах, гематурия. Реже встречаются легочные и желудочнокишечные кровотечения, внутричерепные кровоизлияния, забрюшинные гематомы.
На I этапе диагностического поиска удается выяснить, что кровоточивость появилась с раннего детского возраста. Так, при рождении могут отмечаться цефалогематомы, когда ребенок начинает ходить, то при падениях возникают носовые кровотечения, гематомы в области головы и мягких тканей. В более старшем возрасте появляются кровоизлияния в суставы. Одновременно могут быть поражены от 1 — 2 до 6 —8 суставов. В анамнезе отмечаются также кровотечения после травм и операций, возникающие не сразу (как при тромбоцитопенической пурпуре) после вмешательства, а спустя 1—5 ч. Длительные кровотечения возникают обычно после экстракции зуба или после тонзиллэктомии.
На II этапе диагностического поиска можно выявить поражение опорно-двигательного аппарата, связанного с кровоизлияниями в полость сустава. Выделяют несколько типов суставного поражения: 1) острые гемартрозы (первичные и рецидивирующие); 2) хронические геморрагически-деструктивные остеоартрозы; 3) вторичный иммунный ревматоидный синдром (как осложнение основного процесса). Острый гемартроз — внезапное появление (часто после небольшой травмы) или резкое усиление боли в суставе. Сустав увеличен в объеме, горячий на ощупь, кожа над ним ги-перемирована. При больших кровоизлияниях определяется флюктуация. Боль проходит после эвакуации крови из полости сустава и одновременной трансфузии антигемофильной плазмы. При хроническом геморрагическом остеоартрозе в «холодном» периоде функция сустава может быть не нарушена, но при рентгенологическом исследовании определяются все характерные для остеоартроза признаки (сужение суставной щели, остеофиты, деформации). Со временем подвижность сустава нарушается, что сочетается с атрофией мышц, приводящих сустав в движение.
Вторичный ревматоидный синдром выражается в хроническом воспалительном процессе в мелких суставах кисти и стопы, не поражавшихся ранее кровоизлияниями, с последующей типичной деформацией, болью, выраженной утренней скованностью. С возрастом распространенность и тяжесть всех поражений суставов неуклонно прогрессируют, что приводит к инвалидизации. Прогрессирование поражений суставов зависит от частоты острых гемартрозов. Очень тяжелы и опасны подкожные, межмышечные и забрюшинные гематомы. Профузные желудочно-кишечные кровотечения могут быть спонтанными или спровоцированы приемом ацетилсалициловой кислоты, бутадиона и других ульцерогенных препаратов.
Кровоизлияния в брыжейку и сальник имитируют различные острые хирургические заболевания
— острый аппендицит, непроходимость кишечника и т.д.
Единственным критерием диагноза в этой ситуации может явиться быстрый положительный эффект интенсивной заместительной терапии (переливание антигемофильной плазмы).
Характерная черта гемофилии — длительные кровотечения при травмах и операциях, когда кровотечения возникают не сразу после травмы, а через 1-5 ч. Тонзиллэктомия при гемофилии значительно более опасна, чем полостные хирургические операции, точно так же, как и экстракция зубов (все эти вмешательства следует проводить при заместительной терапии концентратами антигемофильных препаратов).
На III этапе диагностического поиска подтверждается природа кровотечений. У больных гемофилией удлинено активированное частичное тромбопластиновое время (АЧТВ) при нормальном протромбиновом индексе. Количество тромбоцитов в норме, что обусловливает неизмененную длительность кровотечения. Показатель тромбинового времени, указывающий на активность комплекса «гепарин — антитромбин III», также не изменен. Пробы жгута и щипка отрицательные.
Форму гемофилии устанавливают с помощью добавления к плазме больного так называемой бариевой плазмы (плазмы здорового человека, смешанной с сульфатом бария, который связывает факторы протромби-нового комплекса — II, VII, IX и X, но не связывает фактор VIII). Если удлиненное АЧТВ нормализуется после добавления бариевой плазмы, то речь идет о гемофилии А, если нет — то о гемофилии В. Более точная
дифференциация проводится при смешивании плазмы больного с образцами плазмы больных с заведомо известной формой гемофилии и отсутствии нормализации свертывания плазмы больного при таком добавлении.
Диагностика. Данные семейного анамнеза примерно у 2/3 больных содержат указания на геморрагические проявления у близких родственников по женской линии (у мужчин, реже у женщин). Данные личного анамнеза могут содержать информацию о геморрагических проявлениях у пациента. При сборе анамнеза заболевания необходимо обращать внимание на наличие геморрагических проявлений в неонатальном периоде в виде кефалогематом, внутричерепных кровоизлияний, кровоточивости и длительном заживлении пупочной ранки; у грудных детей – экхимозов, не связанных со значимой травмой, гематом мягких тканей после незначительных ушибов или спонтанных. Важно обращать внимание на несоответствие выраженности геморрагических проявлений тяжести предшествовавшей травмы, на рецидивы кровотечений после первичной остановки, не связанные с повторной травмой, массивные и (или) множественные гематомы, системность геморрагических проявлений (проявления различной локализации), «спонтанные геморрагические проявления», возникающие изза длительного латентного периода и несоответствия характера кровотечения тяжести травмы. Физикальное обследование. При тяжёлой и среднетяжелой форме гемофилии выявляется кожный геморрагический синдром различной выраженности в виде множественных экхимозов и гематом. Возможны признаки поражения суставов в виде деформации, отека и локального повышения температуры кожи, позднее – признаки нарушения подвижности суставов, гипотрофия мышц конечности на стороне поражённого сустава, нарушение походки. Лабораторная диагностика. Коагулологическое обследование проводится поэтапно: Первый этап. Коагулологический скрининг при подозрении на геморрагические состояния включает
активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время (ПВ), тромбиновое время (ТВ), концентрацию фибриногена (по Клауссу), время кровотечения стандартизованным методом (например, по Айви, или с помощью анализаторов функции тромбоцитов PФ.A-100 и PФ.A-200) и подсчет количества тромбоцитов. На основе этих тестов можно определить тип нарушения свёртываемости крови. Для гемофилии характерно увеличение АЧТВ, удлинение времени свертывания крови при сохранении других показателей в пределах нормальных значений. Необходимо иметь в виду, что эти скрининг-тесты могут не обнаружить аномалий у пациентов с лёгкой формой гемофилии. Второй этап. Выполняется при изолированном удлинении АЧТВ, либо при отсутствии изменения в скрининге и наличии клинических признаков лёгкой формы гемофилии. На втором этапе проводят тест коррекции (коррекция АЧТВ при смешивании плазмы пациента с нормальной плазмой), определение активности FVIII, FIX, фактора Виллебранда, FXI и FXII. Третий этап. При выявленном снижении активности FVIII или FIX выполняется определение специфического ингибитора к сниженному фактору. При снижении активности нескольких факторов свёртывания крови и/или удлинении фосфолипидзависимых тестов (АЧТВ с чувствительными реактивами) проводится определение неспецифического ингибитора (волчаночного антикоагулянта). Диагноз и тяжесть гемофилии устанавливаются после выявления снижения активности FVIII или FIX, если подтверждено отсутствие данных за приобретенное геморрагическое состояние, в том числе связанное с появлением первичного ингибитора.
Лечение. Гемостатическую терапию назначают в периоды кровотечения. Основным методом лечения является заместительная терапия в виде применения гемопреципитатов, содержащих фактор VIII (антигемофиль-ная плазма, криопреципитат, концентраты фактора VIII). Наиболее эффективным является криопреципитат — выделяемый из плазмы с помощью криоосаждения белковый концентрат, содержащий большое количество фактора VIII. Концентрат фактора VIII вводят внутривенно. При гемофилии В вводят концентраты фактора IX. В экстренных случаях производят массивные прямые переливания крови не реже 3 раз в сутки. Кровоточащие участки обрабатывают тромбином, аминокапроновой кислотой.
При острых гемартрозах сустав временно иммобилизуют, кровь из полости сустава удаляют и вводят гидрокортизон. При ревматоидном синдроме назначают преднизолон в дозе 20 — 40 мг/сут. В «холодном» периоде поражения суставов назначают физиотерапевтические процедуры, лечебную физкультуру.
9.Тромбоцитопатии: понятие, этиология, клиника, лабораторная диагностика, лечение
Тромбоцитопатия – нарушение системы гемостаза, в основе которого лежат качественный дефект и дисфункция тромбоцитов.
Этиология. Тромбоцитопатии бывают
–наследственные (первичные), которые развиваются при генных дефектах: (тромбастения Глянцмана, болезнь Виллебранда, болезнь Бернара – Сулье);
–приобретенные (симптоматические), вторичные – возникают при: заболеваниях и синдромах (опухоли, ДВС-синдром, пороки сердца, уремия, парапротеинемия, иммунные тромбоцитопении, диффузные заболевания соединительной ткани, заболевания печени и почек, мегалобластные анемии, острые лейкозы, миелопролиферативные заболевания) и при воздействии лекарственных препаратов (аспирин, курантил, нестероидные противовоспалительные средства и др.).
Различают следующие основные звенья патогенеза тромбоцитопатий:
–нарушение процессов синтеза и накопления в гранулах тромбоцитов биологически активных веществ;
–расстройство процессов дегрануляции и высвобождения тромбоцитарных факторов в плазму крови;
–нарушение структуры и свойств мембран тромбоцитов.
Клиника. Ведущим в клинике различных форм тромбоцитопатии является рецидивирующий геморрагический синдром, тяжесть которого может варьировать от легкой кровоточивости до обильных кровотечений. У новорожденных тромбоцитопатия может проявляться кефалогематомами, внутричерепными кровоизлияниями, кровоточивостью и медленным заживлением пупочной ранки. Кровотечения микроциркулярного типа характеризуются петехиями, экхимозами, возникающими при незначительных травмах, трении тела одеждой. В отличие от гемофилии, для тромбоцитопатии не характерны гемартрозы и межмышечные гематомы.
При тромбоцтопатиях у детей раннего возраста отмечаются кровотечения при прорезывании зубов, рецидивирующие носовые кровотечения, повышенная кровоточивость десен, длительное заживление мелких повреждений. У девочекподростков часто имеется «семейная» склонность к меноррагиям, ювенильным дисфункциональным маточным кровотечениям. У пациентов с тромбоцитопатиями даже малые хирургические вмешательства (удаление зуба, тонзиллэктомия и др.) сопровождаются обильными и длительными кровотечениями. Реже в клинике тромбоцитопатий встречаются желудочно-кишечные кровотечения, гематурия, кровоизлияния в склеры.
Вследствие повышенной кровопотери у детей с тромбоцитопатиями развивается анемический синдром, характеризующийся общей слабостью, бледностью кожных покровов, головокружениями, одышкой, тахикардией, артериальной гипотонией, склонностью к обморокам.
– геморрагическим синдромом – кровотечения носовые, десневые, почечные, желудочно-кишечные, маточные; кровоизлияния в кожу (мелкоточечная
геморрагическая сыпь, экхимозы), мышцы, слизистые, подкожную жировую клетчатку, ЦНС, во внутренние органы, полости и др.;
–расстройствами микрогемоциркуляции, ведущими к нарушениям обмена веществ в тканях (капилляротрофическая недостаточность); дистрофиями, эрозиями, изъязвлениями; изменениями свойств тромбоцитов (адгезивных, агрегационных, прокоагуляционных); дефектами гранул тромбоцитов – отсутствие или уменьшение их числа (например, при синдроме «серых» тромбоцитов), нарушениями высвобождения их содержимого, отклонением от нормы размера и формы мегакариоцитов и тромбоцитов;
–анемическим синдромом – общая слабость, бледность, головокружение, систолический шум на верхушке и др. (при кровотечениях).
Диагностика тромбоцитопатии включает несколько этапов, главными из которых являются анализ клинических проявлений и семейного анамнеза, углубленное исследование системы гемостаза. Функциональные эндотелиальные пробы (баночная, манжеточная, щипковая, проба жгута) при тромбоцитопатиях, как правило, положительные: на коже, в месте воздействия остаются многочисленные петехии или кровоподтек.
Лабораторный этап диагностики тромбоцитопатии начинается с клинического анализа крови, определения времени кровотечения, показателей коагулограммы. В процессе диагностического поиска тромбоцитопатии проводится определение количества тромбоцитов и тромбоцитарной формулы, изучение их морфометрических характеристик и функции (адгезивности; агрегационной активности тромбоцитов с АДФ, ристомицином, адреналином, тромбином, коллагеном; определение тромбоцитарных факторов свертывания и др.). Лабораторное обследование ребенка с тромбоцитопатией должно выполняться не менее 3-х раз в разные периоды заболевания (во время клинической ремиссии и в момент геморрагических проявлений).
Для оценки функции кроветворения в некоторых случаях назначается проведение стернальной пункции или трепанобиопсии и исследование миелограммы.
Лечение.
Антифибринолитические препараты - транексамовая кислота, аминокапроновая кислота. Препаратом выбора в данной группе является транексамовая кислоты. Доза транексамовой кислоты составляет 15-25 мг/кг перорально 3-4 раза в день или 10 мг/кг внутривенно 3-4 раза в день. Ее также можно использовать для полоскания для рта в случае десневых кровотечений – по 10 мл 5% раствора 4-6 раз в день, в случае заглатывания эквивалентная доза составляет 500 мг. Антифибринолитики противопоказаны при гематурии из-за опасности развития острой почечной недостаточности.
Десмопрессин является синтетическим аналогом вазопрессина (антидиуретического гормона). Стандартная доза DDAVP составляет 0,3 мг/кг (не более 20 мг) внутривенно (или подкожно) или 300 мг интраназально.
Трансфузия тромбоцитов.
Рекомбинантый активированный фактор свертываемости крови VII (rFVIIa).
При наследственных тромбоцитопатиях проведение этиотропного лечения невозможно. Поэтому весь комплекс терапевтических мероприятий делится на неотложную терапию по купированию геморрагического синдрома и профилактическое лечение. В течение всей жизни пациентам с тромбоцитопатией запрещается употребление уксуса с пищей (в т. ч. в консервах), алкоголя. Рекомендуется обогащение рациона продуктами, богатыми витаминами А, С и Р; арахисом.
Медикаментозная терапия тромбоцитопатии проводится гемостатическими средствами (дицинон, этамзилат натрия, адроксон, кальция глюконат, аминокапроновая кислота и др.), препаратами метаболического действия (рибоксин, АТФ, оротат калия, фолиевая кислота). Полезно употребление кровоостанавливающих фитосборов. Плановые профилактические курсы лечения тромбоцитопатии рекомендуется проводить 2-4 раза в год в зависимости от тяжести геморрагического синдрома.
Для локальной остановки кровотечений из поверхностных ран используется орошение кровоточащей поверхности охлажденным раствором аминокапроновой кислоты, нанесение адроксона, аппликации фибринной пленки с тромбином. При носовом кровотечении необходимо ведение в носовые ходы гемостатической губки, проведение анемизации слизистой носа. При маточных кровотечениях применяются препараты, усиливающие сокращение матки (прегнин), внутривенное введение аминокапроновой кислоты; РДВ полости матки при тромбоцитопатии должно проводится под прикрытием гемостатической терапии. При массивной кровопотере может потребоваться переливание эритроцитарной массы, тромбоцитов и плазмы.
10.Тромбоцитопении: этиология, клинические проявления, диагностика, лечение.
Тромбоцитопенические пурпуры объединяют целую группу за-болеваний и синдромов, обусловленных снижением количества тромбоцитов в периферической крови вследствие повышенного их разрушения, недостаточного образования, повышенного потребления
Классификация:
A. Тромбоцитопений вследствие повышенного разрушения тромбоцитов:
I. Наследственные формы (обусловленные дефектами ферментов
гликолиза или цикла Кребса). II. Приобретенные формы:
1) иммунные (аллоиммунные, трансиммунные, гетероиммунные, аутоиммунные): а) симптоматические, б) идиопатические;
2) неиммунные (механическое разрушение тромбоцитов при гемангиомах, спленомегалиях различного происхождения, про¬ тезах клапанов сердца).
Б. Тромбоцитопений вследствие недостаточного образования тромбоцитов (при гемобластозах, гипо- и апластической анемии, В^-дефицитной анемии, гемолитической анемии — ночной пароксизмальной гемоглобинурии).
B. Тромбоцитопений вследствие повышенного потребления тромбоцитов (синдром внутрисосудистого диссеминированного свертывания крови).
ИДИОПАТИЧЕСКАЯ ТРОМБОЦИТОПЕНИЧЕСКАЯ ПУРПУРА
В основе идиопатической тромбоцитопенической пурпуры лежит повышенное разрушение тромбоцитов макрофагами селезенки, что связано с фиксацией на поверхности тромбоцита антител (IgG), продуци-руемых, возможно, лимфоидной тканью селезенки больных и направлен-ных против антигенов собственных тромбоцитов, в результате чего резко укорачивается продолжительность жизни тромбоцитов (до нескольких часов вместо 7 — 10 дней в норме). В ответ на усиленное разрушение тромобоцитов происходит компенсаторное повышение их продукции в костном мозге в несколько раз. Об этом свидетельствует увеличение в костном мозге количества мегакариоцитов и отсутствие вокруг них тромбоцитов, что говорит о повышенном выходе их в кровяное русло (но не о недостаточной их отшнуровке). Идиопатической тромбоцитопенической пурпурой страдают чаще всего женщины молодого и среднего возраста.
Клиническая картина. Проявления болезни определяются геморрагическим синдромом. Как правило, болезнь течет волнообразно: «спокойные» периоды прерываются обострениями, во время которых геморрагический синдром рецидивирует (или усиливается), что сопровождается падением количества тромбоцитов в периферической крови.
На I этапе диагностического поиска можно получить информацию о жалобах больного на появление кожных геморрагии и кровотечений из слизистых оболочек. Кожные геморрагии возникают после небольших травм или же спонтанно и локализуются чаще всего на передней поверхности туловища и на конечностях (чаще — на внутренней поверхности). В местах инъекций лекарственных препаратов могут быть более крупные кровоизлияния. Больные отмечают также кровоточивость десен, носовые кровотечения. После экстракции зуба кровотечения возникают сразу. Реже у больных возникают кровохарканье, кровотечения из пищевари¬тельного тракта, гематурия. Женщины отмечают маточные кровотечения или же более обильные и длительные менструации. Часть больных могут сообщить, что у
них ранее при исследовании крови отмечалась тромбоци-топения, причем периоды усиления кровоточивости сопровождались более выраженным снижением количества тромбоцитов. Наконец, больные могут сообщить об успешном лечении кортикостероидными гормонами (преднизолон), что приводило к уменьшению кровоточивости и увеличе-нию количества тромбоцитов. Некоторым больным ранее предлагалась спленэктомия.
На II этапе диагностического поиска в период обострения заболевания можно обнаружить пятнисто-петехиальный тип кровоточивости — расположение геморрагии на передней поверхности туловища и конечнос-тях, причем давность геморрагии различная — наряду с темно-синими от-мечаются багровые, зеленоватые и желтые пятна.Положительными явля-ются пробы на ломкость капилляров (симптомы щипка и жгута). Со сто-роны внутренних органов изменений обычно не наблюдается, однако у части больных отмечается увеличение селезенки, особенно, если тромбо-цитопения сочетается с гемолитической анемией. Увеличение печени несвойственно тромбоцитопении. У некоторых больных в период обострения болезни могут незначительно увеличиваться лимфатические узлы, особен¬но в области шеи, появляется субфебрильная температура тела.
Решающим является III этап диагностического поиска, во время которого выясняют природу кровоточивости. Прежде всего отмечается увеличение времени кровотечения, а также тромбоцитопения, вплоть до полного исчезновения тромбоцитов из периферической крови. Ретракция кровяного сгустка на высоте тромбоцитопении отсутствует. При числе тромбоцитов, превышающем 50109/л, геморрагический синдром наблюдается редко. Отмечаются изменения формы тромбоцитов (большой величины, атипичной формы и со скудной специфической зернистостью). Показатели коагуляционного гемостаза не изменены (протромбиновый индекс, активированное частичное тромбопластиновое время) Содержание эритроцитов и гемоглобина может быть нормальным. Лишь при частых кровотечениях наблюдается постгеморрагическая ане-мия. Увеличение ретикулоцитов в крови зависит от интенсивности крово-потери. Содержание лейкоцитов у большинства больных нормальное.В костном мозге у большинства больных увеличено количество мега-кариоцитов, преобладают молодые формы.
Диагностика.
1) Анамнез заболевания (предшествующие развитию тромбоцитопении факторы – бактериальный и вирусные инфекции, вакцинации, стрессы, прием различных лекарственных препаратов, наличие и длительность кровотечений в анамнезе после хирургических вмешательств, наличие варикозной болезни, тромбозов, сердечно-сосудистая патология, требующая лечения антикоагулянтами и дезагрегантами, наличие других соматических заболеваний, протекающих с тромбоцитопенией, ДВСсиндромом и др.);
2)Наследственная предрасположенность (наличие у кровных родственников эпизодов кровоточивости и тромбоцитопении, тромбозов и других заболеваний системы кроветворения);
3)Физикальное обследование у больных ИТП не должно выявлять никаких отклонений. Однако гипертермия, снижение массы тела, гепатои спленомегалия и/или лимфоаденопатия требует безотлагательного проведения дообследования для исключения ВИЧ-инфекции, СКВ, ЛПЗ и др. Оценка состояния молочных желез, сердца, вен нижних конечностей, аномалий строения лица и конечностей позволит исключить другие заболевания и синдромы, сопровождающиеся тромбоцитопенией другого генеза.
4)Общий анализ крови с определением количества ретикулоцитов. Для ИТП характерна изолированная тромбоцитопения с нормальными показателями гемоглобина, эритроцитов и ретикулоцитов, а также нормальные показатели лейкоцитов и лейкоцитарной формулы и отсутствие морфологических и функциональных аномалий тромбоцитов. При предшествовавшей кровопотере допустимы признакипостгеморрагической железодефицитной анемии и небольшой ретикулоцитоз.
5)Исследование мазков периферической крови позволяет выявить аномалии, исключающие диагноз ИТП, например, шизоциты, чрезмерное количество гигантских или мелких тромбоцитов при наследственной тромбоцитопении, псевдотромбоцитопении и др. «Ложная» или псевдотромбоцитопения, обусловленная образованием агрегатов тромбоцитов при заборе крови с консервантом ЭДТА может быть подтверждена при повторном подсчете количества тромбоцитов на автоматическом анализаторе в пробе крови с цитратом.
6)Биохимический анализ крови с определением всех основных параметров
(уровня общего белка, альбуминов и глобулинов, уровня общего билирубина с фракциями, активности АСТ, АЛТ, щелочной фосфатазы, ГГТП, креатинина, мочевины, мочевой кислоты, параметров обмена железа) для оценки состояния внутренних органов и выявления соматических заболеваний.
7)Определение уровня иммуноглобулинов классов А, М и G в сыворотке крови – для диагностики иммунодефицита, при котором противопоказано иммуносупрессивное лечение.
8)Цитологическое исследование костного мозга необходимо для исключения тромбоцитопении при острых лейкозах, лимфопролиферативных заболеваниях, миелодиспластическом синдроме и апластической анемии, метастазов опухолей в костный мозг и др. Для диагностики непосредственно ИТП чрезвычайно значимым является количество мегакариоцитов и их морфология. При ИТП число МКЦ чаще всего бывает повышенным или нормальным. Сниженное их число нехарактерно для ИТП. Морфология МКЦ разнообразна. Для ИТП более характерны нормальные и гигантские формы. Проведение трепанобиопсии костного мозга показано при рецидивирующих и резистентных формах ИТП, особенно у пациентов старше 60 лет, при
малом числе МКЦ в миелограмме, подозрении на вторичный генез тромбоцитопении, при редидивах и при решении вопроса о спленэктомии
(3,25,26,27,43).
9)Вирусологические исследования, включающие антитела к вирусам гепатитов А, В и С, и в случае положительного результата – проведение ПЦР диагностики, необходимы для исключения или оценки степени активности гепатитов, способных протекать с тромбоцитопенией. Необходимо проведение диагностического мониторинга (определение антител к цитомегаловирусу, вирусу Эпштейна-Барр и других вирусовсемейства простого герпеса, способных вызывать тромбоцитопению, в том числе и как первичный симптом заболевания) (3,42).
10)Определение антител классов М и G к ВИЧ.
11)Диагностика Hellicobacter pylori различными методами (3,62) у больных в отягощенным язвенным анамнезом и/или клиническими проявлениями язвенной болезни желудка и двенадцатиперстной кишки (3).
12)Прямая проба Кумбса у больных с анемией и ретикулоцитозом (3,4).
13)При первичном обследовании и тромбоцитопении ниже 50,0х109 /л обязательным является исследование развернутой коагулограммы (АЧТВ, протромбиновое и тромбиновое время, фибриноген, антитромбин III, фибринолитическая активность, агрегация тромбоцитов с АДФ, ристомицином и адреналином, скорость агрегации тромбоцитов, активность фактора ХIII, РКМФ, активность протеина С).
14)Маркеры тромбофилий (при наличии в анамнезе тромбозов или ишемических атак).
Лечение. Патогенетическая терапия аутоиммунной тромбоцитопени-ческой пурпуры складывается из применения глюкокортикостероидных гормонов, спленэктомии и назначения иммунодепрессантов (цитостатичес-ких).
Лечение начинают с назначения преднизолона из расчета 1 мг на 1 кг массы тела с последующим снижением дозы и постепенной отменой препарата после нормализации количества тромбоцитов и ликвидации клинических и лабораторных признаков заболевания. В ряде случаев один такой курс может привести к длительной ремиссии (и даже окончательно¬му излечению). Однако чаще после полной отмены преднизолона или даже при попытке снижения дозы наступает рецидив, требующий возврата к исходным дозам. При неполном и нестабильном эффекте лечения преднизолоном (обыч¬но через 3 — 4 мес от начала терапии) возникают показания к спленэктомии или назначению иммунодепрессантов. Спленэктомия дает положительный эффект в 80 % случаев. Результаты спленэктомии лучше тогда, когда нор¬мализация тромбоцитов наступала от приема небольшой дозы преднизоло-на. В дальнейшем в зависимости от эффекта спленэктомии проводят курсы преднизолона существенно меньшими дозами, нежели до операции. Однако у части больных спленэктомия не дает отчетливого эффекта и тогда назна¬чают цитостатические препараты — азатиоприн (по 2
—3 мг на 1 кг массы тела в сутки) или циклофосфан (по 200 — 400 мг/сут) в течение 3 — 5 мес.
В последнее время появились данные об эффективности плазмафере-за, во время которого из крови удаляются аутоантитела, обусловливающие гибель тромбоцитов.
Кровотечения останавливают с помощью самых различных гемостатических средств (гемостатическая губка, тампонада с аминокапроновой кислотой). Гемотрансфузии у больных иммунными тромбоцитопеническими пурпурами проводятся только по жизненным показаниям; следует переливать отмытые и индивидуально подобранные эритроциты.
11. Геморрагические диатезы связанные с поражением сосудистой стенки (на примере геморрагического васкулита Шенлейн-Генноха): этиология, клинические формы, диагностика, принципы лечения.
Геморрагические диатезы (Г Д) — группа врожденных или приобретенных болезней и синдромов, основным клиническим проявлением которых является повышенная кровоточивость — наклонность к повторным кровотечениям или кровоизлияниям, возникающим спонтанно или после незначительных травм.
В развитии кровоточивости принимают участие следующие факторы:
1.Тромбоцитарное звено гемостаза.
2.Плазменное звено гемостаза.
3.Состояние сосудистой стенки.
4.Фибринолитическая активность крови.
Классификация. В соответствии с ведущим механизмом кровоточи-вости среди наиболее часто встречающихся ГД выделяют несколько больших групп.
•Тромбоцитопении (снижение количества тромбоцитов) и тромбоцитопатии (нарушение функциональных свойств тромбоцитов).
•Коагулопатии (гемофилии), развивающиеся при:
а) недостаточном количестве прокоагулянтов, участвующих в плаз¬ менном звене гемостаза; б) недостаточной функциональной активности прокоагулянтов;
в) наличии в крови ингибиторов отдельных прокоагулянтов.
•Ангиопатии (вазопатии) — повреждение сосудистой
стенки врожденного характера или развивающееся в результате иммуноаллергического или инфекционно-токсического воздействия.
•Избыточный фибринолиз, возникающий при: а) лечении тромболитическими препаратами;
б) дефекте ингибитора плазмина или избытке тканевого активатора плазминогена (наследственного происхождения).
•Синдром диссеминированного внутрисосу-
дистого свертывания (ДВС-синдром), представляющий сочетание нарушений различных компонентов гемостаза (тромбоцитопения, коагулопатия и пр.).
Клиническая картина. Проявления ГД чрезвычайно разнообразны, что зависит от формы и выраженности геморрагического синдрома, вовле-чения в патологический процесс различных органов и систем и осложне-ний. В связи с этим целесообразно клиническую картину ГД представить как сочетание различных видов самой кровоточивости, синдрома пораже-ния органов и систем, неспецифического синдрома, синдрома нарушений гемостаза, выявляемых с помощью лабораторных методов исследования.
В настоящее время выделяют пять типов кровоточивости [Баркаган З.С., 1975], наблюдающихся при различных ГД: 1) гематомный; 2) пят-нисто- петехиальный, или микроциркуляторный; 3)
Для определения патогенетического механизма кровоточивости используются лабораторные методы исследования. В настоящее время существует множество методов изучения гемостаза, причем многие из них по сути дела дублируют друг друга, в связи с чем необходимо определение рационального минимума исследований. Примерный алгоритм использования методов исследования гемостаза, который необходимо применять при ГД любого происхождения, следующий.
Исследование начинается с определения времени кровотечения (в норме колеблется от 2 до 5 мин), которое позволяет оценить участие тромбоцитарного звена гемостаза в патогенезе кровоточивости: при его удлинении роль нарушенного тромбоцитарного звена несомненна. После¬дующее определение количества тромбоцитов в периферической крови позволяет сделать более детальное заключение: при снижении
количества тромбоцитов в периферической крови речь идет о тромбоцитопенической пурпуре; если же количество тромбоцитов не снижено, то следует думать о тромбоцитопатии, для чего проводится определение функциональных свойств тромбоцитов (определение адгезии и агрегации).
Если же при наличии геморрагических проявлений время кровотече-ния не увеличено, то, по-видимому, речь может идти о ГД, обусловленном нарушением плазменного звена гемостаза.
С этой целью определяется протромбиновое время (ПВ) и активиро-ванное частичное тромбопластиновое время (АЧТВ). При удлинении ПВ и неизмененном АЧТВ дефект находится во «внешнем» каскаде сверты¬вания крови (дефицит фактора VII — гипоконвертинемия). При удлине¬нии АЧТВ и неизмененном ПВ «дефект» гемостаза локализуется во «внутреннем» каскаде (дефицит факторов VIII, IX). При удлинении ПВ и АЧТВ речь идет о дефиците факторов X, V, II (протромбин) или I (фибриноген). Для дальнейшего уточнения требуется определение уров¬ня фибриногена, а также использование так называемых дефицитных сывороток. Это исследование проводится в специализированных лабора¬ториях.
Если же количество и функциональные свойства тромбоцитов не из-менены, показатели коагуляционного гемостаза также без отклонений от нормы, то следует думать, что ГД обусловлен патологией сосудистой стенки или же другими причинами, в частности повышенным фибринолизом. Об этом будет свидетельствовать укорочение времени лизиса эуглобулино-вых сгустков (в норме 2 — 4 ч).
Перечисленные методы исследования системы гемостаза при ГД позволяют выявить наиболее частые нарушения гемостаза. Более детальное его исследование обычно проводится в специализированных лабораториях. Далее рассматривается диагностический поиск при ГД, обусловленных снижением количества тромбоцитов (тромбоцитопении), патологией плазменного звена гемостаза (гемофилии), патологией сосудистой стенки (ангиопатии) и ДВС-синдроме.
Геморраги́ческий васкули́т (синонимы: пурпура Шёнлейна — Ге́ноха[1],
Пурпура Шенлейна-Геноха (син.: геморрагический васкулит, анафилактоидная пурпура, геморрагический капилляротоксикоз) – системный васкулит, поражающий преимущественно сосуды микроциркуляторного русла (артериолы, капилляры и послкапиллярные венулы) и характеризующийся отложением в их стенке иммунных депозитов, состоящих преимущственно из иммуноглобулина А, который клинически проявляется пурпурой (кожной геморрагической сыпью) в сочетании с поражением суставов, желудочно-кишечного тракта и почек.
Главной причиной, вызывающей это заболевание является циркуляция в крови иммунных комплексов и активированных компонентов системы комплемента. В здоровом организме иммунные комплексы элиминируются из организма специальными клетками. Чрезмерное накопление циркулирующих иммунных комплексов в условиях преобладания антигенов или при недостаточном образовании антител приводит к отложению их на эндотелии микроциркуляторного русла с вторичной активацией белков системы комплемента по классическому пути и вторичном изменении сосудистой стенки. В результате развивается микротромбоваскулит, и происходят сдвиги в системе гемостаза: активация тромбоцитов, циркуляция в крови спонтанных агрегатов, выраженная гиперкоагуляция, снижение в плазме антитромбина III, тромбопения, повышение уровня фактора Виллебранда, депрессия фибринолиза. У большинства больных (66-80 %) развитию заболевания предшествует инфекция верхних дыхательных путей. Описана манифестация заболевания после тифа, паратифа А и Б, кори, желтой лихорадки. Другими потенциальными стартовыми агентами заболевания могут быть: лекарства (пенициллин, ампициллин, эритромицин, хинидин, эналаприл, лизиноприл, аминазин), пищевая аллергия, укусы насекомых, переохлаждение.
Классификация По степени активности
I степень активности — состояние при этом удовлетворительное, температура тела нормальная или субфебрильная, кожные высыпания необильные, все остальные проявления отсутствуют, СОЭ увеличено до 20 миллиметров в час.
II степень активности — состояние средней тяжести, выраженный кожный синдром, повышается температура тела выше 38 градусов(лихорадка), выраженный интоксикационный синдром (головная боль, слабость, миалгии), выраженный суставной синдром, умеренно выраженный абдоминальный и мочевой синдром. В крови повышено количество лейкоцитов, нейтрофилов, эозинофилов, СОЭ будет повышено до 20—40 миллиметров в час, снижается содержание альбуминов, диспротеинемия.
III степень активности — состояние будет уже тяжелым, выражены симптомы интоксикации (высокая температура, головная боль, слабость, миалгии). Будет выражен кожный синдром, суставной, абдоминальный (приступообразные боли в животе, рвота, с примесью крови), выраженный почечный синдром, может быть поражение центральной нервной системы и периферической нервной системы. В крови выраженное повышение лейкоцитов, повышение нейтрофилов, повышение СОЭ выше 40 миллиметров в час, может быть анемия, снижение тромбоцитов.
Клиническая картина
Как правило, геморрагический васкулит протекает доброкачественно. Обычно болезнь заканчивается спонтанной ремиссией или полным выздоровлением в течение 2-3 недель от момента появления первых высыпаний на коже. В некоторых случаях болезнь приобретает рецидивирующее течение. Возможны тяжёлые осложнения, обусловленные поражением почек или кишечника.
Выделяют несколько клинических форм геморрагического васкулита:
1.Простая или кожная форма
2.Суставная (ревматоидная) форма
3.Абдоминальная форма
4.Почечная форма
5.Молниеносная форма
6.Сочетанное поражение (смешанная форма)
Клинически болезнь проявляется одним или несколькими симптомами:
Поражение кожи — самый частый симптом, относится к числу диагностических критериев заболевания. Наблюдается характерная геморрагическая сыпь — так называемая пальпируемая пурпура, элементы которой незначительно возвышаются над поверхностью кожи, что незаметно на глаз, но легко определяется на ощупь. Часто отдельные элементы сливаются, могут образовывать сплошные поля значительной площади. Иногда отдельные элементы некротизирующиеся.В дебюте заболевания высыпания могут иметь петехиальный характер. В начале заболевания высыпания всегда локализуются в дистальных отделах нижних конечностей. Затем они постепенно распространяются на бёдра и ягодицы. Очень редко в процесс вовлекаются верхние конечности, живот и спина. Через несколько дней пурпура в большинстве случаев бледнеет, приобретает за счёт пигментации бурую окраску и затем постепенно исчезает. При рецидивирующем течении могут сохраняться участки пигментации. Рубцов не бывает никогда (за исключением единичных случаев с некротизацией элементов и присоединением вторичной инфекции).Суставной синдром — часто возникает вместе с кожным синдромом, встречается в 59-100 % случае.Излюбленная локализация — крупные суставы нижних конечностей, реже вовлекаются локтевые и лучезапястные суставы. Характерны мигрирующие боли в суставах, возникающие одновременно с появлением высыпаний на коже. Примерно в четверти случаев (особенно у детей) боли в суставах или артрит предшествуют поражению кожи.
Абдоминальный синдром, обусловленный поражением желудочнокишечного тракта, встречается примерно у 2/3 от числа всех больных. Проявляется спастическими болями в животе, тошнотой, рвотой, желудочнокишечным кровотечением. Возможны такие тяжёлые осложнения, как инвагинация кишечника, перфорация, перитонит. При эндоскопическом исследовании обнаруживают геморрагический или эрозивный дуоденит, реже эрозии в желудке или в кишечнике (локализация возможна любая, включая прямую кишку).
Почечный синдром: Чаще развивается после появления других признаков болезни, иногда через одну — три недели после начала заболевания, но в единичных случаях может быть первым его проявлением. Тяжесть почечной патологии, как правило, не коррелирует с выраженностью других симптомов. Клинические проявления поражения почек разнообразны. Обычно выявляется изолированная микроили макроглобулинурия, иногда сочетающаяся с умеренной протеинурией. В большинстве случаев эти изменения проходят бесследно, но у некоторых больных может развиться гломерулонефрит. Возможно развитие нефротического синдрома. Морфологические изменения в почках варьируют от минимальных до тяжёлого нефрита «с полулуниями». При электронной микроскопии выявляются иммунные депозиты в мезангии, субэндотелии, субэпителии, в клубочках почек. В их состав входят IgA, преимущественно 1-го и реже 2-го субкласса, IgG, IgМ, С3 и фибрин.
Поражение лёгких: встречается в единичных случаях. Описаны больные с лёгочным кровотечением и лёгочными геморрагиями.
Поражение нервной системы: встречается в единичных случаях. Описаны больные с развитием энцефалопатии, с небольшими изменениями в психическом статусе; могут быть сильные головные боли, судороги, кортикальные геморрагии, субдуральные гематомы и даже инфаркт мозга. Описано развитие полинейропатии.
Поражение мошонки: встречается у детей, не чаще 35 %, и сводится к отёку мошонки (что связывают с геморрагиями в её сосуды).
Молниеносная форма. В ее основе лежит гиперергическая реакция, развитие острого некротического тромбоваскулита. Заболевание чаще развивается на первом-втором году жизни через 1-4 недели после детской инфекции (ветряная оспа, краснуха, скарлатина и т. д.). Характерны симметричные обширные кровоизлияния, некрозы, появление цианотичных участков кожи (кисти, стопы, ягодицы, лицо), имеющих сливной характер. В дальнейшем возможно развитие гангрены кистей и стоп, развитие комы, шока.
Неспецифичны. Важным признаком, позволяющим заподозрить заболевание, является увеличение концентрации IgA в сыворотке крови. У 30 % — 40 % больных обнаруживается РФ. У детей в 30 % случаев наблюдается
увеличение титра АСЛ-О. Повышение СОЭ и СРБ коррелируют со степенью активности васкулита.
Диагностические критерии Диагноз ПШГ устанавливают при наличии кожной геморрагической сыпи в сочетании с одним из следующих критериев:
• Абдоминалгии • Артралгии/суставной синдром • Отложения IgA в пораженных тканях и органах (обычно выявляемые при биопсии кожи и/или почек). • Протеинурия (более 0,3 г/сут) и/или гематурия (более 5 эритроцитов в поле зрения).
Лечение
Во-первых, необходима диета (исключаются аллергенные продукты). Вовторых, строгий постельный режим. В третьих, медикаментозная терапия (антиагреганты, антикоагулянты, кортикостероиды, иммунодепрессантыазатиоприн, а также антитромботическая терапия). Применяют следующие препараты:
дезагреганты — курантил по 2—4 миллиграмма/килограмм в сутки, трентал внутривенно капельно.
гепарин в дозировке по 200—700 единиц на килограмм массы в сутки подкожно или внутривенно 4 раза в день, отменяют постепенно с понижением разовой дозы.
активаторы фибринолиза — никотиновая кислота.
При тяжелом течении назначают плазмаферез или терапию глюкокортикостероидами.
В исключительных случаях применяют цитостатики, такие, как Азатиоприн или Циклофосфан. В основном течение заболевания благоприятное, и иммуносупрессантная или цитостатическая терапия применяется редко (например, при развитии аутоиммунного нефрита).
12.Лимфогранулематоз: этиология, клиника, классификация, диагностика, лечение. 2014
Лимфогранулематоз (болезнь Ходжкина, злокачественная гранулёма) — это злокачественная опухоль лимфоидной ткани с клональной пролиферацией В-клеток зародышевых центров лимфоузлов.
Этиология неизвестна. Связь его с туберкулезом, другими инфекционными возбудителями и вирусом Энштейна-Барр не доказана. У лиц, перенесших инфекционный мононуклеоз, частота в 3 раза выше, чем в общей популяции.
Нозологические единицы: Классическая лимфомаХоджкина:
Лимфоцитарное преобладание 5%
Смешанно-клеточный вариант 15-30%
Лимфоцитарное истощение менее 1%
Нодулярный склероз 60-80%
Нодулярный вариант с лимфоидным преобладанием 5%
Гистологическая классификация Лимфогранулематоза (МКБ, ВОЗ, 2001)
1)Лимфогистицитарный вариант
2)Нодулярный склероз
3)Смешанноклеточный вариант
4)Диффузный склероз
5)Ретикулярный вариант
Лимфогистиоцитарный вариант соответствует дебюту заболевания и его 1-ой стадии. При этой гистологической форме чаще наблюдается выздоровление.
Нодулярный склероз отмечается при поражении лимфатических узлов средостения, для него характерна поздняя генерализация процесса.
Смешанноклеточный вариант соответствует классической клинической форме лимфогранулематоза.
Вариант с лимфоидным истощением характеризуется отсутствием лимфоцитов и встречается при подостром течении заболевания. Он объединяет вариант диффузного склероза и ретикулярный вариант лимфоидного истощения.
Клиническая классификация
Выделяют 4 стадии. Каждая стадия подразделяется на 2 группы: А
(отсутствие), В (наличие) общих симптомов заболевания.
Стадия I: поражение лимфоузлов одной области или одного нелимфатического органа или ткани в пределах одного сегмента.
Стадия II: поражение л/узлов двух и более областей по одну сторону диафрагмы. Количество пораженных лимфоузлов (локализаций) обозначается арабской цифрой (II 2. II 3 и т.д.).
Стадия III: поражение лимфоузлов по обеим сторонам диафрагмы.
Стадия IV: диссеминированное поражение одного и более нелимфатического органа и лимфатических узлов или без них. Локализация
поражения в IV стадии обозначается символом: L — легкие, Н-печень, М-КМ, О-кости, Р-плевра, Д-кожа, подкожная клетчатка.
Симптомы, клиническая картина: ОБСЛЕДОВАНИЕ:
Анамнез. Основные вопросы:
1.общее состояние ребенка – наличие потери массы тела более чем на 10% за последние 3-6 мес, субфебрилитет, недомогание, слабость, ночные обильные поты, кожный зуд, слабость, анорексия.
2.навязчивый непродуктивный кашель, синдром верхней полой вены, охриплость голоса, дисфагия, диспноэ
3.наличие болей в животе, увеличение объема живота
4.наличие болей в костях, спине, патологические переломы
5.сроки и темпы увеличения лимфоузлов. Основным симптомом является лимфоаденопатия, увеличение лимфоузлов происходит постепенно, ассиметрично
Физикальное обследование:
1.Увеличение лимфоузлов. Лимфоузлы безболезненные плотные подвижные, без признаков воспаления, часто в виде конгломератов. В 90% случаев инициально увеличиваются наддиафрагмально расположенные группы лимфоузлов, в 60-80% шейные, до 60% медиастинальные. Могут быть увеличены над- и подключичные, аксиллярные лимфоузлы, любые группы внутрибрюшных, паховые.
2.Экстранодулярные очаги
-прорастание в плевру, легкие, трахею, пищевод и развитие соответствующих симптомов, чаще плеврита; редко бывает перикардит
-спленомегалия: увеличение селезенки при ЛХ выявляется часто, но это не всегда происходит за счет ее поражения опухолью: при удалении селезенки очаги поражения выявляются в 26% случаев. При этом практически всегда бывают поражены лимфоузлы ворот селезенки и парааортальные лимфоузлы. Симптомы гиперспленизма не развиваются даже при выраженной спленомегалии
-поражение ЦНС может развиться в далеко зашедших случаях ЛХ, симптоматика обусловлена сдавлением в месте локализации опухоли;
-поражение костей - чаще поражаются позвонки, тазобедренные суставы;
-вовлечение костного мозга встречается в 5-10% случаев ЛХ и диагностируется при обнаружении очагов лимфогранулематозной ткани с единичными клетками Ходжкина и БШР при гистологическом исследовании костного мозга, полученного при трепанобиопсии.
3. Паранеопластические симптомы - феномен гемофагоцитоза, который может быть причиной цитопении;
-тромбоцитопеническая пурпура с типичной клинической презентацией;
-Кумбс-позитивная гемолитическая анемия;
-системный васкулит.
ДИАГНОСТИКА
1.Клинический анализ крови: умеренный нейтрофильный лейкоцитоз и лимфопения, увеличение СОЭ встречается практически у всех больных. Могут быть умеренная эозинофилия и тромбоцитоз, что не имеет прямого диагностического значения.
2.Биохимический анализ крови: мочевина, креатинин, общий белок, общий билирубин и его фракции, АЛТ, АСТ, ЛДГ, ЩФ, глюкоза, электролиты, гамма-глобулин и альфа2-глобулин.
3.Определение группы крови и резус-фактора.
4.Коагулограмма, иммуноглобулины A, G, M.
5.Вирусологическое исследование: определение антител к варицелла-зостер, ЭБВ, ЦМВ, ВИЧ, вирусу простого герпеса, токсоплазмозу, гепатиту A, B, C (HCV-PCR).
6.Ультразвуковое исследование периферических лимфоузлов и органов брюшной полости дает информацию о наличии увеличенных лимфоузлов, инфильтратов в паренхиматозных органах. Лимфоузлы диаметром менее 1 см считаются непораженными, лимфоузлы диаметром 1-2 см требуют динамического наблюдения в процессе терапии, лимфоузлы диаметром более
2см считаются пораженными.
7.Рентгенография грудной клетки проводится в двух проекциях – прямой и боковой, позволяет выявить увеличение лимфоузлов средостения, инфильтраты в легких, их величину и расположение, степень смещения органов грудной клетки, наличие выпота в плевральные полости, перикард. 8. Трепанобиопсия подвздошной кости из 1-2-х точек, кроме IA и IIA стадий болезни, проводится под общей анестезией.
9.Биопсия периферического лимфоузла, наиболее диагностически информативного и наиболее удобно расположенного. Патоморфологическое, иммуногистохимическое, цитогенетическое, микробиологическое исследование полученного материала.
10.Компьютерная томографияс контрастным усилением грудной клетки, брюшной полости, полости малого таза - необходимый компонент обследования для стадирования процесса.
11.Магнитно-резонансная томография используется для выявления поражения костной системы и ЦНС при необходимости.
12.Методы радиоизотопной диагностики полезны для подтверждения
наличия костных поражений при наличии показаний (боли, переломы) 13. Позитронно-эмиссионная томография с использованием 18F-
флуородеоксиглюкозы – может применяться при инициальном стадировании заболевания, для оценки результатов лечения и статуса ремиссии, установления рецидива ЛХ. Диагностические полостные операции – торакоскопия/томия, лапароскопия/томия с биопсией внутригрудных,
внутрибрюшных л/у или печени проводятся только при отсутствии увеличенных периферических лимфоузлов и невозможности верификации диагноза.
14. Функциональные исследования • ЭКГ, ЭХО-КГ • ЭЭГ (необязательно) • Подросткам должна предлагаться возможность криопрезервации спермы и, по возможности, криоконсервация ткани яичника.
Лечение.
Общими условиями лечения пациента с лимфомой Ходжкина являются:
•проведение полихимиотерапии в соответствии со стадией и группой риска в специализированном стационаре с соблюдением принципов сопроводительной терапии;
•обеспечение адекватного венозного доступа, в том числе ЦВК;
•обеспечение адекватной трансфузионной поддержки эритроцитарной и тромбоцитарной массой;
•обеспечение колониестимулирующими факторами (Г-КСФ);
•адекватная антибактериальная терапия в случаях нейтропенической лихорадки (см ниже);
•соблюдение профилактических мер - уход за ротовой полостью (полоскание полости рта 4 р в день дезинфицирующими растворами), гигиена кожи (ежедневное мытье под душем или обтирание водным раствором хлоргексидина), строгая личная гигиена родителей, мытье рук персонала.
•проведение лучевой терапии в специализированных радиологических центрах
В зависимости от диагностированной стадии больные должны быть отнесены в одну из терапевтических групп:
-Группа 1 – I A/B, II A
Химиотерапия 2 цикла OE*PA
Лучевая терапия в дозе 20 Гр. на первично пораженные области
-Группа 2 – I EA/B, II EA, II B,III A
Химиотерапия 2 цикла OE*PA и 2 цикла COPDAC
Лучевая терапия в дозе 20 Гр. на первично пораженные области
- Группа 3 – II EB, III EA/B, III B, IV AB 15
Химиотерапия 2 цикла OE*PA и 4 цикла COPDAC
Лучевая терапия в дозе 20 Гр. на первично пораженные области
При наличии остаточной опухоли, объемом более 100 мл – доза лучевой терапии увеличивается до 30 Гр.
При необходимости облучения печени или почек СОД не должна превышать 15 Гр, легких – 12 Гр.
Лучевая терапия должна начинаться в течение 25 дней от окончания химиотерапии при восстановленных показателях гемопоэза
OE*PA
Преднизолон 60 мг/м 2 /сут р.о. на 3 приема 1-15 Винкристин 1,5 мг/м 2 (макс. 2 мг) в/в стр. 1,8,15 Доксорубицин 40 мг/м 2 1-6 час. инфузией 1,15 Этопозид 125 мг/м 2 1-2 час. инфузией 1-5
COPDAC
Преднизолон 40 мг/м 2 /сут р.о. на 3 приема 1-15 Винкристин 1,5 мг/м 2 (макс. 2 мг) в/в стр. 1,8 Дакарбазин 250 мг/м 2 30 мин. инфузией 1,2,3 Циклофосфамид 500 мг/м 2 1-час. инфузией 1,8
13.Миеломная болезнь: классификация, клиника, диагностика, лечение. 2016
Множественная миелома (ММ) - это злокачественная опухоль, морфологическим субстратом которой являются плазматические клетки, продуцирующие моноклональный иммуноглобулин.
•Классификация:
Варианты плазмоклеточной миеломы:
•Вялотекущая миелома
•Тлеющая миелома
•Остеосклеротическая миелома (POEMS синдром)*
•Плазмоклеточный лейкоз
•Несекретирующая миелома
•*POEMS - полинейропатия, органомегалия, эндокринопатия, М-
компонент, кожные изменения.
I.Клинико-анатомическая (рентгенологическая):
1)диффузно-очаговые формы ММ 60% (остеопороз, очаговые поражения костей);
2)диффузные формы (24%);
3)множественно-очаговые формы (15%);
4)склерозирующая форма
5)солитарная миелома
6)висцеральные формы
7)первично лейкемическая форма
8)скрыто протекающая миелома
9)редкие формы (1%).
II.Международная классификация
(Durie, Salmon, 1975)
Стадия I: опухолевая масса менее 0,6х1012 кл/м2
Критерии - совокупность:
--гемоглобин выше 100 г/л;
--кальций сыворотки меньше 3 ммоль/л;
--R- нормальная структура костной ткани или солитарный очаг;
--уровень продукции М-компонента:
а) IgG менее 50 г/л б) IgA менее 30 г/л
в) экскреция ЛЦ с мочей менее 4 г/сут;
•Стадия II: Средняя опухолевая масса (0,6-1,2х1012 клеток/м2).
•Критерии:
промежуточное значение показателей между величинами I и III стадий
•Стадия III: масса опухоли более 1,2х1012 кл/м2)
Критерии: любой из признаков:
•-- гемоглобин ниже 85 г/л;
•-- кальций сыворотки более 3 ммоль/л;
•-- Rлогически - выраженная остеодеструкция;
•-- уровень продукции М-компонента:
•а) IgG более 70 г/л
•б) IgA более 50 г/л
•в) экскреция ЛЦ с мочей более 4 г/сут;
•Подстадия А: без ПН (креатинин сыв. < 20 мг/л)
•Подстадия Б: с ПН (креатинин сыв. > 20 мг/л)
III.Иммунохимическая классификация
типы парапротеина крови / мочи и ЛЦ:
1.IgG (53%),
2.IgA (25%),
3.IgD (2%),
4.IgE
5.Бенс-Джонса.
Редкие варианты: IgM и несекретирующая миелома.
По скорости роста миеломы выделяют:
•быстрорастущие плазмоцитомы (фракция роста - 20-50%)
•медленнорастущие плазмоцитомы (фракция роста - 5-10%).
Клиническая картина *1. Костные поражения
•генерализованный остеопороз с участками остеолиза,
•патологические переломы локализация поражения: череп, таз, ребра, позвонки
*2. Миеломная нефропатия
выявляется у половины больных
•упорная протеинурия
•ХПН
1. гиперпродукция и гиперэкскреция МЛЦ Ig
2. отложения парапротеинов в виде амилоидных фибрилл и/или гранул ЛЦ в сосудах почек, БМК, интерстиции;
*3. Висцеральные изменения
• гепато- и спленомегалия
Развиваются у 10% больных не имеют большой прогностической значимости
*4. Неврологические осложнения
-Первичные (распространения процесса на спинной мозг или корешки)
-Вторичные (гиперкальциемия, повышенная вязкость, параамилоидоз)
•у 10-30% больных - компрессия спинного мозга или поражение
конского хвоста
*5. Гипервискозный синдром
повышенный уровнь патологического Ig и повышение вязкости крови
•кровоточивость слизистых (носовые, десневые)
•ретинопатия (до полной потери зрения)
•нарушения периферического кровотока
•парестезии
•синдром Рейно.
*6. Параамилоидоз
амилоидоз при ММ поражает
дерму, сухожилия, суставы, сосуды, мышцы, сердце, язык
•диагностика параамилоидоза - биопсия кожи, слизистой полости
рта, прямой кишки, мышц...
•*7. Гиперкальциемия
вследствие резорбции костей
•потеря аппетита, тошнота, рвота, сонливость, тубулярные нарушения
•*8. Нарушения гемостаза
повышение вязкости крови
•тромбоцитопения
•тромбоцитопатия
•нарушение плазменного звена гемостаза
*9. Инфекционные осложнения
•пневмония (золотистый стафилококк, Streptococcus pneumoniae, Klebsiella pneumoniae)
•пиелонефрит (грамотрицательные микроорганизмы)
Диагностика. Для постановки диагноза ММ необходимо иметь критерии:
При установлении диагноза симптоматической ММ должны присутствовать следующие критерии:
1.Плазматические клетки в костном мозге 10% и более и/или плазмоклеточная опухоль в биопсийном материале пораженной ткани.
2.Моноклональный белок в сыворотке крови и/или в моче (за исключением пациентов с несекретирующей ММ).
3.Один или более следующих признаков поражения органов или тканей, связанных с плазмоклеточной пролиферацией:
• гиперкальциемия (> 11,5 мг/дл [> 2,65 ммоль/л]),
• почечная недостаточность (креатинин > 2 мг/дл [> 177 мкмоль/л]),
• анемия (Hb < 10 г/дл или на 2 г/дл ниже нормального уровня Hb),
• поражение костей (остеолитические поражения, остеопороз или патологические переломы). К другим симптомам, наиболее часто сопровождающих ММ, относят амилоидоз, рецидивирующие инфекции чаще
2раз за 12 месяцев, синдром гипервязкости крови.
•Клиническое обследование: - Сбор анамнеза:
-Физикальный осмотр, в т.ч. пальпация всех доступных пальпации групп периферических лимфатических узлов, печени, селезенки.
- Определение статуса по ECOG
•Лабораторные методы исследования:
-Развернутый клинический анализ крови с исследованием гемоглобина, подсчетом лейкоцитарной формулы.
-Общий анализ мочи.
-Биохимический анализ крови (ЛДГ, мочевая кислота, мочевина, креатинин, общий белок, альбумин, билирубин, АСТ, АЛТ, щелочная фосфатаза, калий, кальций).
-Определение скорости клубочковой фильтрации (СКФ)
-Определение β2-микроглобулина в сыворотке.
-Коагулограмма.
-Электрофорез и иммунофиксация белков сыворотки крови с количественным определением уровня М-градиента.
-Определение уровня иммуноглобулинов сыворотки крови для оценки степени гуморального иммунодефицита.
-Электрофорез и иммунофиксация белков суточной мочи с количественным определением уровня моноклонального белка.
-Определение группы крови, резус-фактора
-Определение маркеров вирусных гепатитов В и С, ВИЧ.
-Морфологическое исследование аспирата костного мозга и/или трепанобиоптата, при отсутствии его поражения – морфологическое исследование биоптата опухолевой ткани.
• Методы лучевой диагностики - Рентгенография костей, включая: череп, грудную клетку, все отделы
позвоночника в двух проекциях, таз, плечевые и бедренные кости
- Компьютерная томография костей (КТ) рекомендуется при болях в костях при отсутствии патологии на рентгенограммах
• Магнитно-резонансная томография (МРТ) показана при подозрении на компрессию спинного мозга, для уточнения характера и размеров мягкотканого компонента, исходящего из пораженной кости. Выполнение МРТ целесообразно при бессимптомной ММ, так как позволяет в ряде случаев выявить невидимые на рентгенограммах очаги поражения костей, наличие которых можно предположить клинически.
Лечение.
Системная химиотерапия цитостатики алкилирующего ряда курсами ч/з 6 недель
•мельфалан 0,15 мг/кг внутрь (моноэффект 50%)
•+ преднизолон 20-40 мг/день (эффективность - 75%)
•7 дней (циклофосфан или реже хлорбутин)
Моложе 60 лет с удовлетворительным соматическим статусом трансплантация аутологичного костного мозга
•или стволовых клеток периферической крови
•Высокие дозы мельфалана (200 мг/м)
•общее облучение тела + альфа-интерферон (в постоперационном периоде на фоне химиотерапии)
•солитарная костная или экстрамедуллярная плазмоцитома - локальная лучевая терапии (курсовая доза 40 - 50 Гр)
Симптоматическая терапия
•Борьба с осложнениями ММ
•Коррекции гиперкальцемии (солевые р-ры, стимуляция кальцийуреза фуросемидом - до 3-4 л мочи/сутки
•Глюкокортикоиды (преднизолон 50-100 мг/сут)
•Средства подавляющие активность остеокластов (митрамицин 15 мкг/кг/сут курсом до 4 суток, кальцитонин, длительно дихлорометан)
•Борьба с повышенной вязкостью и ОПН – плазмаферез
(уменьшает белковую нагрузку на почки, улучшает функцию)
•Профилактика инфекций
•парентерально гамма-глобулина
•При возникшей инфекции
•полнодозная терапии антибиотиками широкого спектра
•солитарная костная или экстрамедуллярная плазмоцитома - локальная лучевая терапии (курсовая доза 40 - 50 Гр)
14.Полицитемия: клиника, диагностика, лечение.
Эритремия является миелопролиферативным заболеванием, хрони¬ческим, доброкачественно текущим лейкозом, при котором наблюдается повышенное образование эритроцитов, а также нейтрофильных лейкоци¬тов и тромбоцитов. Источник опухолевого роста — клетка-предшественни¬ца миелопоэза.
Этиология. Причины развития заболевания неизвестны.
Патогенез. В основе заболевания лежит опухолевая пролиферация всех трех ростков кроветворения — красного, гранулоцитарного и мегакариоцитарного, однако доминирует рост красного ростка. В связи с этим основным субстратом опухоли являются созревающие в избыточном коли¬честве эритроциты. Появляются очаги кроветворения в селезенке и пече¬ни. Увеличенное количество эритроцитов и тромбоцитов в периферичес¬кой крови снижает скорость кровотока, повышает вязкость и свертывае¬мость крови, что обусловливает появление ряда клинических симптомов. Классификация. Учитывают стадию течения процесса, вовлечение в патологический процесс селезенки и последующую трансформацию эрит-ремии в другие заболевания системы крови.
Стадия I — начальная: содержание гемоглобина на верхней границе нормы, небольшое увеличение массы циркулирующих эритроцитов, селе-зенка увеличена незначительно или без изменений. АД нормальное или слегка повышено, очаговая гиперплазия костного мозга в трепанате из подвздошной кости.
Стадия II — развернутая: фаза А — без миелоидной метаплазии се-лезенки (простой вариант плеторы без спленомегалии). Тотальная трех-ростковая гиперплазия костного мозга. Отсутствие экстрамедуллярного гемопоэза; фаза Б — с миелоидной метаплазией селезенки. Большой мие-лопролиферативный синдром: панцитоз в периферической крови, в кост-ном мозге имеется панмиелоз с очаговым миелофиброзом или без него, миелоидная метаплазия селезенки с фиброзом или без него.
Стадия III — терминальная: перерождение доброкачественной опу-холи в злокачественную (миелофиброз с анемизацией, хронический мие-лолейкоз, острый лейкоз). Миелофиброз развивается практически у всех, болеющих более 10—15 лет; он отражает естественную эволюцию болезни. Признаком миелофиброза является цитопения (анемия, тромбоцитопения, реже — лейкопения). Развитие хронического миелолейкоза проявляется нарастанием лейкоцитоза, увеличением (или появлением) в периферичес¬кой крови клеток гранулоцитарного ряда (миелоцитов, промиелоцитов), а также обнаружением в клетках крови и костного мозга Ph-хромосомы.
Клиническая картина. Эритремия проявляется двумя большими син¬дромами.
Плеторический синдром обусловлен увеличенным содержанием эритроцитов, а также лейкоцитов и тромбоцитов (плетора — полнокровие). Этот синдром складывается из: 1) субъективных синдромов, 2) нару¬шений сердечно-сосудистой системы, 3) сдвигов в лабораторных показа¬телях.
1.К субъективным симптомам плеторического синдрома относятся: головные боли, головокружения, нарушение зрения, стенокардические боли, кожный зуд, эритромелалгия (внезапное возникновение гиперемии с синюшным оттенком кожи пальцев рук, сопровождающееся резкими боля¬ ми и жжением), возможны ощущения онемения и зябкости конечностей.
2.Нарушения сердечно-сосудистой системы проявляются в измене¬ нии окраски кожных покровов и видимых слизистых оболочек по типу эритроцианоза, особенности окраски слизистой оболочки в месте перехода мягкого неба в твердое (симптом Купермана), АГ, развитии тромбоза, реже кровоточивости. Помимо тромбозов, возможны отеки голеней и эрит¬ ромелалгия. Нарушения кровообращения в артериальной системе могут приводить к тяжелым осложнениям: острому инфаркту миокарда, инсуль¬ там, нарушению зрения, тромбозу почечных артерий.
3.Сдвиги в лабораторных показателях определяются главным обра¬
зом при клиническом анализе крови: отмечаются увеличение содержания гемоглобина и эритроцитов, повышение показателя гематокрита и вязкос-ти крови, умеренный лейкоцитоз со сдвигом лейкоцитарной формулы влево, тромбоцитоз, резкое замедление СОЭ.
Миелопролиферативный синдром обусловлен гиперплазией всех трех ростков кроветворения в костном мозге и экстрамедуллярно. Он включа-ет: 1) субъективные симптомы, 2) спленомегалию и(или) гепатомегалию, 3) изменения лабораторных показателей.
1.К субъективным симптомам относятся слабость, потливость, по¬ вышение температуры тела, боли в костях, тяжесть или боль в левом под¬ реберье (вследствие спленомегалии).
2.Спленомегалия (увеличение селезенки) объясняется не только мие-
лоидной метаплазией органа (появление очагов экстрамедуллярного кро¬ ветворения), но и застоем крови. Реже наблюдается увеличение печени. 3. Среди изменений лабораторных показателей наибольшее диагнос¬ тическое значение имеют нарушения в периферической крови в виде пан-
цитоза, чаще со сдвигом лейкоцитарной формулы влево; при трепанобиопсии выявляется трехростковая гиперплазия костного мозга, в пунктате се¬ лезенки — очаги миелоидной метаплазии органа.
На I этапе диагностического поиска в начальной стадии заболева-ния больные могут не предъявлять никаких жалоб. По мере прогрессиро-вания болезни жалобы связаны с наличием и выраженностью плеторы и миелопролиферативного процесса. Наиболее часты жалобы «плеторического» характера, обусловленные повышенным кровенаполнением сосудов и функциональными нейрососудистыми расстройствами (головные боли, эритромелалгия, нарушение зрения и пр.). Вся эта симптоматика может быть связана и с другими заболеваниями, что необходимо выяснить при дальнейшем обследовании больного.
Жалобы, обусловленные наличием миелопролиферативного синдрома (потливость, тяжесть в левом подреберье, боли в костях, повышение температуры тела) также неспецифичны для эритремии. Достаточно характе-рен кожный зуд, который появляется после приема водных процедур. Этот симптом наблюдается у 55 % больных в развернутой стадии и объяс¬няется гиперпродукцией базофилов и гистаминемией. Аналогична природа крапивницы, наблюдающейся у 5 —7 % больных.
На II этапе диагностического поиска можно выявить отчетливые симптомы лишь во II (развернутой) стадии болезни. Обнаруживают в ос-новном признаки плеторического синдрома: эритроцианоз, инъецирован-ные сосуды конъюнктивы («кроличьи глаза»), отчетливая цветовая грани-ца в месте перехода твердого неба в мягкое. Можно выявить симптомы эритромелалгии: отек кончиков пальцев, стоп, нижней трети голени, со-провождающийся локальной гиперемией и резким жжением.
При исследовании сердечно-сосудистой системы диагностируют АГ и увеличение левого желудочка, в развернутой стадии болезни — «пестрые ноги» — изменение кожных покровов голеней (преимущественно дистальной их части) в виде различной интенсивности участков пигментации, обу¬словленных нарушением венозного кровообращения.
При пальпации живота можно обнаружить увеличение селезенки, что является одним из характерных признаков болезни. Увеличение селезенки может быть обусловлено: 1) повышенным депонированием элементов крови;
2) «рабочей» гипертрофией вследствие увеличения ее секвестри¬рующей функции; 3) экстрамедуллярным кроветворением (миелоидная метаплазия с преобладанием эритропоэза). Эти причины часто сочетают¬ся. Обнаруживаемое иногда увеличение печени также обусловлено анало¬гичными причинами, а также развитием фиброза и хронического холецис¬тита (неспецифический реактивный гепатит). Следует иметь в виду, что гепатомегалия может наблюдаться при злокачественной опухоли печени с развитием вторичного эритроцитоза.
Осложнения эритремии в виде тромбозов сосудов головного мозга вы¬ражаются рядом очаговых симптомов, выявляемых при исследовании ЦНС.
Однако и на II этапе поставить окончательно диагноз эритремии нель-зя, так как многие ее симптомы могут встречаться при симптоматических эритроцитозах. Кроме того, отдельно взятые симптомы, такие как АГ, спленомегалия и гепатомегалия, характерны для самых разнообразных заболеваний.
В связи с этим III этап диагностического поиска приобретает ре-шающее значение, так как позволяет: а) поставить окончательный диа¬гноз; б) уточнить стадию эритремии; в) выявить осложнения; г) осущест¬вить контроль за лечением.
Анализ периферической крови обнаруживает эритроцитоз, увеличе¬ние содержания гемоглобина и показателя гематокрита, что, однако, встречается и при симптоматических эритроцитозах. Для диагноза значе¬ние имеет сочетание повышения уровня гемоглобина с эритроцитозом, лейкоцитозом и тромбоцитозом. При исследовании лейкоцитарной форму¬лы обнаруживают нейтрофилез и иногда незрелые гранулоциты. Если из¬менения в периферической крови незначительны или данные неубедитель¬ны (например, эритроцитоз не сочетается с тромбоцитозом), то необходи¬мо провести исследование костного мозга (трепанобиопсия). Наличие в трепанате тотальной трехростковой гиперплазии костного мозга с преобла¬данием эритропоэза, замещение жировой ткани красным костным мозгом дают возможность поставить окончательный диагноз. Расширение «плац¬дарма» кроветворения выявляется также с помощью радионуклидного сканирования костей с 32Р. Гистохимическое исследование выявляет повышенную активность щелочной фосфатазы нейтрофилов.
Исходами болезни являются ситуации, указанные в III стадии тече¬ния болезни (миелофиброз, хронический миелолейкоз, острый лейкоз, анемия).
Диагностика. Эритремию можно заподозрить у лиц с наличием стой-кого эритроцитоза в сочетании с нейтрофильным лейкоцитозом, тромбоци-тозом при отсутствии заболеваний (или состояний), которые могли бы вы¬звать эритроцитоз.
Диагностическими критериями эритремии (в развернутой стадии) яв-ляются:
•увеличение числа эритроцитов в крови (более 61О12/л у мужчин и
5,71012/л у женщин);
•увеличение содержания НЬ (более 177 г/л для мужчин и более 172 г/л для женщин);
•увеличение показателей гематокрита (52 % для мужчин и 48 % для женщин);
увеличение массы циркулирующих эритроцитов; лейкоцитоз более 12109/л (при отсутствии явных причин для по¬явления лейкоцитоза); тромбоцитоз более 400-109/л; увеличение абсолютного числа базофилов в крови; увеличение селезенки;
нормальное насыщение артериальной крови кислородом (более 92 %); трехростковая пролиферация в костном мозге (по данным трепано-биопсии) с вытеснением из него жира;
• нормальное содержание эритропоэтина в крови. Лечение
В развернутой стадии болезни при наличии плеторического синдро¬ма, но без лейко- и тромбоцитоза применяют кровопускания как самостоятельный метод терапии. Извлекают по 400 — 500 мл крови за один раз через день (в условиях стационара) или через 2 дня (в условиях поликлиники). Для профилактики тромбозов (разви¬вающихся в результате кровопускания) назначают ацетилсалицило¬вую кислоту в дозе 0,5— 1 г/сут накануне и в день кровопускания, а также в течение 1 — 2 нед после окончания кровопусканий. Кроме ацетилсалициловой кислоты, назначают и другие дезагреганты — дипиридамол (курантил), тиклоридин (тиклид), трентал одновре¬менно с аспирином. Перед кровопусканием целесообразно ввести внутривенно 400 мл реополиглюкина, а также 5000 ЕД гепарина (через иглу Дюфо). При плохой переносимости кровопусканий, на¬блюдаемой у лиц с выраженным атеросклерозом мозговых сосудов, ограничиваются эксфузией 300 мл (2 раза в неделю). При крово¬пусканиях необходимо снизить гемоглобин до 150 г/л, а показа¬тель гематокрита до 42 — 47 %.
Если кровопускания недостаточно эффективны, а также при фор-мах болезни, протекающих с панцитозом и спленомегалией, назна¬чают цитостатическую терапию. Возраст больных более 55 лет расширяет показания к применению цитостатиков. Косвенными пока-заниями к цитостатической терапии являются и другие признаки миелопролиферативного синдрома (зуд), а также
тяжесть заболева-ния, висцеральные сосудистые осложнения (инсульт, инфаркт мио-карда), истощение.
Противопоказаниями к цитостатической терапии являются молодой возраст больных, рефрактерность к лечению на предыдущих этапах, а также чрезмерно активная в прошлом цитостатическая терапия из-за опа¬сения перехода заболевания в фазу анемии. Эффект цитостатической те¬рапии следует оценивать через 3 мес после окончания лечения; это объяс¬няется тем, что продуцированные до лечения эритроциты живут в среднем около 2
— 3 мес. Снижение количества лейкоцитов и тромбоцитов наступа¬ет значительно раньше, соответственно срокам их жизни. Критерием эф¬фективности цитостатической терапии является достижение гематологи¬ческой ремиссии (полной, когда все показатели крови нормализуются, или частичной, при которой остается несколько повышенным количество эритроцитов, лейкоцитов и/или тромбоцитов).
Из цитостатических препаратов на первом этапе обычно назначают гидроксимочевину (гидреа) под контролем периферической крови (1 раз в 2 нед). Препарат обладает незначительным мутагенным эффектом: под его воздействием не отмечено увеличения частоты развития лейкозов. Ле¬чение гидроксимочевиной следует проводить постоянно, так как с точки зрения эффективности этот препарат уступает другим препаратам (алки-лирующим агентам — миелосан, миелобромол и др.) по силе воздействия на эритроидный росток; кроме того, при лечении гидроксимочевиной про¬должают кровопускания. Однако если этот препарат не дает достаточного эффекта, то используют группу алкилирующих препаратов. Из всего арсе¬нала препаратов этой группы предпочтение отдается нитрозомочевине (препарат назначается курсами до 1 мес и вводится внутривенно), так как при длительном использовании ранее применявшихся алкилирующих пре¬паратов отмечался несколько более частый исход эритремии в ОЛ. Тем не менее миелосан и миелобромол остаются в арсенале врача при лечении эритремии.
Весьма существенно, что рецидивы заболевания следует лечить тем же цитостатиком, который вызвал ремиссию. Назначение нового препара¬та должно происходить при неэффективности предшествующего лечения или появлении нового качества болезни (например, развитие ХМЛ).
Болезни почек
1. Острый гломерулонефрит: этиология, патогенез, клиника, диагностика, лечение.
Острый гломерулонефрит (ОГН) — острое диффузное заболе-вание почек, развивающееся на иммунной основе и первично локализую-щееся в клубочках. Возникает вследствие различных причин (чаще всего после перенесенной кожной инфекции), обычно заканчивается выздоров-лением, но иногда приобретает хроническое течение.
При морфологическом исследовании (световая, иммунофлюоресцент-ная и электронная микроскопия) выявляется картина пролиферативного гломерулонефрита. Наблюдаются пролиферация мезангиальных и эндотелиальных клеток, иногда эпителия капсулы клубочка, а также инфильтра-ция нейтрофилами. Отмечаются отек и очаговая лейкоцитарная инфильт-рация почечной интерстициальной ткани, дистрофия и атрофия канальце-вого эпителия.
Этиология. В происхождении ОГН четко прослеживается значение инфекции: острых ангин и фарингитов, вызванных так называемыми неф-ритогенными штаммами стрептококков. Основное значение имеет р-гемо-литический стрептококк группы А (особенно типы 12, 49); его выявляют у 60 — 80 % больных. В настоящее время возросла роль вирусной инфекции. Примерно в V3 случаев этиологию ОГН установить не удается («немотиви¬рованное» начало).
Возникновению заболевания способствует резкое охлаждение тела, особенно в условиях повышенной влажности.
Вакцинация является одним из факторов развития ОГН, причем в 3/4 случаев поражение почек возникает после 2-й или даже 3-й инъекции вак-цины. После стрептококковых инфекций латентный период, предшест-вующий развитию симптомов болезни, составляет 2 — 3 нед. При остром охлаждении или парентеральном введении белка заболевание развивается в ближайшие дни после воздействия патогенного фактора.
Патогенез. Патогенез гломерулонефрита в настоящее время связыва-ют с иммунными нарушениями. В ответ на попадание в организм инфек-ции к антигенам стрептококка появляются антитела, которые, соединяясь со стрептококковым антигеном, образуют иммунные комплексы, активирующие комплемент. Эти комплексы вначале циркулируют в сосудистом русле, а затем откладываются на наружной поверхности базальной мембраны клубочковых капилляров, а также в мезангии клубочков.
Кроме антигенов бактериального происхождения, в образовании им-мунных комплексов могут принимать участие и другие экзогенные антиге-ны (лекарственные препараты, чужеродные белки и пр.). Иммунные ком-плексы фиксируются на базальной мембране в виде отдельных глыбок. Фактором, непосредственно вызывающим клубочковое поражение, явля-ется комплемент: продукты его расщепления вызывают локальные измене-ния стенки капилляров, повышают ее проницаемость. К местам отложения иммунных комплексов и комплемента устремляются нейтрофилы, лизосомные ферменты которых усиливают повреждение эндотелия и базальной мембраны, отделяя их друг от друга. Наблюдается пролиферация клеток мезангия и эндотелия, что способствует элиминации иммунных комплек-сов из организма. Если этот процесс оказывается достаточно эффектив¬ным, то наступает выздоровление. В случае, если иммунных комплексов много и
базальная мембрана существенно повреждается, то выраженная мезангиальная реакция будет приводить к хронизации процесса и разви¬тию неблагоприятного варианта болезни — подострого экстракапиллярно¬го гломерулонефрита.
Клиническая картина. Выделяют наличие и выраженность следую-щих основных синдромов: мочевого, гипертензивного, отечного.
Мочевой синдром: в моче появляются белок (протеинурия), формен-ные элементы (гематурия, лейкоцитурия), цилиндры (цилиндрурия).
Протеинурия связана с повышенной фильтрацией плазменных бел¬ков через клубочковые капилляры — это так называемая клубочковая (гломерулярная) протеинурия. Отложения иммунных комплексов могут вызывать локальные изменения капиллярной стенки в виде увеличения размеров «пор» базальной мембраны, что и обусловливает увеличенную проницаемость капилляров для белковых субстанций. Фильтрации (в частности, альбуминов) способствует также потеря отрицательного за-ряда базальной мембраной (в нормальных условиях отрицательный заряд мембраны отталкивает отрицательно заряженные молекулы, в том числе молекулы альбумина). Патогенез гематурии полностью неясен. Предполагают, что большое значение имеет вовлечение мезангия, а также поражение интерстициаль-ной ткани. Гематурия может зависеть от некротизирующего воспаления почечных артериол, почечной внутрисосудистой гемокоагуляции. Эритро¬циты проникают через мельчайшие разрывы базальной мембраны, изме¬няя свою форму. Лейкоцитурия не связана с инфекцией мочевых путей, при ОГН она обусловлена иммунным воспалением в клубочках и интерстициальной ткани почек. Обычно лейкоцитурия невелика, кроме того, при ОГН она наблюдается нечасто.Цилиндрурия — выделение с мочой белковых или клеточных обра-зований канальцевого происхождения, имеющих цилиндрическую форму и разную величину. Зернистые цилиндры состоят из плотной зернистой массы, образуются из распавшихся клеток почечного эпителия; их на¬личие свидетельствует о дистрофических изменениях в канальцах. Вос-ковидные цилиндры имеют резкие контуры и гомогенную структуру. Гиалиновые цилиндры являются белковыми образованиями; предполага-ют, что они образованы гликопротеином, который секретируется в ка-нальцах.
Гипертонический синдром обусловлен тремя основными механизма-ми: 1) задержкой натрия и воды; 2) активацией ренин-ангиотензин-аль- достероновой, а также симпатико-адреналовой систем; 3) снижением функции депрессорной системы почек.
Отечный синдром связывают со следующими факторами: 1) сниже-нием клубочковой фильтрации вследствие поражения клубочков; умень-шением фильтрационного заряда натрия и повышением его реабсорбции; 2) задержкой воды вследствие задержки в организме натрия; 3) увеличе-нием
объема циркулирующей крови и развитием так называемого отека крови (Е.М. Тареев), что может способствовать развитию острой сердеч-ной недостаточности; 4) вторичным гиперальдостеронизмом; 5) повыше-нием секреции АДГ и увеличением чувствительности дистальных отделов нефрона к нему, что приводит к еще большей задержке жидкости; 6) по-вышением проницаемости стенок капилляров, что способствует выходу жидкой части крови в ткани; 7) снижением онкотического давления плаз-мы при массивной протеинурии.
На I этапе диагностического поиска выясняют обстоятельства, предшествующие появлению жалоб. Эти жалобы, к сожалению, малоспецифичны и встречаются при самых различных заболеваниях. Часть из них все же позволяет предположить заболевание почек, особенно если эти жалобы появляются через 1 — 2 нед после перенесенной ангины, обострения хронического тонзиллита, переохлаждения, введения вакцин или сыворот-ки. Вместе с тем некоторые больные могут не предъявлять никаких жалоб. Заболевание у них выявляют совершенно случайно или вообще не диагностируют. Так, некоторые больные могут отмечать уменьшение выделения мочи в сочетании с некоторой отечностью (пастозность) лица. При появлении отеков снижение суточного диуреза более заметно. Дизурические расстройства (болезненное частое мочеиспускание) наблюдаются лишь в10— 14 % случаев, у ряда больных они служат основанием для неправиль-ной диагностики инфекции мочевыводящих путей.
Боли в поясничной области несильные, ноющие, возникают в первые дни болезни и выявляются у 1/3 всех больных. Механизм болей связан, ве-роятно, с увеличением размеров почек. Длительность болей вариабельна: у некоторых больных они держатся несколько недель, на что обращают внимание врача сами больные.
Другие симптомы: повышенная утомляемость, головная боль, одышка при физической нагрузке, кратковременное повышение температуры тела до субфебрильной — наблюдаются с различной частотой и не имеют се¬рьезного диагностического значения. Однако выраженная головная боль, сильная одышка в сочетании с дизурией, уменьшением выделения мочи при соответствующих анамнестических данных достаточно убедительно указывают на возможность развития ОГН.
На II этапе диагностического поиска можно не выявить никаких патологических признаков. У части больных обнаруживают отеки (чаще под глазами, особенно по утрам) до анасарки, асцита и гидроторакса. Время появления отеков самое разное: чаще всего они появляются позднее 3-го дня болезни и весьма редка — в 1-й день. Другой характерный признак ОГН — артериальная гипертензия, ко-торая выявляется лишь у половины больных. Высота подъема АД обычно составляет 140—160/85 — 90 мм рт.ст., лишь редко достигая 180/100 мм рт.ст.В ряде случаев обнаруживают признаки
остро развивающейся недо-статочности кровообращения в виде одышки, умеренного расширения гра-ниц сердца и глухости тонов сердца, застойных (влажные мелкоиузырча-тые, незвонкие) хрипов в нижних отделах легких, увеличения печени. Причины недостаточности кровообращения следующие: 1) увеличение объема циркулирующей крови вследствие задержки натрия и воды; 2) внезапное повышение АД до значительных цифр; 3) метаболические изменения миокарда.
III этап диагностического поиска является наиболее важным в диа-гностике ОГН, так как независимо от клинического варианта у всех боль-ных выявляется мочевой синдром. Особенно важен этот этап для больных с моносимптомным течением болезни, так как только наличие мочевого синдрома позволяет поставить диагноз заболевания почек.
При исследовании мочи в 100 % случаев диагностируются протеинурия различной степени выраженности и гематурия, несколько реже лейкоцитурия и цилиндрурия — у 92 —97 % больных. Для диагноза, кроме протеинурии, большое значение имеет гематурия. Выраженность гематурии варьирует: наиболее часто отмечается микрогематурия (до 10 эритроцитов в поле зрения у 35 % больных), макрогематурия в настоящее время крайне редка (7 % случаев).
В однократной порции мочи можно не обнаружить эритроцитов, в связи с чем при подозрении на ОГН необходимо, кроме серии повторных исследований, провести исследование мочи по Нечипоренко (определение количества форменных элементов в 1 мкл). Относительная плотность мочи при ОГН обычно не меняется, однако в период нарастания отеков она может повышаться.
У части больных выявляются острофазовые показатели воспаления (повышение содержания фибриногена и а2-глобулина, СРВ, увеличениеСОЭ). Количество лейкоцитов в крови меняется мало. Отмечается уме-ренная анемия (обусловлена гиперволемией). При неосложненном тече-нии ОГН содержание в крови азотистых веществ (креатинин, индикан, мочевина) не изменяется.
Иммунологические показатели свидетельствуют о наличии в крови циркулирующих иммунных комплексов, повышенном содержании анти-О- стрептолизина, антигена к стрептококку, снижении содержания комплемента. Однако эти исследования не являются обязательными для диагностики ОГН.
В начальной фазе болезни наблюдается изменение пробы Реберга — снижение клубочковой фильтрации и повышение канальцевой реабсорб-ции, нормализующейся по мере выздоровления.
При рентгенологическом исследовании у больных с выраженной артериальной гипертензией может отмечаться умеренное увеличение левого желудочка, который принимает прежние размеры по мере выздоровления больного.
Достаточно часто на ЭКГ выявляются изменения конечной части желудочкового комплекса в виде снижения амплитуды и инверсии зубца Т (преимущественно в левых грудных отведениях). Они возникают вследст-вие острого перенапряжения миокарда артериальной гипертензией, а также в результате метаболических нарушений.
Пункционная биопсия почки показана при затяжном течении заболе-вания, когда возникает необходимость в проведении активной терапии (кортикостероиды, цитостатики).
Лечение. В комплекс лечебных мероприятий входят: 1) режим; 2) дие¬та; 3) лекарственная терапия.
•Режим. При выраженной клинической картине больной должен быть госпитализирован. Назначают строгий постельный режим до ликвидации отеков и нормализации АД, в среднем на 2 —4 нед. Пребывание в постели обеспечивает равномерное согревание тела, что приводит к уменьшению спазма сосудов и снижению АД, а также к увеличению клубочковой фильтрации и диуреза. В стацио¬ наре больной находится 4 — 8 нед, в зависимости от полноты ликви¬ дации основных симптомов болезни. Домашнее лечение продлевают до 4 мес со дня начала заболевания (даже при спокойном течении ОГН). Такое длительное лечение является лучшей профилактикой перехода ОГН в хронический гломерулонефрит.
•Диета. Основное правило — ограничение жидкости и поваренной соли в зависимости от выраженности клинической симптоматики. Общее количество выпитой воды за сутки должно равняться объему выделенной за предыдущие сутки мочи плюс 300 — 500 мл. Больно¬ го переводят на диету с ограничением белка (до 60 г/сут), общее количество соли — не более 3 — 5 г/сут. Такую диету следует со-
блюдать до исчезновения всех внепочечных симптомов и резкого улучшения мочевого осадка.
♦ Медикаментозное лечение ОГН. Этиологическая терапия показана при установлении причины заболевания, ее профилактический эффект на развитие ОГН не доказан (C). При наличии очага инфекции или острого инфекционного заболевания назначают антибиотики внутрь. Устранение хронических инфекций, в том числе ассоциированных с MRSA способствует более быстрому разрешению нефрита. При стрептококковой инфекции — пенициллин V внутрь по 500000 ЕД 6-8 раз в сутки (детям 25-90тыс ЕД/кг/сутки) 5-7 дней, безопасен при беременности (B), но необходима оценка преимуществ и риска; амоксициллин 500–750 мг внутрь 2 раза в сутки 5–7 дней (B), цефалексин по 750–500 мг 2 раза в сутки 10 дней (детям по 50 мг/кг/сут в два приёма 10 дней) (B), в стационаре при наличии персистирующей инфекции – бензилпенициллин по 0,5–1 млн ЕД 6 раз в сутки в/м 10 дней. При синуситах, пневмонии препараты выбора — амоксициллин 500–750 мг внутрь 2 раза в сутки 5–7 дней (B), доксициклин при остром бронхите 150 мг 1 раз в сутки 5–7 дней (A), цефаклор 500 мг 2 раза в сутки 7 дней (детям 40 мг/кг/сут в 2 приёма 7 дней) (B). При аллергии на беталактамные антибиотики назначают ЛС из группы макролидов: эритромицин 250 мг 4 раза в сутки 10 дней (B), азитромицин 250–500 мг 1 раз в сутки 4 дня (B), рокситромицин 150 мг 2 раза в сутки 7 дней (B).
Симптоматическая терапия. Антигипертензивная терапия: При АГ — ингибиторы АПФ/БРА в качестве монотерапии или в сочетании с блокаторами кальциевых каналов недигидропиридинового ряда или пролонгированных форм дигидропиридинового ряда. Диуретики при АГ: фуросемид (лазикс) 20-40 мг, при неэффективности на дозе 40 мг назначить другой препарат, детям 0.5-1 мг/кг; при отёках 40-80 мг внутрь с повышением дозы на 20-40 мг через каждые 6 час до эффективного диуреза (не более 200 мг за 1 прием), затем дозу можно повторять. Иммунодепрессанты и глюкокортикоиды при ОГН не используют; эффективность антигистаминных ЛС, препаратов кальция, аскорбиновой кислоты, рутина и антиаггрегантов в контролируемых исследованиях не доказана.Хронический гломерулонефрит: этиология, клинические формы, диагностика.
2. Хронический гломерулонефрит: этиология, клинические формы, диагностика.
Хронический гломерулонефрит – группа заболеваний, протекающих с рецидивирующей и устойчивой гематурией, изолированной протеинурией, нефротическим и хроническим нефритическим синдромами. Нефротический синдром характеризуется тяжелой протеинурией (>3,5г/сут), гипоальбуминемией (альбумин сыворотки 5%), умеренные отеки/или
артериальную гипертензию, продолжающиеся в течение длительного времени.
Характеризуется первичным поражением клубочкового аппарата с последующим вовлечением остальных структур почки и прогрессирующим течением, в результате чего развиваются нефросклероз и почечная недостаточность. В зависимости от преимущественной локализации и характе¬ра изменений в нефроне выделяют несколько основных морфологических вариантов ХГН. Морфологические особенности ХГН накладывают отпечаток на клинические проявления болезни, однако полного параллелизма между ними нет.
ХГН может быть самостоятельным заболеванием или одним из прояв-лений какого-либо другого (например, инфекционного эндокардита, СКВ, геморрагического васкулита). В последнем случае может создаться трудная для правильной диагностики ситуация, когда поражение почек выступает на первый план в картине болезни при отсутствии или минимальной выражен¬ности других признаков системного заболевания. В то же время присоединение почечной патологии может сгладить ранее яркую картину основного заболевания. Эти ситуации могут быть обозначены как «нефритические маски» различных заболеваний. ХГН в 10 — 20 % случаев развивается как исход ОГН. Заболевание чаще встречается у лиц молодого возраста.
Классификация:
По клиническим формам. Латентная форма (изменения только в моче; периферические отёки отсутствуют, АД не повышено) — до 50% случаев хронического ГН. Гематурическая форма — болезнь Берже, IgA-нефрит (рецидивирующая гематурия, отёки и АГ у 30–50% пациентов) — 20–30% случаев хронического ГН. Гипертоническая форма (изменения в моче, АГ) — 20–30% случаев. Нефротическая форма (нефротический синдром — массивная протеинурия, гипоальбуминурия, отёки, гиперлипидемия; АГ нет)
— 10% случаев хронического ГН. Смешанная форма (нефротический синдром в сочетании с АГ и/или гематурией и/или азотемией) — 5% случаев хронического ГН. По фазам. Обострение (активная фаза, рецидив) — появление нефритического или нефротического синдрома. Ремиссия (неактивная фаза) — улучшение или нормализация экстраренальных проявлений (отёков, АГ), функций почек и изменений в моче. По патогенезу. Первичный ГН (идиопатический). Вторичный ГН, ассоциированный с общим или системным заболеванием, устанавливается при выявлении причинного заболевания (системная красная волчанка, ревматоидный артрит, болезнь Шонляйн-Геноха, бактериальный эндокардит и другие)
Этиология. Этиологические факторы могут быть такие же, как и при ОГН, — инфекционные (бактериальные, вирусные, паразитарные), а также некоторые неинфекционные агенты. Связь ХГН с инфекцией осо¬бенно четко видна при инфекционном эндокардите (ИЭ), когда массивная антибиотическая терапия
приводит к излечению ИЭ и ХГН (или ремиссии). Среди вирусов особенно часто выявляется вирус гепатита В, причем поражение почек может не сочетаться с вирусным гепатитом или циррозом печени.
Патогенез. Отмечают два возможных механизма поражения почек: иммунокомплексный и антительный. Иммунокомплексный механизм при ХГН аналогичен описанному при ОГН. ХГН развивается в тех случаях, когда ги¬перплазия эндотелия и мезангиальных клеток оказывается недостаточной и иммунные комплексы не удаляются из почки, что приводит к хроническому течению воспалительного процесса. Развитие ХГН обусловливается также и антительным механизмом: в ответ на внедрение в организм различных антигенов иммунокомпетентная система вырабатывает антитела, тропные к 6а-зальной мембране капилляров, которые фиксируются на ее поверхности. Происходит повреждение мембраны, и ее антигены становятся чужеродны¬ми для организма, в результате чего вырабатываются аутоантитела, которые также фиксируются на базальной мембране. Комплемент оседает на мембра¬не в зоне локализации комплекса аутоантиген — аутоантитело. Далее про¬исходит миграция нейтрофилов к базальной мембране. При разрушении нейтрофилов выделяются лизосомные ферменты, усиливающие поврежде¬ние мембраны. Одновременно происходит активация свертывающей систе¬мы, что усиливает коагулирующую активность и отложение фибрина в зоне расположения антигена и антитела. Выделение тромбоцитами, фиксирован¬ными в месте повреждения мембраны, вазоактивных веществ усиливает про¬цессы воспаления. Хроническое течение процесса обусловливается постоян¬ной выработкой аутоантител к антигенам базальной мембраны капилляров. Кроме иммунных механизмов, в процессе прогрессирования ХГН принима¬ют участие и неиммунные механизмы, среди которых следует упомянуть по¬вреждающее действие протеинурии на клубочки и канальцы,
снижение син¬теза простагландинов (ухудшающее почечную гемодинамику), артериаль¬ную гипертензию (ускоряющую развитие почечной недостаточности), неф-ротоксическое действие гиперлипидемии.
Длительный воспалительный процесс, текущий волнообразно (с пе-риодами ремиссий и обострений), приводит в конце концов к склерозу, ги-алинозу, запустеванию клубочков и развитию хронической почечной недостаточности.
Для диагностики ГН абсолютно необходима биопсия почки – позволяет определить морфологический тип (вариант) ГН, единственным исключением является стероидчувствительный НС у детей, когда диагноз устанавливается клинически, биопсия у таких пациентов остается в резерве на случай атипичного НС (ГН KDIGO, 2012). На амбулаторном этапе необходимо заподозрить ГН и направить пациента в нефрологическое отделение для проведения биопсии и установления окончательного диагноза ГН. Однако при отсутствии или ограниченной возможности проведения биопсии диагноз
ГН устанавливается клинически. Диагностика ГН на амбулаторном этапе Жалобы на головную боль, потемнение мочи, отеки или пастозность ног, лица или век. Могут быть жалобы на тошноту, рвоту, головную боль. ОГН следует заподозрить при впервые развившемся нефритическом синдроме (С) ― появлении через 1–3 нед после стрептококковой или другой инфекции триады симптомов: гематурии с протеинурией, АГ и отёков. При позднем обращении к врачу (через неделю от начала и позже) возможно обнаружение изменений только в моче без отеков и АГ (С). Изолированная гематурия при постинфекционном нефрите разрешается в течение 6 мес. При ХГН выявляется один из клинико-лабораторных синдромов (мочевой, гематурический, гипертонический, нефротический, смешанный). При обострении появляются или нарастают отеки век/нижних конечностей, уменьшение диуреза, потемнение мочи, повышение АД, головная боль; при латентном ХГН клинических проявлений заболевания может не быть. В ремиссию клинические проявления и жалобы могут отсутствовать. Для IgA нефрита, как и для ОГН, характерна гематурия, однако стойкая микрогематурия более типична для IgA нефропатии. При IgA нефрите инкубационный период чаще короткий ― менее 5 дней. При ХГН в отличие от ОГН, выявляется гипертрофия левого желудочка; ангиоретинопатия II–III степени; признаки ХБП. Для БПГН характерно острое начало с нефритического, нефротического или смешанного синдромов, прогрессирующее течение с появлением в течение первых месяцев заболевания признаков почечной недостаточности. Клинические проявления заболевания неуклонно нарастают; присоединяются азотемия, олигоанурия, анемия, никтурия, резистентная артериальная гипертензия, сердечная недостаточность. Прогрессирование до терминальной почечной недостаточности возможно в течение 6-12 мес, при эффективности лечении возможно улучшение прогноза. Анамнез и физикальное обследование В анамнезе возможны указания на перенесенную стрептококковую (фарингит) или другую инфекцию за 1–3 нед до обострения. Причиной ГН могут быть геморрагический васкулит, хронический вирусный гепатит В и С, болезнь Крона, синдром Шёгрена, анкилозирующий спондилоартрит, карциномы, неходжкинская лимфома, лейкозы, СКВ, сифилис, филяриатоз, малярия, шистосомоз, ЛС (препараты золота и ртути, пеницилламин, циклоспорин,
НПВП, рифампицин); криоглобулинемия, интерферон-альфа, болезнь Фабри, лимфопролиферативная патология; серповидноклеточная анемия, отторжение почечного трансплантата, хирургическое иссечение части почечной паренхимы, пузырномочеточниковый рефлюкс, приём героина, дисгенезии нефронов, ВИЧ-инфекция. В тоже время ГН может быть и идиопатическим. При ХГН в анамнезе могут выявляться симптомы/синдромы ХГН (отеки, гематурия, АГ). Физикальное обследование позволяет обнаружить клинические симптомы нефритического синдрома: моча цвета «кофе», «чая» или «мясных помоев»; отеки на лице, веках, ногах; повышение АД, симптомы левожелудочковой сердечной недостаточности. ХГН нередко выявляют случайно по изменениям в анализе
мочи. У части больных ХГН впервые выявляется на поздних стадиях ХБП. Температура тела обычно нормальная, cимптом Пастернацкого отрицательный. При вторичном ГН могут выявляться симптомы заболевания, послужившего причиной ХГН. При ХГН, впервые выявленном на стадии ХПН, выявляются симптомы уремического синдрома: сухая бледная кожа с желтоватым оттенком, расчесы, ортопное, гипертрофия левого желудочка. Лабораторно-инструментальные исследования. Позволяют подтвердить диагноз ГН С При ОГН и обострении ХГН в ОАК умеренное повышение СОЭ, которое может быть значительным при вторичном ГН. Анемия выявляется при гидремии, аутоиммунном заболевании или ХБП III–V cтадии. Биохимическое исследование крови: при постстрептококковом ОГН повышен титр антистрептококковых АТ (антистрептолизина-О, антистрептокиназы, антигиалуронидазы), при ХГН повышается редко. Гипокомплементемия С3–компонента, в меньшей степени С4 и общего криоглобулина иногда выявляется при первичном, постоянно при волчаночном и криоглобулинемическом нефритах. Повышение титра IgA при болезни Берже, Ig G — при вторичных ГН при СЗСТ. Повышены концентрации С-реактивного белка, сиаловых кислот, фибриногена; снижены
—общего белка, альбуминов, особенно — при нефротическом синдроме. В протеинограмме гипер-α1- и α2-глобулинемия; при нефротическом синдроме
—гипо-γ-глобулинемия; при вторичных ГН, обусловленных системными заболеваниями соединительной ткани — гипер- γ-глобулинемия. Снижение СКФ, повышение в плазме крови концентрации креатинина и/или мочевины
—при ОПП или ХБП. При вторичном ГН выявляются специфические для первичного заболевания изменения в крови: при волчаночном нефрите — антинуклеарные АТ, умеренное увеличение титра АТ к ДНК, LE-клетки, антифосфолипидные АТ. При ХГН, ассоциированном с вирусными гепатитами С, В — положительные НВV, НСV, криоглобулинемия; при мембранопролиферативном и криоглобулинемическом ГН повышен уровень смешанных криоглобулинов. При синдроме Гудпасчера выявляются антитела к базальной гломерулярной мембране. В моче при обострении: повышение осмотической плотности, снижение суточного объема; в осадке измененные эритроциты от единичных до закрывающих все поле зрения; лейкоциты — в меньшем количестве, но могут преобладать над эритроцитами при волчаночном нефрите, нефротическом синдроме, при этом представлены преимущественно лимфоцитами; цилиндры; протеинурия от минимальной до 1–3 г/сут; протеинурия более 3 г/сут развивается при нефротическом синдроме. Посев с миндалин, крови иногда позволяют уточнить этиологию ОГН (С). Специальные исследования. Биопсия почки — золотой стандарт диагностики ХГН. Показания к нефробиопсии: уточнение морфологической формы ГН, активности, дифференциальная диагностика. УЗИ почек проводится, чтобы исключить очаговые заболевания почек, обструкцию мочевых путей: при ГН почки симметричные, контуры гладкие, размеры не изменены или уменьшены (при ХБП), эхогенность повышена. ЭКГ: признаки гипертрофии левого желудочка при ХГН с АГ.
3. Современная терапия хронического гломерулонефрита.
Лечение ХГН. Методы лечения больных ХГН определяются клиническим вариантом, особенностями морфологических изменений в почке, прогрессированием процесса, развивающимися осложнениями. Общими при лечении являются следующие мероприятия: 1) соблюдение определенного режима; 2) диетические ограничения; 3) лекарственная терапия.
Соблюдение режима питания, диеты, следование определенному об-разу жизни являются обязательными для всех больных, тогда как лекар-ственная терапия показана не всем больных ХГН. Это означает, что дале-ко не каждому больному, у которого выявлена ХГН, следует спешить на-значать лекарственные препараты.
•Режим определяется клиническими проявлениями болезни. При ХГН следует избегать охлаждения, чрезмерного физического и пси¬ хического утомления. Категорически запрещается ночная работа.
Один раз в год больной должен быть госпитализирован. При про¬ студных заболеваниях больного следует выдержать на домашнем режиме и при выписке на работу сделать контрольный анализ мочи.
•Диета зависит от формы ХГН. При ХГН с изолированным мочевым
синдромом можно назначить общий стол, но при этом следует ограничить прием соли (до 10 г/сут). При ХГН гипертонического и нефротического типов количество соли снижается до 8—10 и даже до б г/сут при нарастании отеков.
• Медикаментозное лечение ХГН. Эффективность этиологической терапии (воздействия на инфекция, опухоли, ЛС) в достижении ремиссии или снижении частоты рецидивов в контролируемых исследованиях изучена недостаточно, у отдельных пациентов при четкой зависимости рецидивов ГН от обострения очаговой инфекции допустима антимикробная терапия инфекций, удаление очага инфекции (тонзиллярных миндалин), опухоли, но данные меры улучшают ближайший прогноз (ускоряют достижение ремиссии), но не влияют на отдаленный прогноз (прогрессирование ХГН) (D). Иммуносупрессивная терапия (глюкокортикоиды и цитостатики) направлена на подавление активности ГН. Симптоматическая терапия назначается при показаниях: антигипертензивные ЛС (ингибиторы АПФ/БРА), антиагреганты, антикоагулянты, гиполипидемические ЛС. Иммуносупрессивная терапия. Обычно при активных ГН назначается комбинированная иммуносупрессивная терапия (глюкокортикоиды с цитостатиками), особенно показана при активных формах ГН с высоким риском прогрессирования почечной недостаточности (C). Цитостатики при активном ГН назначаются в
средних/высоких дозах ежедневно или в двойной дозе через день в течение 1,5-2 мес., до снижения активности заболевания; затем доза снижается вдвое от исходной и лечение продолжается до ремиссии (с отменой препарата или переходом на поддерживающую противорецидивную терапию). Цитостатики
вкачестве монотерапии назначаются при противопоказаниях к глюкокортикоидам, их неэффективности или появлении побочных эффектов (в последнем случае возможно cочетанное применение, позволяющее снизить дозу глюкокортикоидов). Циклофосфамид 2–3 мг/кг/сут в/м или в/в назначают: при отсутствии эффекта от ГК или при частых рецидивах стероидозависимого ГМИ (2,С), или хлорамбуцил 0,1–0,2 мг/кг/сут внутрь в течение 6–8 нед; альтернативные препараты — циклоспорин 2,5–3,5 мг/кг/сут внутрь (A) (отсутствии эффекта от ГК при ФСГС при ИГА нефрите уменьшает протеинурию и уровень циркуляции IgA, но повышает уровень креатинина и приводит к рецидиву ГН вскоре после прекращения терапии); азатиоприн по 1,5–3 мг/кг/сут внутрь; микофенолат мофетил: ограниченные данные об эффективности при прогрессирующей IgA нефропатии, небольшой эффект или его отсутствие по сравнению с преднизолоном или плацебо (C). Пульс-терапию циклофосфамидом проводят при высокой активности ГН в дозе 15 мг/кг (или 0,6–0,75 г/м2 поверхности тела) в/в 1 раз
вмесяц, обычно сочетая с глюкокортикоидами в виде пульстерапии или пероральной терапии. Производные аминохинолина: хлорохин, гидроксихлорохин — убедительных данных об эффективности нет, контролируемые исследования не проводились. Назначаются при отсутствии показаний к активной терапии, при склерозирующих формах по 0,25–0,2 г внутрь 2 раза в день в течение 2 нед, затем 1 раз в день. Глюкокортикоиды в комбинированной терапии показаны при обострении ГН (A); в качестве монотерапии показаны при МПГН и ГМИ (2,С). При МГН эффект глюкокортикоидов нечёткий. При МКГН и ФСГС глюкокортикоиды малоэффективны. Противопоказаны при стабильной АГ и ХПН (индуцируют нефросклероз). Преднизолон внутрь назачается в дозе 1–1,5 мг/кг/сут в течение 6–8 нед с последующим снижением по на 1/3 или до 2030 мг/сут и дальнейшим медленным снижением по 2,5–1,25 мг/нед вплоть до отмены или поддерживающей дозы (5-10 мг) при вторичных ГН и иногда – при НС. Лечение нефротического синдрома у детей преднизолоном в течение 3 мес более эффективно в предупреждении рецидивов, чем короткие курсы (B). Преднизолон «пульсами» назначают при высокой активности ГН в начале лечения в дозе 1000 мг в/в капельно 1 раз в сутки 3 дня подряд или через день; после снижения активности ГН возможно ежемесячное проведение пульс-терапии вплоть до ремиссии. Длительная ежемесячная пульс-терапия особенно показана при вторичных ГН, ассоциированных с системным заболеванием соединительной ткани.
Многокомпонентные схемы. Преимущества многокомпонентных схем по сравнению с изолированной иммуносупрессивной терапией цитостатиками в контролируемых исследованиях не изучены. Кортикостероиды,
циклофосфамид, микофенолат-мофетил отдельно или в комбинации показаны при аутоиммунно-опосредованных ГН (C). Кортикостероиды, рыбий жир, микофенолат мофетил эффективны при ИГА-нефропатии (C). Стероиды, дипиридамол, азатиаприн показаны при МПГН или ГН, ассоциированном с гепатитом (C). Рыбий жир, принимаемый при ИГАнефрите до 2 лет, замедляет снижение почечной функции (C). Стероиды, тонзилэктомия, рыбий жир и ИАПФ при ИГА-нефрите – эффективность дискуссиона. Дипиридамол и ацетилсалициловая кислота эффективны при МПГН (C). Трёхкомпонентная схема (ГКС или цитостатики с гепарином и антиагрегантами): преднизолон в дозе 1–1,5 мг/кг/сут внутрь 4–6 нед, затем 1 мг/кг/сут через день, далее снижают дозу на 1,25–2,5 мг/нед вплоть до отмены, или циклофосфамид по 200 мг в/в ежедневно или двойная доза через день в течение 1–2 мес, затем половинная доза до достижения ремиссии (циклофосфамид можно заменить хлорамбуцилом или азатиоприном); гепарин по 5000 ЕД 4 раза в сутки в течение 1–2 мес с переходом на фениндион или ацетилсалициловую кислоту по 0,25–0,125 г/сут или варфарин 10 мг/сут внутрь; дипиридамол по 400 мг/сут внутрь, в/в. Четырёхкомпонентная схема Кинкайд–Смит: преднизолон по 25–30 мг/сут внутрь в течение 1–2 мес, затем снижение дозы на 1,25–2,5 мг/нед вплоть до отмены; циклофосфамид по 200 мг в/в ежедневно или двойная доза через день в течение 1–2 мес, затем половинная доза до достижения ремиссии (циклофосфамид можно заменить хлорамбуцилом или азатиоприном); гепарин по 5000 ЕД 4 раза в сутки в течение 1–2 мес с переходом на фениндион (ацетилсалициловую кислоту); дипиридамол по 400 мг/сут внутрь или в/в. Схема Понтичелли: начало терапии с преднизолона — 3 дня подряд в дозе 1 г/сут, следующие 27 дней в дозе 30 мг/сут внутрь, 2-й месяц — хлорамбуцил в дозе 0,2 мг/кг. Лечение проводят 6 мес. Схема Стейнберга: пульс-терапия циклофосфамидом — 1 г в/в ежемесячно в течение года; в последующие 2 года — 1 раз в 3 мес; в последующие 2 года — 1 раз в 6 мес.
Симптоматическая терапия. Антигипертензивная терапия АГ должна включать ЛС, уменьшающие внутриклубочковую гипертензию и гиперфильтрацию и замедляющие прогрессирование ХПН, т.е., обладающие нефропротективным эффектом. Ингибиторы АПФ(A) оказывают нефропротективное действие – снижают внутриклубочковое давление и уменьшают протеинурию: эналаприл 5–40 мг/сут, лизиноприл 10 мг/сут, беназеприл 10 мг/сут, рамиприл 2,5–5 мг/сут, периндоприл 2–4 мг/сут, трандалоприл 1-2 мг/1 раз в сутки, зофеноприл по 7,5-30 мг 1 раз в сутки, фозиноприл 10–20 мг 1–2 раза в сутки. Блокаторы АT1рецепторов оказывают нефропротективное действие: лозартан 50-100 мг 1 раз в сутки, валсартан 80-160 мг 2 раза в сутки, кандесартан 16-32 мг/сутки, ирбесартан 150-300 мг 1 мг 1 раз в сутки, телмисартан 40-80 мг 1 раз в сутки, эпросартан 400-800 мг/сутки. Блокаторы кальциевых каналов назначаются только в комбинации с ИАПФ или с блокаторами АT1рецепторов вторым препаратом: верапамил 120–320 мг/сут, дилтиазем 160–360 мг/сут,
амлодипин 2,5-10 мг/сут, лерканидипин по 10-20 мг/сут. Селективные β- адреноблокаторы применяются в комбинированной терапии с ИАПФ или блокаторами АT1рецепторов: метопролол 50–100 мг/сут, небивалол 5 мг 1 раз в сутки, карведилол 12,5-25 мг 2 раза в сутки. Гиполипидемические ЛС уменьшают протеинурию (C). ЛС назначают при гиперлипидемии (нефротический синдром, ХГН, ХПН). Наиболее выраженным гиполипидемическим эффектом обладают статины (C): симвастатин 40 мг/сутки, аторвастатин 20-40 мг/сут, розувастатин 10-40 мг/сут в течение 4–6 нед с последующим снижением дозы до минимально эффективной, позволяющей контролировать гиперлипидемию. Диуретики при отёках и комбинированной терапии при АГ — гидрохлоротиазид, фуросемид, индапамид, спиронолактон. Антикоагулянты, антиагреганты, антиоксиданты. Убедительных данных об эффективности антиоксидантов (витамин E, рыбий жир) нет. Антикоагулянты — убедительных данных об эффективности нет. Назначаются в сочетании с глюкокортикоидами и цитостатиками: Гепарин по 5000 ЕД 4 раза в сутки п/к не менее 1–2 мес, перед отменой дозу снижают за 2–3 дня. Надропарин кальция по 0,3–0,6 мл 1–2 раза в сутки п/к. Антиагреганты — убедительных данных об эффективности монотерапии нет, контролируемые исследования по применению в составе многокомпонентных схем единичные. Роль аспирина и дипиридамола неясная (C), показаны при противопоказаниях или резистентности к кортикостероидам и исключении гепатита (C) при идиопатическом МПГН у взрослых с высоким риском прогрессирования в ХПН: дипиридамол по 400– 600 мг/сут, пентоксифиллин по 0,2–0,3 г/сут, тиклопидин по 0,25 г 2 раза в сутки, ацетилсалициловая кислота по 0,25–0,5 г/сут. В отдельных наблюдениях комбинация аспирина 375 мг/день и дипиридамола 225 мг/день в течение 1 года уменьшала показатель снижения клубочковой фильтрации и частоту прогрессирования в ТХПН без различия в исходах через 10 лет, а комбинация циклофосфана с варфарином и дипиридамолом в течение 3 лет
(C) и циклофосфана в течение 6 мес с варфарином и дипиридамолом в течение 2 лет (C) способствовали выраженному снижению протеинурии. Плазмаферез — эффект в контролируемых исследованиях не доказан. Применяется в сочетании с пульс-терапией преднизолоном и/или циклофосфамидом при высокоактивных ГН и отсутствии эффекта от лечения преднизолоном и циклофосфамидом. Ультрафильтрация, гемодиализ — при БПГН, ХБП. Хирургическое лечение. Эффективность тонзилэктомии на благоприятный исход ОГН в клинических испытаниях не доказана. При взаимосвязи рецидивов ХГН с обострениями тонзиллита — тонзилэктомия, хотя эффективность не доказана. При терминальной ХБП — трансплантация почки.
4. Амилоидоз почек: этиология, классификация, клиника, диагностика, лечение.
Амилоидоз – группа заболеваний, отличительным признаком которых является отложение в тканях и органах фибриллярного гликопротеида – амилоида.
Амилоид является сложным гликопротеидом, в котором фибрилляр-ные и глобулярные белки тесно связаны с полисахаридами.
В настоящее время в зависимости от этиологии выделяют несколько форм амилоидоза, имеющих свойственный им биохимический состав ами-лоидных фибрилл.
Первичный (идиопатический) амилоидоз развивается без видимых причин и поражает различные органы (сердце, почки, ки¬шечник, печень, нервную систему). Биохимическая форма первичного амилоидоза — AL-форма, предшественником такого амилоида являются Ig и легкие цепи иммуноглобулинов. По структуре амилоида и характеру поражения внутренних органов к первичному (идиопатическому) амилои-дозу близок амилоидоз при миеломной болезни, который в настоящее время выделяется в отдельную группу.
Наследственный (генетический) амилоидоз проявля¬ется преимущественным поражением почек, сочетанием поражения почек и нервной системы. В нашей стране наследственный амилоидоз обычно связан с периодической болезнью, которая передается по аутосомно-доми-нантному типу. При этом заболевании амилоидоз может быть единствен¬ным проявлением. Биохимическая форма наследственного амилоидоза — AF (предшественником амилоида является преальбумин). В случае перио¬дической болезни биохимическая форма — АА (предшественником явля¬ется белок SAA).
Приобретенный (вторичный) амилоидоз встречается наиболее часто и развивается при ревматоидном артрите, болезни Бехте-рева, туберкулезе, хронических нагноениях — остеомиелите, бронхоэкта-тической болезни, хроническом абсцессе легкого, реже — при неспеци-фическом язвенном колите, псориазе, лимфогранулематозе, сифилисе, опухолях почки, легкого и др. Биохимическая форма вторичного амилои-доза — АА (его сывороточный предшественник — белок SAA, синтезируе-мый гепатоцитами).
Старческий амилоидоз — результат инволютивных нару¬шений обмена белка, обнаруживается в головном мозге, поджелудочной железе, сердце. Биохимическая формула — AS (предшественником явля¬ется преальбумин).
Локальный амилоидоз развивается без видимых причин, его биохимическая формула — АЕ (предшественник неизвестен).
В почках амилоид откладывается в мембране клубочковых капилля-ров и канальцев нефрона, в мезангии, капиллярных петлях и по ходу ар-териол. По мере накопления амилоида большинство нефронов атрофиру-ется, погибает или замещается соединительной тканью — возникает ами-лоидно- сморщенная почка. Этот процесс можно представить в виде сле-дующей схемы:
протеинурия -> нефротический синдром -> почечная недостаточность.
Соответственно этому в клинической картине выделяют три стадии: 1) начальную (протеинурическую); 2) развернутую (нефротическую); 3) терминальную (азотемическую).
Клиническая картина. Проявления амилоидоза разнообразны и опре¬деляются: 1) локализацией амилоида в том или ином органе; 2) степенью выраженности отложений амилоида в органе; 3) основным заболеванием, на фоне которого развился амилоид (при вторичной форме амилоидоза).
При диагностике могут возникнуть затруднения, обусловленные тем, что клинические проявления болезни будут заметны лишь при определен-ном количестве отложившегося амилоида. В связи с этим неизбежен «латентный» период от момента отложения амилоида до появления симпто-мов нарушения функционирования органа или системы.
Клиническая картина особенно яркая при поражении почек — наиболее частой локализации отложений амилоида.
На I этапе диагностического поиска в начальной стадии практи-чески никакой информации, свидетельствующей о поражении почек ами-лоидозом, получить не удается. Жалобы больных связаны с основным за-болеванием (при вторичном амилоидозе).
В анамнезе имеются сведения о наличии того или иного заболевания (туберкулез легких, остеомиелит, ревматоидный артрит и пр.), его течении, проводившейся терапии. Сами по себе эти сведения не позволяют диагностировать амилоидоз почек, но обращают внимание врача на такую возможность.В развернутой стадии амилоидоза больные предъявляют жалобы, обусловленные развитием нефротического синдрома, на уменьшение коли¬чества мочи, отеки различной распространенности и выраженности, а также жалобы на слабость, отсутствие аппетита, снижение работоспособ¬ности. Наряду с ними при вторичном амилоидозе остаются жалобы на проявление основного заболевания.
В терминальной стадии жалобы вызваны развивающейся хронической почечной недостаточностью: снижение аппетита, тошнота, рвота (диспепсические расстройства), головные боли, нарушение сна (нарушения нерв-ной системы), кожный зуд.
Диагностические критерии Жалобы:
·слабость, повышенная утомляемость;
·головная боль;
·отеки на ногах, руках и лице;
·повышенное артериальное давление;
·тошнота, диарея (понос);
·боли в области сердца;
·боли в мышцах.
Анамнез:
·потеря веса;
·наличие моноклональной гаммапатии неясного генеза;
·хронические воспалительные (гнойные) заболевания;
·хронические инфекции;
·наследственность.
На II этапе диагностического поиска в ранней стадии могут обна-руживаться только симптомы, характерные для основного заболевания (при вторичном амилоидозе).
Вразвернутой стадии выявляют: 1) отеки различной ло-кализации и выраженности; при значительной задержке жидкости в орга-низме могут появляться гидроторакс, гидроперикард, преходящий асцит; 2) артериальную гипертензию (встречается у 12 — 20 % больных амилоидо-зом), дилатацию и гипертрофию левого желудочка; 3) увеличение печени и селезенки вследствие отложения в тканях амилоида (печень и селезенка плотные, безболезненные, с заостренным краем); 4) симптомы основного заболевания (при вторичном амилоидозе).
Втерминальной стадии симптоматика определяется выраженностью почечной недостаточности: 1) дистрофический синдром (изменения кожи и слизистых оболочек); 2) серозно-суставной синдром (остеоартропатии, вторичная подагра, сухой перикардит, плеврит); 3) ар-териальная гипертензия.
Физикальное обследование Общий осмотр:
·периорбитальная пурпура (наблюдается в 15% случаев);
·макроглоссия характерно для первичного амилоидоза (AL);
·одышка при физической нагрузке (наблюдается около 40% больных);
·признак наплечника (околосуставная инфильтрация амилоида приводит к ложной гипертрофии и к увеличению объема мускулатуры плечевого пояса и бедра).
Аускультация:
·возможно наличие нарушения сердечного ритма.
Пальпация:
·отеки нижних конечностей, из-за гипоальбуминемии и нефротического синдрома, а также из-за застоя в большом круге кровообращения вследствие рестриктивной кардиомиопатии (наблюдается в 50% случаев);
·увеличение печени и селезенки;
·парестезии (наблюдается около у 15% больных);
·спастические боли в ЖКТ;
·возможно наличие увеличения подчелюстных слюнных желез.
На III этапе диагностического поиска при амилоидозе получают наиболее значимую для постановки диагноза информацию, которую можно сгруппировать следующим образом: 1) мочевой синдром; 2) нару¬шения
белкового и липидного обмена; 3) обнаружение отложения амило¬идных масс.
Мочевой синдром: 1) протеинурия — важнейший симптом амилоидо-за, развивается при всех его формах, но наиболее часто при вторичном амилоидозе. Протеинурия обычно бывает значительной, за сутки выделя-ется 2 —20 г белка, основную часть которого составляют альбумины. В меньших количествах выделяются глобулины, возможно выведение с мочой сывороточного предшественника амилоида (белок SAA). В терми¬нальной стадии протеинурия сохраняется. В моче можно обнаружить а- и особенно у- гликопротеиды.
Соответственно степени протеинурии обнаруживают гиалиновые и реже зернистые цилиндры. Нечасто диагностируется микрогематурия или лейкоцитурия, однако выраженность ее не соответствует степени протеинурии (как это наблюдается при гломерулонефритах). Степени наруше¬ний липидного обмена при амилоидозе соответствует липоидурия с нали¬чием двоякопреломляющих кристаллов в осадке мочи.
Нарушения белкового и липидного обмена: 1) гипопротеинемия в сочетании с гипоальбуминемией и гипер-<Х2- и гипергаммаглобулинемией; 2) гиперхолестеринемия, гипертриглицеридемия, гипербеталипопротеиде-мия. Выраженная диспротеинемия и нарушения липидного обмена приво¬дят к значительному увеличению СОЭ и изменению осадочных проб (ти-моловая, сулемовая и др.).Большое значение для диагноза имеет обнаружение амилоидных масс в органах и тканях: в печени (50 % случаев), селезенке (при пункцион-ной биопсии), слизистой оболочке десны и прямой кишки.
В начальной стадии ( протеину рической) при биопсии слизистой обо-лочки десны чаще получают отрицательный, а прямой кишки — положи-тельный результат; в развернутой стадии (нефротической) в первом слу-чае результаты положительные у половины больных, а во втором — еще чаще.
Наконец, при хронической почечной недостаточности данные биопсии ткани десны положительны более чем в половине наблюдений, а слизи¬стой оболочки прямой кишки почти во всех случаях. Следовательно, био¬псию слизистой оболочки десны следует рекомендовать при далеко зашед¬шем процессе, а прямой кишки — в любой стадии амилоидоза.
При подозрении на идиопатический амилоидоз (протекает чаще с поражением сердца, периферических нервов, реже — почек) целесообразно прежде всего проводить биопсию слизистой оболочки десны, а при вторич¬ном (приобретенном) амилоидозе и наследственных его формах (протека¬ют с преимущественным поражением почек) — биопсию слизистой обо¬лочки прямой кишки.
Ряд других исследований помогает: 1) уточнить диагноз заболевания, на фоне которого развился амилоидоз; 2) оценить функциональное состо-яние почек (проба Реберга, Зимницкого, уровень креатинина крови).
Лабораторные исследования:
·общий анализ крови – анемия, лейкоцитоз, повышение СОЭ;
·общий анализ мочи – протеинурия, микрогематурия, асептическая лейкоцитурия;
·биохимический анализ крови (общий белок, альбумин, Na, Ca, холестерин, сахар в сыворотке крови) – гипопротеинемия (за счёт гипоальбуминемии), гиперглобулинемия, гипонатриемия, гипопротромбинемия, гипокальциемия, гиперхолестеринемия.
Инструментальные исследования:
· УЗИ органов брюшной полости и почек – визуализируются увеличенные уплотнённые почки (большие жировые почки).
Лечение. Все еще остается нерешенной проблема лечения амилоидо-за, так как не выяснены причины, приводящие к усилению амилоидогене-за и недостаточности его резорбции. Тем не менее возможно проведение серии лечебных мероприятий, улучшающих состояние больного. В настоя¬щее время лечение больного амилоидозом проводится с учетом: 1) воздей¬ствия на основное заболевание, на фоне которого развился амилоидоз (вторичный); 2) воздействия на механизмы патогенеза; 3) воздействия на основные клинические синдромы.
• Воздействие на основное заболевание, на фоне которого развивает¬ ся вторичный амилоидоз, необходимо ввиду того, что частые обо¬ стрения или высокая активность патологического процесса ведут к
прогрессированию амилоидоза.
Это воздействие заключается в следующем:
а) при хронических инфекциях (туберкулез, сифилис) необходима длительная специфическая терапия; б) при хронических неспецифических заболеваниях легких — ком¬
плексная терапия с применением антибиотиков, бронхиального дренажа, а при необходимости и оперативное вмешательство (например, при хрони¬ ческом абсцессе легкого); в) при системных заболеваниях соединительной ткани, например при
ревматоидном артрите, показана комплексная терапия, включающая на¬ значение базисных препаратов (D-пеницилламин, соли золота, аминохинолиновые препараты).
• Воздействие на механизмы патогенеза предполагает уменьшение синтеза амилоида:
а) ежедневный прием 80—120 г сырой печени в течение 6—12 мес приводит к снижению протеинурии, уменьшению размеров пече¬ ни и селезенки;
б) аминохинолиновые препараты (хингамин, или делагил, по 0,25 — 0,5 г в день в течение многих месяцев и даже лет) снижа¬ ют прогрессирование процесса. По-видимому, эти средства влия¬ ют на синтез амилоидных фибрилл. Лечение эффективно только в ранних стадиях амилоидоза; при далеко зашедшем процессе (развернутый нефротический синдром, почечная недостаточ¬ ность) назначение этих препаратов нецелесообразно;
в) при развитии амилоидоза вследствие периодической болезни ре¬ комендуется колхицин; г) при первичном амилоидозе назначают также мелфалан, угнетаю¬
щий функцию некоторых клонов лимфоцитов, в частности син¬

тезирующих легкие цепи иммуноглобулинов, участвующих в формировании амилоидной фибриллы (это имеет отношение и к амилоидозу, развивающемуся при миеломной болезни).
• Воздействие на основные клинические синдромы предусматривает ликвидацию отеков, АГ, а также мероприятия, направленные на борьбу с развивающейся почечной недостаточностью:
а) при развитии нефротического синдрома и выраженных отеков необходимо достаточное содержание в пище белка, снижение по¬ варенной соли, а также введение цельной крови или эритроцитной массы (особенно при наличии анемии), осторожное приме¬ нение мочегонных средств;
б) артериальная гипертензия нечасто встречается при амилоидозе, однако, когда она достигает высоких цифр, необходимо назначе¬ ние гипотензивных средств различного типа;
в) при развитии почечной недостаточности лечение проводится по общепринятому плану (ограничение белка в пище, достаточное введение жидкости, коррекция минерального обмена). При почечной недостаточности, обусловленной амилоидозом, возможно применение гемодиализа и трансплантации почек.
Лечение AL типа амилоидоза
Препараты |
Разовая доза |
Кратность введения |
||
|
|
|
||
Мелфалан* |
140-200мг/м2 |
Однократно |
||
Бортезомид |
1.3 мг/м2 |
2 |
раза в неделю по схеме |
|
Дексаметазон |
40 |
мг/сут |
1 |
раз в день внутрь или в/в по схеме |
|
|
|
|
|
Циклофосфамид |
10 |
мг/кг |
1 |
день в/в |
|
|
|
|
|
Талидомид* |
200 мг/сут |
1 |
раз в день желательно перед сном и не менее 1 часа |
|
|
|
|
после еды |
|
|
|
|
|
|
Леналидомид |
25 |
мг/сут |
1 |
раз в день по схеме |
Лечение АА типа амилоидоза
Препараты |
Разовая доза |
Кратность введения |
|
|
|
|
|
Инфликсимаб |
3-10 мг/сут |
1 |
раз в сутки в/в по схеме |
|
|
|
|
Этанерцепт |
50 мг |
1 |
раз в неделю п/к |
|
|
|
|

Анакинра* |
100 |
мг |
1 |
раз в день п/к |
|
|
|
|
|
Цанакинумаб |
150-300 мг |
1 |
раз в 4 недели п/к по схеме |
|
|
|
|
|
|
Рилонацепт* |
320 |
мг/сут |
По 160 мг п/к на разные участки |
|
Семейный вторичный амилоидоз
Препараты |
Разовая доза |
Кратность введения |
|
|
|
Колхицин* |
0,5- 0,6 мг |
2 раза в сутки |
|
|
|
Дифлунизал* |
250-500 мг |
Внутрь 2 раза в день |
Перечень дополнительных лекарственных средств:
Нефропротективная терапия – ингибиторы ангиотензин-превращающего фермента
Препараты |
Разовая доза |
Кратность введения |
||
|
|
|
||
Лизиноприл |
5 – 10 мг |
1- 2 раза |
||
Рамиприл |
5 – 10 мг |
1- 2 раза |
||
Фозиноприл |
5 – 10 мг |
1- 2 раза |
||
Периндоприл |
2,5 – 5 мг |
1- 2 раза |
||
|
|
|
|
|
Нефропротективная терапия – блокаторы ренин-ангиотензина II |
|
|
||
|
|
|
||
Лозартан |
50-100 мг |
1-2 раза |
||
Валсартан |
80-160 мг |
1-2 раза |
||
Кандесартан |
8 – 16 мг |
1-2 раза |
||
|
|
|
|
|
Диуретики |
|
|
|
|
|
|
|
|
|
Петлевые: |
1-3мг/кг/сут |
1 |
раз |
|
фуросемид |
||||
5-10 мг |
1 |
раз |
||
торасемид |
||||
|
|
|
||
Тиазидоподобные: гипотиазид |
25-100 мг |
1 |
раз |
|
индапамид |
||||
1,25-5 мг |
1 |
раз |
||
Антагонисты альдостерона |
||||
|
1 |
раз |
||
спиронолактон |
12,5-25мг/сут |
|||
|
|
|||
|
|
|
||
|
|
|
|
|
Антикоагулянты |
|
|
|
|
|
|
|
||
Гепарин натрия Надропарин кальция |
2500-5000 МЕ |
1-2 раза в день |
||
1000-5000 МЕ |
1-2 раза в день |
|||
Эноксапарин натрия |
||||
1000-5000 МЕ |
1-2 раза в день |
|||
|
||||
|
|
|
|
|
Статины |
|
|
|
|
|
|
|
|
|
Розувастатин |
10-20 мг |
1 |
раз в день |
|
Симвастатин |
10-20 мг |
1 |
раз в день |
|
Аторвастатин |
10-20 мг |
1 |
раз в день |
|
|
|
|
|
|
Заменители плазмы и других компонентов крови |
|
|
||
|
|
|
|
|
Альбумин |
10 % 200 мл, 20% 100 мл |
|
|
|
|
|
|
|
|
5. Нефротический синдром: этиология, патогенез, клиника, современные подходы к лечению.
Нефротический синдром – клинический синдром, характеризующийся тяжелой протеинурией >3,5г/1,73м2 /сут, гипоальбуминемией, гиперлипидемией и отеками.
По этиологическому фактору:
Первичные гломерулярные болезни (первичный идиопатический нефротический синдром):
•болезнь минимальных изменений;
•мембранозная гломерулопатия;
•фокально-сегментарный гломерулосклероз;
•мембрано-пролиферативный (мезангиокапиллярный) гломерулонефрит;
•другие пролиферативные гломерулонефриты.
Вторичные гломерулопатии (вторичный нефротический синдром) в рамках:
•инфекций: инфекционный эндокардит, сифилис, лепра, гепатиты В и С, мононуклеоз, цитомегаловирусная инфекция, ветряная оспа, ВИЧ, малярия, токсоплазмоз, шистосомиаз;
•применения медикаментов и наркотических средств: препараты золота, пеницилламин, НПВП, препараты висмута, лития, пробенецид, высокие дозы каптоприла, параметадон, героин;
•системных заболеваний: СКВ, синдром Шарпа, ревматоидный артрит, дерматомиозит, пурпура Шенлейн-Геноха, первичный и вторичный амилоидоз, полиартериит, синдром Такаясу, синдром Гудпасчера, герпетиформный дерматит, синдром Шегрена, саркоидоз, криоглобулинемия, язвенный колит;
•нарушения обмена веществ: сахарный диабет, гипотиреоз, семейная средиземноморская лихорадка;
•злокачественных новообразований: болезнь Ходжкина, неходжкинская лимфома, хронический лимфолейкоз, множественная миелома, злокачественная меланома, карциномы легких, желудка, толстой кишки, молочных желез, щитовидной железы, шейки матки, яичников и почек;
•аллергических реакций: укус насекомых, поллиноз, сывороточная болезнь;
•врожденные заболевания: синдром Альпорта, болезнь Фабри, нэилпателласиндром (синдром поражения ногтей и надколенника), серповидноклеточная анемия, дефицит альфа1-антитрипсина;
•другие: преэклампсия, ПМР, IgА-нефропатия, стеноз почечной артерии
(редко).
Патогенез.
В основе развития нефротического синдрома лежат иммунные нарушения, аналогичные происходящим при гломерулонефрите. Кроме того, имеют значение патогенетические механизмы, лежащие в основе заболевания, приведшего к развитию нефротического синдрома.
Патофизиология многих признаков нефротического синдрома изучена хорошо. Общим для большинства форм нефротического синдрома является повышение клубочковой проницаемости для белков, обусловленное основным патологическим процессом и приводящее к альбуминурии. Кроме того, при некоторых заболеваниях происходит повышенная потеря с мочой более крупных белков. Когда скорость потерь альбумина превышает интенсивность его синтеза, развивается гипоальбуминемия. Это снижает онкотическое давление и способствует перемещению жидкости в ткани. Образовавшаяся в итоге гиповолемия стимулирует повышенную секрецию ренина, альдостерона и антидиуретического гормона. Эти изменения способствуют задержке натрия и воды, следствием чего является олигурия и низкая концентрация натрия в моче. Поэтому натрий и вода поступают в ткани, содействуя этим увеличению отеков. Гипоальбуминемия способствует увеличению образования липопротеинов. Общий уровень в плазме липидов, холестерина и фосфолипидов повышен постоянно, при этом их уровень пропорционален гипоальбуминемии.
Диагностика
Диагностические критерии Жалобы:
·спонтанное появление и исчезновение отеков;
·снижение диуреза;
·появление кожной сыпи, эритемы;
·артралгии;
·выпадение волос;
Анамнез:
·стоматиты, синуситы, риниты с кровянистым отделяемым;
·частые пневмонии;
·бронхиальная астма;
·солнечная инсоляция;
·эпизоды макрогематурии на фоне фарингита и ОРВИ;
·эпизоды лихорадки неясной этиологии;
·потеря веса за короткий промежуток времени, не связанная с желанием пациента;
·наличие вирусного гепатита;
·сопутствующие заболевания: ревматоидный артрит, хронические очаги инфекции (например: остеомиелит, бронхоэктатическая болезнь и др.);
·прием препаратов золота, висмута, лития, НПВП, пробенецид, высокие дозы каптоприла, параметадон; употребление наркотических веществ (героина);
·у женщин – привычные выкидыши в анамнезе;
·аллергические реакции на контрастные вещества, вакцины.
Физикальное обследование:
Признак |
Характеристика |
Возможные причины |
|
|
|
|
|
Отеки |
мягкие, различной степени |
нефротический синдром |
|
выраженности: от минимальных |
|||
|
|
||
|
|
|
|
периферических до полостных и |
|
|
|
анасарки |
|
|
|
|
|
|
|
мигрирующая рожеподобная эритема |
|
|
Кожная эритема |
без определенной локализации с |
нефротический криз |
|
абдоминальной болью |
|
||
|
|
|
|
|
на лице в виде «бабочки» |
СКВ |
|
|
|
|
|
|
в зоне «декальте» |
СКВ |
|
Кожная сыпь |
|
|
|
симметричная на верхних, нижних |
системные заболевания, |
||
|
конечностях, туловище |
васкулиты, инфекции |
|
|
|
|
|
Поражение слизистых |
энантемы, хейлит, стоматит |
системные заболевания |
|
оболочек |
|||
|
|
||
|
|
|
|
|
в виде артралгий без деформаций |
системные заболевания |
|
Суставной синдром |
|
|
|
мелких суставов кистей рук, с |
ревматоидный артрит à |
||
|
деформацией |
амилоидоз почек |
|
|
|
|
|
Выделения из |
кровянистые выделения из носа, |
системные васкулиты à |
|
дыхательных путей |
мокрота с примесью крови |
БПГН |
|
|
|
|
|
Нарушение кожной |
снижение чувствительности кожи |
сахарный диабет |
|
чувствительности |
верхних и/или нижних конечностей |
||
|
|||
|
|
|
|
Ортостатическая |
разница между АД сидя и стоя |
сахарный диабет |
|
гипотония |
|||
|
|
||
|
|
|
|
|
|
онкологические |
|
Увеличение |
увеличение лимфоузлов различной |
заболевания à |
|
лимфатических узлов |
локализации |
паранеопластические |
|
|
|
нефропатии |
|
|
|
|
Диагностика основывается на выявленных изменениях в анализах крови и мочи (протеинурия, гиперлипидемия, гипопротеинемия), на клинических данных. Клиника МИНС развертывается постепенно, причем преобладают экстраренальные симптомы, особенно отечный: появляются нарастающие отеки, вначале век, лица , поясничной области (в дальнейшем могут достигать степени анасарки — распространенный отек подкожной клетчатки), половых органов, асцит, гидроторакс, реже — гидроперикард. Характерна значительная гепатомегалия вследствие дистрофии печени. Кожа становится бледной (“перламутровая” бледность) при отсутствии анемии, сухой, появляются признаки гиповитаминозов А, С, В1, В2, дистрофические изменения. Могут наблюдаться ломкость и потускнение волос, на коже — трещины, из которых вытекает жидкость, striae distensae. Ребенок вялый, плохо ест, развивается одышка, тахикардия, систолический шум на верхушке (“гипопротеинемическая кардиопатия”).Тяжелым осложнением у больных анасаркой, т. е. выраженной гипопротеинемией, может быть гиповолемический шок, которому предшествуют анорексия, рвота, резкие
боли в животе. В наблюдениях Н. Д. Савенковой и А. В. Папаяна (1997) абдоминальный болевой синдром развивается у 23,5 % детей с гипоальбуминемией менее 15 г/л, а мигрирующие рожеподобные эритемы у 33,3 %, тромботические эпизоды у 12,5 %, ОПН у 3,3% детей с той же выраженностью гипоальбуминемии, тогда как нефротический гиповолемический шок отмечен лишь при уровне белка в сыворотке менее 10 г/л (у 5%). По мере схождения отеков становится все заметнее уменьшение массы скелетных мышц.
Артериальное кровяное давление обычно нормальное, лишь у до10% детей может быть кратковременная артериальная гипертензия. Уровень альбумина в сыворотке крови у таких детей менее 10 г/л.
Содержание общего белка в плазме (сыворотке) крови снижено иногда до 40 г/л.
Особенно резко снижена концентрация альбуминов и g-глобулина, тогда как уровень a2-глобулинов повышен, т. е. наблюдается резкая диспротеинемия. Сыворотка крови имеет молочный цвет, в ней находят высокий уровень липидов, холестерина, фибриногена. Уровень азотистых шлаков крови, как правило, нормальный, а содержание калия и натрия снижено. СОЭ резко увеличена (до 50–70 мм/час).
Ренальная симптоматика — олигурия с высокой относительной плотностью (1,026–1,030) мочи и выраженная протеинурия. При исследовании клубочковой фильтрации по эндогенному креатинину получают нормальные и даже повышенные показатели, но это ложное впечатление. Если учесть степень протеинурии, то клубочковая фильтрация при МИНС всегда снижена.
Клиническая картина, течение и исход НС, осложнившего диффузный гломерулонефрит, отличаются от клиники МИНС.
Мочевой синдром при МИНС слагается из следующих симптомов:
1.протеинурия,
2.олигурия с высокой относительной плотностью мочи,
3.цилиндрурия.
Протеинурия при МИНС, как правило, селективная, т. е. в моче находят белки плазмы крови с молекулярной массой менее 85 000 (альбумин и его полимеры, преальбумины, сидерофилин, гаптоглобин, трансферрин, a1- и b- глобулины, a1- и a2-гликопротеины и др.). В большинстве случаев у детей с селективной протеинурией прогноз лучше, и они чувствительны к терапии глюкокортикоидами. В генезе протеинурии имеет значение и нарушение реабсорбции белка в почечных канальцах. Неселективная протеинурия, когда в моче есть много крупномолекулярных белков, как правило, следствие фибропластического процесса, склероза, т. е. для МИНС нехарактерна.
Напомним, что у здорового ребенка старше 4 лет в суточной моче может быть до 100–150 мг белка.
Олигурия связана с гиповолемией, гиперальдостеронизмом, поражением канальцев. Из-за протеинурии относительная плотность мочи увеличена, достигает 1,040. Высока активность в крови больных и АДГ.Иногда при НС отмечается массивная лейкоцитурия, обусловленная иммунопатологическим процессом в почках. Лейкоцитурия чаще кратковременная и не связана с бактериальной инфекцией, т. е. пиелонефритом. Частота выявления лейкоцитурий и эритроцитурий при МИНС по данным разных авторов не превышает 10%.
При большом количестве белка в моче он может свернуться еще в канальцах, принимая их форму; на этот слепок наслаивается жироперерожденный почечный эпителий — так образуются гиалиновые, зернистые и восковые цилиндры.
Отеки. Массивная и длительная альбуминурия у больного с НС в конце концов неизбежно вызывает гипопротеинемию, так как потери белка превышают интенсивность его синтеза. Гипопротеинемия ведет к нарушению старлингова равновесия между гидродинамическим, фильтрационным и коллоидно-осмотическим давлением. Это приводит к преобладанию оттока жидкости из артериального русла над притоком. Отеки начинают появляться, когда уровень альбумина снижается ниже 27 г/л плазмы и развиваются всегда, если гипоальбуминемия достигает 18 г/л.В патогенезе отеков важную роль играет и вторичный гиперальдостеронизм, типичный для НС. В результате его в организме задерживается натрий, а следовательно, и вода, хотя в крови имеется гипонатриемия.
Гипопротеинемия. Основной причиной гипопротеинемии у больных с НС являются большие потери альбуминов с мочой и перемещение их в ткани. Кроме того, имеют значение повышенный катаболизм альбуминов, нарушение белоксинтезирующей функции печени. Уменьшение содержания g-глобулинов в крови больных прежде всего с нарушением их синтеза.Гипоальбуминемия и гиповолемия, дефицит антикоагулянтов — антитромбина III и протеинов С и S, гиперфибриногенемия, гиперлипидемия создают угрозу для тромботических нарушений у больных МИНС.
Гиперлипидемия. Некоторые авторы связывают увеличение уровня липопротеинов низкой и очень низкой плотности, холестерина и липидов (свободные жирные кислоты, триглицериды, фосфолипиды и др.) при НС с нарушением функции печени, другие объясняют это явление понижением функции щитовидной железы. В связи с тем, что внутривенное введение раствора альбумина препятствует нарастанию гиперхолестеринемии, предполагают, что увеличение уровня холестерина в крови происходит компенсаторно вследствие уменьшения содержания альбуминов. Поскольку липидемию в эксперименте можно получить после перевязки мочеточников,
высказывают мысль о том, что гиперхолестеринемия и липидемия при МИНС имеют почечное происхождение и зависят от повреждения интермедиарного обмена в ферментной системе канальцев. В генезе гиперлипидемии имеет значение также низкий уровень в крови лецитинхолестеринацетилтрансферазы, в больших количествах выделяющейся с мочой, и низкая активность липопротеидлипазы. При МИНС обычно диагностируют IIа и IIб типы гиперлипидемий.
Нарушения фосфорно-кальциевого обмена (гипокальциемия, остеопороз, остеомаляция) обусловлены нарушением функции почек, а также метаболизма витамина D.
Нарушения обмена железа и микроэлементов с низкими уровнями в крови как железа, так и цинка, меди, кобальта определяют в значительной степени склонность таких больных к анемиям, трофическим расстройствам кожи, задержке роста, а возможно — иммунодефицитам.
Вязкость крови при МИНС повышена за счет гиперлипидемии, повышенной адгезивности тромбоцитов. В то же время уровни факторов свертывания крови (прокоагулянтов) и антисвертывания (антитромбин III, протеины С и S) снижены, что и объясняет сравнительно низкую частоту декомпенсированного ДВС-синдрома при МИНС.
Инфекции — прежде одно из очень частых осложнений МИНС. Особенно часто были перитониты, которые в большинстве случаев вызывались пневмококками, но в 25–50% случаев — кишечной палочкой.
Лечение
Тактика лечения:
·достижение полной или частичной ремиссии;
·ликвидация экстраренальных симптомов (АГ, отеки) и осложнений (электролитные нарушения, инфекции, нефротический криз).
·замедление прогрессирования ХБП и отдаление ее терминальной стадии (диализ, трансплантация почки);
Немедикаментозное лечение: Режим:
Немедикаментозное лечение:
·режим III;
·постельный при тяжелом состоянии пациента и наличии осложнений
·дозированная физическая активность по 30 минут 5 раз в неделю.
·отказ от курения;
·отказ от алкоголя;
Диета:
·сбалансированная, адекватное введение белка (1,5-2г/кг), калораж по возрасту;
·при наличии отеков и АГ – ограничение употребления натрия хлорид (поваренной соли) < 1-2г/сут;
·мониторинг уровня протеинурии по тест–полоскам 1 раз в 1-2 недели,
регулярное измерение АД.
·при нарастании протеинурии (рецидиве) определение
протеин/креатининового коэффициента (для расчета суточной протеинурии) и коррекция иммуносупрессивной терапии; · при резистентности к проводимой иммуносупрессивной терапии
проведение повторной биопсии почки в условиях стационара.
Медикаментозное лечение:
При наличии персистирующей гломерулярной гематурии без/с протеинурией до 1г/сут показана нефропротективная терапия в виде антигипертензивных
препаратов из группы иАПФ или БРА [1] [УД-А].
Патогенетическая терапия хронического гломерулонефрита (нефротический синдром, хронический нефритический синдром) отличается в зависимости от морфологического варианта гломерулонефрита, поэтому правомочна только после проведения биопсии почки, верификации морфологического диагноза и должна продолжаться в амбулаторных условиях.
Терапия незначительных гломерулярных нарушений. Этот морфологический вариант (гломерулонефрит с минимальными изменениями – ГНМИ) встречается в 10-20% биопсии при НС у взрослых, тогда как у детей является причиной НС в 80% случаев. Поэтому, если в детской практике проведение биопсии почки требуется лишь при стероид-резистентности, тогда как у взрослых проведение биопсии почки требуется уже в дебюте НС.
Лечение дебюта. Метилпреднизолон 0,6-0,8мг/кг/сут или преднизолон 0,5- 1мг/кг/сут (максимальные суточные дозы 64 и 80мг, соответственно) в течение 6-8 недель (предпочтительнее длительное назначение до 12-16 недель) в виде однократного приема в утреннее время, после приема завтрака (Уровень 1В). По достижению полной или частичной ремиссии – снижение дозы преднизолона на 5 мг каждые 3-4 дня до достижения дозы преднизолона 20-30мг/сут. Последующие 2-3 месяца прием преднизолона в альтернирующем режиме, т.е. через день с постепенным снижением дозы по 5мг каждые 1-2 недели, до достижения 10мг (Уровень 2В). Последующее снижение дозы по 2,5мг каждые 1- 2 недели при альтернирующей схеме приема до полной отмены [4-6].
Более быстрое снижение дозы преднизолона возможно при появлении нежелательных явлений стероидной терапии.
Пациенты, не достигшие полной или частичной ремиссии после приема полной дозы в течение 16 недель определяются как стероид-резистентные и требуют комбинированной терапии циклоспорином-А и минимальной дозой преднизолона 0,15-0,2мг/кг/сут [5, 7-9] [УД-А].
Лечение рецидива. У 50-75% пациентов, ответивших на стероидную терапию встречаются рецидивы. При рецидиве назначается Преднизолон в дозе 60 максимум 80мг/сут в течение 4-х недель с последующим снижением по 5 мг каждые 3-5 дней до полной отмены в течение 1-2 мес [7, 8].
При частых (3 и более в течение 1 года) рецидивах или стероид-зависимой (рецидив на фоне приема стероидов) форме используется комбинированная терапия: низкие дозы преднизолона 0,15-0,20мг/кг/сут + один из следующих групп препарат: алкилирующие агенты (циклофосфамид), антиметаболиты (микофеноловая кислота, мофетила микофенолат), ингибиторы кальцинейрина (циклоспорин-А или Такролимус) [10] [УД-А].
Циклофосфамид 2мг/кг/сут, внутрь в течение 8-12 нед, под контролем числа лейкоцитов (не менее 3 х 10 9/л) + профилактика геморрагического цистита
(месна) [10, 11].
Циклоспорин-А микроэмульсионная форма в дозе 3мг/кг/сут, внутрь в 2 приема, не микроэмульсионная форма в дозе 4-5мг/кг/сут, внутрь в 2 приема, при целевой С0 концентрации 100-200нг/мл в течение 18-24 месяцев и более (Уровень 2В). [8-11].
Микофеноловая кислота, внутрь в дозе 540-720мг х 2 раза или мофетила микофенолат внутрь в дозе 750-1000мг х 2 раза в день в течение 6-26 месяцев [8].
Ритуксимаб – химерическое моноклональное антитело, используется для лечения различных морфологических вариантов НС. Рекомендуется лишь при отсутствии эффекта от выше проведенной терапии. Назначается в дозе 375мг/м2 поверхности тела, 1 раз в неделю, всего №4, внутривенно, капельно после премедикации [УД-В].
Пациентам без противопоказаний к стероидной терапии назначается Метилпреднизолон или Преднизолон (Уровень 1А) в дозе 1мг/кг/сут (максимум 80мг/сут), внутрь. Длительность приема и начало снижения дозы зависят от скорости достижения полной или частичной ремиссии. Пациентам с сопутствующими заболеваниями (тяжелый остеопороз, диабет, ожирение) инициальную терапию мы рекомендуем начинать с комбинации (Уровень 2В) низкой дозы Преднизолона (0,15-0,20мг/кг/сут, максимум 15мг/сут) + Циклоспорин (2-4мг/кг/сут, разделенных на 2 приема) или Такролимус (4мг/сут, внутрь, разделенных на 2 приема). Целевой уровень концентрации С0 циклоспорина в сыворотке крови 100-175нг/мл, такролимуса 4-7нг/мл. [13-15].
При СКФ < 40мл/мин применение ингибиторов кальциневрина не рекомендуется по причине их нефротоксичности.
Для всех пациентов с ФСГС рекомендуется назначение нефропротективной терапии иАПФ или БРА (Уровень 1 В).
Иммуносупрессивная терапия монотерапию кортикостероидами, а при быстропрогрессирующем течении и находке полулуний при нефробиопсии требует проведения комбинированной иммуноспурессивной терапии кортикостероиды в дебюте в виде пульс-терапии 15мг/кг веса в/в капельно №3, затем внутрь в дозе 1мг/кг/сут 60 дней, затем 0,6мг/кг/сут 60 дней, затем 0,3мг/кг/сут 60дней + циклофосфамид 0,5мг/м2, в/в капельно ежемесячно в течение 6 месяцев. Во второй линии вместо циклофосфамида возможно применение микофеноловой кислоты или микофенолата мофетил Мофетила микофенолат (не забывать тератогенное действие и при планировании беременности отказаться от данной группы препаратов). [30-31].
Другие медикаменты:
·антациды или блокаторы протонной помпы при появлении гастроинтестинальных симптомов.
·карбонат кальция (250-500мг/сут) длительно необходим, если терапия преднизолоном продолжается более 3 месяцев [УД-В] [15].
·обычно нет необходимости коррекции гиперлипидемии у стероидчувствительных пациентов, так как она купируется после наступления ремиссии.
Артериальная гипертензия: иАПФ, блокаторы кальциевых каналов, β-блокаторы [18].
Гиповолемический шок бывает при назначении диуретиков, особенно когда имеется септицемия, диарея, рвота. Гиповолемический шок можно предположить при наличии разной интенсивности болей в животе, гипотензии, тахикардии, ознобе, в крови повышены уровни гематокрита, мочевины и мочевой кислоты. Восстанавливается путем срочных инфузий физиологических растворов из расчета 15-20мл/кг 20-30 минут, можно повторно. Инфузия 10% раствора альбумина (10мл/кг) или 20% раствора (0,5-1г/кг) при отсутствии эффекта после двух болюсов физ. раствора.
Побочные эффекты кортикостероидов: повышенный аппетит, задержка роста, риск инфекций, гипертензия, деминерализация костей, повышение глюкозы крови, катаракта
Перечень основных лекарственных средств:
Нефропротективная терапия – ингибиторы ангиотензин-превращающего фермента
Препараты |
Разовая доза |
Кратность введения |
|||
|
|
|
|
||
Лизиноприл |
5 – 10 |
мг |
1- 2 раза |
||
Рамиприл |
5 – 10 |
мг |
1- 2 |
раза |
|
Фозиноприл |
5 – |
10 |
мг |
1- 2 раза |
|
Периндоприл |
2,5 |
– 5 мг |
1- 2 раза |
||
|
|
|
|
|
|
Нефропротективная терапия – блокаторы ренин-ангиотензина II
Препараты |
Разовая доза |
Кратность |
|
введения |
|||
|
|
||
|
|
|
|
Лозартан |
50-100 мг |
1-2 раза |
|
Валсартан |
80-160 мг |
1-2 раза |
|
Кандесартан |
8 – 16 мг |
1-2 раза |
|
|
|
|
Иммуносупрессивная терапия
Препараты |
Разовая доза |
Кратность введения |
|
|||
|
|
|
|
|
|
|
|
|
|
Утром в течение 6-8 |
|
||
Метилпреднизолон |
0,6-0,8мг/кг/сут |
недель |
|
|||
Преднизолон |
0,5-1мг/кг/сут |
Утром в течение 6-8 |
|
|||
Циклоспорином-А |
3мг/кг/сут |
недель |
|
|||
Циклофосфамид |
2-2,5мг/кг/сут |
2 |
раза в день |
|
||
Мофетила микофенолат |
750-1000 мг |
1 |
раз в день |
|
||
Микофеноловая кислота |
540-720мг |
2 |
раза в день |
|
||
|
|
|
|
|
|
|
Диуретики |
|
|
|
|
|
|
Препараты |
Разовая доза |
Кратность введения |
|
|||
|
|
|
|
|
|
|
Петлевые: |
|
|
|
|
|
|
фуросемид |
1-3мг/кг/сут |
1 |
раз |
|
||
торасемид |
5-10 мг |
1 |
раз |
|
||
Тиазидоподобные: гипотиазид |
|
|
|
|
|
|
индапамид |
25-100 мг |
1 |
раз |
|
||
Антагонисты альдостерона |
1,25-5 мг |
1 |
раз |
|
||
спиронолактон |
12,5-25мг/сут |
1 |
раз |
|
||
|
|
|
|
|
||
|
|
|
|
|
|
|
Антикоагулянты |
|
|
|
|
|
|
Препараты |
|
Разовая |
|
|
Кратность введения |
|
|
доза |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гепарин натрия Надропарин кальция |
|
2500-5000 МЕ |
|
|
1-2 раза в день |
|
|
|
|
|
|
|
|
Эноксапарин натрия |
|
1000-5000 МЕ |
1-2 раза в день |
||
|
|
1000-5000 МЕ |
1-2 раза в день |
||
|
|
|
|
|
|
Статины |
|
|
|
|
|
Препараты |
Разовая |
|
Кратность введения |
|
|
доза |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
Розувастатин |
10-20 мг |
|
1 раз в день |
|
|
Симвастатин |
10-20 мг |
|
1 раз в день |
|
|
Аторвастатин |
10-20 мг |
|
1 раз в день |
|
|
|
|
|
|
|
|
Перечень дополнительных лекарственных средств:
·ритуксимаб – доза 375мг/м2 поверхности тела, 1 раз в неделю, всего №4, внутривенно;
·альбумин 10 % 200 мл, 20% 100 мл по потребности;
·антациды: Омепразол (Эзомепразол) 20 мг 2 раза в день;
·карбонат кальция 250-500 мг/сут.
6.Хронический пиелонефрит: этиология, классификация, клинические проявления, диагностика.
Хронический Пи́елонефри́т (греч. πύέλός — корыто, лохань; νεφρός — почка)
— Неспецифический воспалительный процесс с преимущественным поражением канальцевой системы почки, преимущественно бактериальной этиологии, характеризующееся поражением почечной лоханки (пиелит), чашечек и паренхимы почки (в основном её межуточной ткани).
Классификация
Выделяют:
■первичный хронический пиелонефрит, развивающийся в интактной почке (без аномалий развития и диагностированных нарушений уродинамики ВМП);
■вторичный хронический пиелонефрит, возникающий на фоне заболеваний, нарушающих пассаж мочи: ◊ аномалии развития почек и мочевыводящих путей; ◊ мочекаменная болезнь; ◊ стриктуры мочеточника различной этиологии; ◊ болезнь Ормонда (ретроперитонеальный склероз);
◊ пузырно-мочеточниковый рефлюкс и рефлюкс-нефропатия; ◊ аденома и склероз простаты; ◊ склероз шейки мочевого пузыря;
◊ нейрогенный мочевой пузырь (особенно гипотонического типа); ◊ кисты и опухоли почки; ◊ новообразования мочевыводящих путей;
◊ злокачественные опухоли половых органов. По локализации процесс может быть одноили двусторонним. Выделяют фазы хронического пиелонефрита:
■активного воспаления;
■латентного воспаления;
■ремиссии или клинического выздоровления
В группе хронического пиелонефрита при анализе материала биопсий коркового вещества почки различают 6 морфологических вариантов. Нет достаточных оснований рассматривать все из них как последовательные стадии изменений — правильнее считать их неодинаковыми формами течения хронического пиелонефрита, обусловленными различиями факторов, способствующих развитию пиелонефрита.
Хронический пиелонефрит может постоянно беспокоить пациента тупыми ноющими болями в пояснице, особенно в сырую холодную погоду, а также энурезом или болезненным мочеиспусканием так как во время этой болезни особенно ослабляется не только иммунитет, но и мочевой пузырь. Кроме того, хронический пиелонефрит время от времени обостряется, и тогда у больного появляются все признаки острого процесса. Лечение хронического пиелонефрита принципиально такое же, как и острого, но более длительное и трудоемкое.
Клиническая картина Местная симптоматика:
Боли в поясничной области на стороне поражения. При необструктивных пиелонефритах обычно боли тупые, ноющего характера, могут быть низкой или достигать высокой интенсивности, принимать приступообразный характер (например, при обструкции мочеточника камнем с развитием т. н. калькулёзного пиелонефрита).
Дизурические явления для собственно пиелонефрита не характерны, но могут иметь место при уретрите и цистите, приведших к развитию восходящего пиелонефрита.
Общая симптоматика характеризуется развитием интоксикационного синдрома:
лихорадка до 38—40 °C, ознобы, общая слабость,
снижение аппетита, тошнота, иногда рвота.
У лиц пожилого и старческого возраста часто развивается атипичная клиническая картина либо со стёртой клиникой, либо с выраженными общими проявлениями и отсутствием местной симптоматики.
Диагностика
Физикальное обследование
При обследовании больного хроническим пиелонефритом обращают внимание:
■на болезненность при пальпации в области почки;
■положительный симптом Пастернацкого с поражённой стороны;
■наличие полиурии.
Обязательно измерение артериального давления, температуры тела. Особую склонность к артериальной гипертензии выявляют у больных вторичным хроническим пиелонефритом на фоне аномалий почек
Лабораторные методы исследования Анализ крови
Общий анализ крови. Общевоспалительные изменения: лейкоцитоз, ускорение СОЭ, сдвиг лейкоцитарной формулы влево, при выраженном воспалении — анемия.
Биохимический анализ крови. Возможно увеличение трансаминаз, гипергаммаглобулинемия, при развитии явлений почечной недостаточности — повышение цифр мочевины, креатинина, повышенная СОЭ.
Анализ мочи
■При лабораторном исследовании выявляют лейкоцитурию (в большинстве случаев нейтрофильную) и бактериурию. Возможны небольшая протеинурия (до 1 г/сут), микрогематурия, гипостенурия, щелочная реакция мочи.
■Бактериологический анализ мочи показан всем больным для выявления возбудителя заболевания и назначения адекватной антибактериальной терапии. При количественной оценке степени бактериурии значимым считают уровень 104 КОЕ/мл. В нестандартных случаях (при полиурии или иммуносупрессии) клинически значимой может быть и меньшая степень бактериурии.
Инструментальные методы исследования
■УЗИ позволяет диагностировать:
■отёк паренхимы при обострении;
■уменьшение размеров почки, её деформацию, повышенную эхогенность паренхимы (признаки нефросклероза) при длительно текущем пиелонефрите вне обострения.
Расширение чашечно-лоханочной системы свидетельствует о нарушении пассажа мочи. Кроме того, допплеровское исследование позволяет уточнить степень нарушения кровотока.
■ По данным экскреторной урографии выявляют специфические рентгенологические признаки пиелонефрита. Однако основная цель её выполнения — уточнение состояния мочевыводящих путей и диагностика нарушения пассажа мочи.
рентгенологические методы исследования:
обзорная и экскреторная урография дополняют друг друга и проводятся обычно вместе (обзорный снимок с последующим проведением экскреторной урографии). На обзорном снимке может быть выявлено увеличение размеров почки, выбухание её контура (при карбункуле и абсцессе), нечёткость контура большой поясничной мышцы на стороне поражения (отёк паранефральной клетчатки, паранефрит), наличие теней конкрементов (калькулёзный пиелонефрит). На экскреторных урограммах в фазе серозного воспаления уродинамика и функция почек чаще не нарушена, может определяться увеличение почки, ограничение её подвижности при ортопробе, умеренное сдавление чашечно-лоханочной системы отёчной паренхимой почки. При апостематозном пиелонефрите к перечисленным признакам серозного пиелонефрита добавляется снижение выделительной функции почки. При карбункулах и абсцессах почки на экскреторных урограммах может определяться выбухание контура, сдавление и деформация лоханки и чашечек абсцессом, инфильтратом.
■ КТ и МРТ показаны для диагностики заболеваний, провоцирующих развитие пиелонефрита:
◊ мочекаменной болезни (КТ, КТ с контрастированием); ◊ опухолей и аномалий развития почек и мочевыводящих путей (КТ с контрастированием, МРТ).
ретроградная пиелоуретерография выполняется при отсутствии на экскреторных урограммах функции почки или если по каким-либо причинам экскреторная урография не может быть проведена (тяжёлое состояние больного, наличие острой или хронической почечной недостаточности).
абдоминальная аортография, селективная почечная артериография, компьютерная томография применяются, главным образом, для проведения дифференциальной диагностики пиелонефрита и другой почечной патологии.
■ Радиоизотопные методы исследования проводят для решения вопроса о симметричности нефропатии и оценки функционального состояния почки.
■ Биопсию почки применяют для дифференциальной диагностики с другими диффузными поражениями почечной ткани, особенно при решении вопроса о необходимости проведения иммуносупрессивной терапии.
7. Принципы лечения хронического пиелонефрита.
Немедикаментозное лечение
При хроническом пиелонефрите необходимо поддерживать достаточный диурез. Объём выпиваемой жидкости должен составлять 2000—2500 мл/сут. Рекомендовано применение мочегонных сборов, витаминизированных отваров (морсов) с антисептическими свойствами (клюква, брусника, шиповник).
Вне обострения возможно санаторно-курортное лечение в Ессентуках, Железноводске, Пятигорске, Трускавце и на курортах местного значения, ориентированных на лечение почечных заболеваний.
Больным хроническим пиелонефритом, осложнённым артериальной гипертензией при отсутствии полиурии и потери электролитов, показано ограничение потребления поваренной соли (5—6 г/сут) и жидкости (до1000 мл/сут).
Медикаментозное лечение
В лечении хронического пиелонефрита ведущее значение имеет антибактериальная терапия. Это заболевание способны вызывать многие виды микроорганизмов, против которых может быть применён любой из имеющихся в настоящее время антибактериальных препаратов. Лечение антибактериальными препаратами при хроническом пиелонефрите предпочтительно проводить после выполнения бактериологического анализа мочи с идентификацией возбудителя и определением его чувствительности к антибиотикам.
Гипотензивную терапию при хроническом пиелонефрите проводят по обычным схемам. Однако необходимо отметить, что артериальная гипертензия в большинстве случаев связана с повышением уровня ренина крови, поэтому базовыми препаратами считают ингибиторы АПФ. В случае их непереносимости (в основном из-за кашля) препаратами выбора будут антагонисты рецепторов ангиотензина II. Дозы лекарственных средств таким пациентам в связи с частым нефросклерозом (возможно, двусторонним) обязательно подбирают с учётом пробы Ребергав
При обострении/рецидивировании пиелонефрита назначение антибиотикотерапии допустимо только после устранения нарушений пассажа мочи и должно сопровождаться эрадикацией корригируемых факторов риска, при возможности удалением или сменой ранее установленных дренажей.
Рекомендованная начальная эмпирическая антибактериальная терапия при остром неосложнённом пиелонефрите лёгкой и средней степени тяжести.
|
|
|
|
|
|
|
|
|
|
Антибиотики |
|
Ежедневная доза |
|
|
Продолжительность терапии, дней |
|
Литература |
|
|
|
|
|
|
|
|
|
|||
Ципрофлоксацин1 |
|
500-750 мг 2 раза в день |
|
7-10 |
|
[21] |
|
||
Левофлоксацин1 |
|
250-500 мг 1 раз в день |
|
7-10 |
|
[27] |
|
||
|
|
|
|
|
|
|
|
||
Левофлоксацин |
|
750 мг 1 |
раз в день |
|
|
5 |
|
[22, 23] |
|
|
|
||||||||
Альтернативные препараты (эквивалентны фторхинолонам клинически, но не микробиологически) |
|
||||||||
|
|
|
|
|
|
|
|
||
Цефподоксима проксетил |
|
200 мг 2 |
раза в день |
|
|
10 |
|
[25] |
|
|
|
|
|
|
|
|
|
||
Цефтибутен |
|
400 мг 1 |
раз в день |
|
10 |
|
[24] |
|
|
|
|
||||||||
Только при известной чувствительности микроорганизма (не для начальной эмпирической терапии) |
|
||||||||
|
|
|
|
|
|
|
|||
Триметопримсульфаметоксазол |
|
160/800 мг 2 раза в день |
|
|
14 |
|
[21] |
|
|
|
|
|
|
|
|
|
|||
Ко-амоксиклав2, 3 |
|
0,5/0,125 г 3 раза в день |
|
14 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
■ Пациентам с рецидивом острого неосложнённого пиелонефрита тяжелой степени показана терапия одним из приведённых парентеральных антибиотиков:
◊парентеральные фторхинолоны пациентам, у которых показатель резистентности E. соli к данным препаратам составляет <10%
◊цефалоспорины III поколения пациентам, у которых показатель резистентности БЛРС-продуцирующих штаммов E. соli к данным препаратам составляет <10%
◊аминопенициллины + ингибиторы β-лактамаз при известной чувствительности к ним грамположительных микроорганизмов
◊аминогликозиды или карбапенемы пациентам, у которых показатель резистентности E. соli к фторхинолонам и/или БЛРСпродуцирующих штаммов E. соli к данным препаратам составляет >10%
Первоначальная парентеральная терапия при тяжёлой степени
|
|
|
|
|
|
|
Антибиотики |
|
Ежедневная доза |
|
|
Литература |
|
|
|
|
|
|
||
Ципрофлоксацин |
|
400 мг 2 раза в день |
|
|
[21] |
|
|
|
|
|
|
||
Левофлоксацин1 |
|
250-500 мг 1 раз в день |
|
|
[27] |
|
|
|
|
|
|
||
Левофлоксацин |
|
750 мг 1 раз в день |
|
[22] |
|
|
|
|
|
|
|
|
|
Альтернативные препараты |
|
|
|
|
|
|
|
|
|
|
|
|
|
Цефотаксим2 |
|
2 г 3 раза в день |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Цефтриаксон1, 4 |
|
1-2 г 1 раз в день |
|
[28] |
|
|
Цефтазидим2 |
|
1-2 г 3 раза в день |
|
|
[29] |
|
|
|
|
|
|
||
Цефепим1, 4 |
|
1-2 г 2 раза в день |
|
[30] |
|
|
|
|
|
|
|
|
|
Ко-амоксиклав2,3 |
|
1,5 г 3 раза в день |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Пиперациллин/тазобактам1,4 |
|
2/0,25-4/0,5 г 3 раза в день |
|
[31] |
|
|
|
|
|
|
|
|
|
Гентамицин2 |
|
5 мг/кг 1 раз в день |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Амикацин2 |
|
15 мг/кг 1 раз в день |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Эртапенем4 |
|
1 г 1 раз в день |
|
|
[28] |
|
|
|
|
|
|
||
Имипенем/циластатин4 |
|
0,5/0,5 г 3 раза в день |
|
|
[31] |
|
|
|
|
|
|
||
Меропенем4 |
|
1 г 3 раза в день |
|
[29] |
|
|
|
|
|
|
|
||
Дорипенем4 |
|
0,5 г 3 раза в день |
|
[32] |
|
|
|
|
|
|
|
|
|
К методам консервативного лечения относится также катетеризация мочеточника на стороне поражения с целью восстановления оттока мочи из поражённой почки.
В связи с этим при многих воспалительных заболеваниях неспецифической этиологии, наряду с общепринятым медикаментозным лечением, патогенетически оправдано назначение антиоксидантов. К антиоксидантам относятся: витамин E (токоферол), витамин С (аскорбиновая кислота), убихинон (коэнзим Q10), витамин А (ретинол), β-каротин, селен и т. д.
При появлении признаков почечной недостаточности назначают оксиданты (кокарбоксилаза, реже рибофлавин, пиридоксальфосфат)
Оперативное лечение (операции)
Оперативное лечение включает органосохраняющие и органоуносящие операции.
Органосохраняющие: Объём оперативного вмешательства при остром пиелонефрите зависит от характера выявленных изменений в почке. Декапсуляция почки выполняется при любых вариантах гнойного пиелонефрита. При апостематозном пиелонефрите производится декапсуляция почки со вскрытием апостем. Что снижает сдавление почечной паренхимы инфильтратом и отёком, способствует восстановлению кровотока в почке. При наличии карбункула почки производится рассечение и иссечение карбункула, при абсцессе почки — вскрытие абсцесса и иссечение его стенки. К органосохраняющим операциям также относят нефростомию
— как при открытой операции, так и чрескожную пункционную нефростомию под контролем УЗИ.
Органоуносящие: Нефрэктомия.
Показания к нефрэктомии при хроническом пиелонефрите
■Пионефроз.
■Выраженный односторонний нефросклероз с утратой функции органа в случае, если поражённая почка становится очагом хронической инфекции.
■Односторонний нефросклероз с утратой или значительным снижением функции органа в случае, если поражённая почка обусловливает тяжёлую, трудно контролируемую артериальную гипертензию.
8.Хроническая болезнь почек: этиология, классификация, клиника, диагностика, лечение.
Хроническая болезнь почек (ХБП) — это продолжающиеся в течение ≥3 мес. значимые для здоровья нарушения анатомической структуры или функции почек.
Причины ХБП: диабетическая нефропатия, гломерулонефрит, гипертоническая нефропатия, тубулоинтерстициальные заболевания почек, поликистозная дегенерация почек; реже ишемическая нефропатия, обструктивная нефропатия, системные заболевания соединительной ткани, саркоидоз, амилоидоз.
Большинство хронических болезней почек может вызвать постепенную потерю нефронов, что приводит к перегрузке других нефронов, прежде всего, вследствие гиперфильтрации. Сначала клубочки подвергаются гипертрофии, а затем развиваются склеротические изменения и интерстициальный фиброз, что приводит к нарушению функции почек. При прогрессировании ХПН в крови накапливаются т. н. уремические токсины, в основном, низко- и среднемолекулярные продукты обмена белков. Уменьшается синтез эритропоэтина в почках, что, наряду с другими
факторами (дефицит железа, скрытая или явная потеря крови, торможение функций костного мозга уремическими токсинами, сокращенная продолжительность жизни эритроцитов, дефицит фолиевой кислоты и
витамина В12), приводит к анемии. Снижение 1-α-гидроксилирования витамина D в почках является одной из причин гипокальциемии и вторичного гиперпаратиреоза. Почки теряют способность поддерживать надлежащий водно-электролитный баланс и рН крови. Вследствие нарушения экскреции натрия и воды почками (нарушение гипертензивного натрийуреза), избыточной секреции почками вазопрессорных веществ (ангиотензина II, эндотелина 1), дефицита вазодилятирующих факторов (напр., NO, простагландинов), повышенной активности симпатической системы, гормональных и метаболических нарушений, склерозирования стенок крупных артерий развивается артериальная гипертензия, которая появляется у >90 % пациентов со значительным нарушением экскреторной функции почек (этот процент снижается до 50 % после начала гемодиализа). Фактором, который может вызывать повышение артериального давления, также является эритропоэтин, который назначается для лечения анемии.
Классификация. Современная классификация основана на двух показателях — скорости клубочковой фильтрации (СКФ) и признаках почечного повреждения (протеинурия, альбуминурия). В зависимости от их сочетания выделяют пять стадий хронической болезни почек.
стадия |
описание |
СКФ, мл/мин/1,73м² |
|
|
|
1 |
Признаки нефропатии, нормальная СКФ |
> 90 |
|
|
|
2 |
Признаки нефропатии, легкое снижение СКФ |
60 – 89 |
|
|
|
3А |
Умеренное снижение СКФ |
45 – 59 |
|
|
|
3Б |
Выраженное снижение СКФ |
30 – 44 |
|
|
|
4 |
Тяжелое снижение СКФ |
15 – 29 |
|
|
|
5 |
Терминальная хроническая почечная недостаточность |
< 15 |
|
|
|
Стадии 3—5 соответствуют определению хронической почечной недостаточности (снижение СКФ 60 и менее мл/мин). Стадия 5 соответствует терминальной хронической почечной недостаточности (уремия).
Клиническая картина. Клиническая картина зависит от тяжести ХБП и основного заболевания. Вначале может не быть никаких клинических симптомов, или они не являются патогномоничными (напр., артериальная гипертензия). По мере снижения СКФ появляются симптомы и осложнения со стороны различных органов и систем.
1. Общие симптомы: слабость, усталость, гипотермия, потеря аппетита, сниженная устойчивость к инфекциям.
2. Кожные симптомы: бледность, сухая кожа, землисто-коричневый цвет кожи, удлиненное кровотечение из ран и тенденция к возникновению кровоподтеков (симптом геморрагического диатеза), зуд (при терминальной ХПН), «уремический иней» (отложения мочевины на коже).
3. Нарушения деятельности сердечно-сосудистой системы: артериальная гипертензия,
гипертрофия левого желудочка, сердечная недостаточность, аритмия, ускоренный атеросклероз, кальцификация сосудов, уремический перикардит.
4. Нарушения функций дыхательной системы: ацидозное дыхание (Куссмауля →разд. 1.14), уремический плеврит, гиперемия и отек легких (т. н. уремические легкие при выраженной ХПН).
5. Нарушения функций пищеварительной системы: гастрит и энтерит, язвы желудка или двенадцатиперстной кишки, желудочно-кишечные кровотечения; при выраженной ХПН — уремический запах изо рта, тошнота и рвота, паралитическая кишечная непроходимость, острый панкреатит.
6. Нарушения функций нервной системы и мышц (встречаются при выраженной ХПН):
нарушение концентрации и памяти, головная боль, сонливость днем и бессонница ночью, нарушения поведения (напр., апатия или раздражительность), судороги и кома (симптомы тяжелой энцефалопатии или отека мозга), уремическая полинейропатия: синдром беспокойных ног (чувство дискомфорта в ногах, которое заставляет постоянно выполнять движения нижними конечностями), потеря глубоких сухожильных рефлексов, слабость мышц, хлопающий тремор кистей, спазмы мышечных пучков и групп мышц, хроническая икота, паралич малоберцового нерва, периферическая тетраплегия при наиболее тяжелой форме нейропатии.
7. Нарушения функций репродуктивной системы: нарушения менструального цикла
(редкие менструации, вторичная аменорея), бесплодие, сексуальные расстройства (снижение полового влечения, импотенция).
8. Синдром минеральных и костных расстройств, связанных с ХБП: нарушения метаболизма кальция (гипоили гиперкальциемия), фосфора (гиперфосфатемия), дефицит активного витамина D и нарушения секреции ПТГ (вторичный или
третичный гиперпаратиреоз) приводят к нарушениям метаболизма костной ткани (почечной остеодистрофии) и кальцификации сосудов или других мягких тканей. Почечная остеодистрофия — это прогрессирующее нарушение структуры костей вследствие слишком быстрого (причина — гиперпаратиреоз) или слишком медленного (т. н. адинамическая болезнь костей) костного метаболизма, или вследствие отложения в костях β2-микроглобулина или алюминия; проявляется в виде боли в костях и суставах, а также спонтанными переломами костей.
9. Нарушения водно-электролитного обмена и кислотно-щелочного равновесия: выявляются при лабораторных исследованиях →см. ниже.
10. Нарушения системы кроветворения: анемия хронических заболеваний,
тромбоцитопения или тромбоцитоз, лейкопения, иногда глубокая, за счет снижения числа лимфоцитов; нарушения гемостаза (разнонаправленные изменения хронометрических показателей, повышение концентрации продуктов паракоагуляции, нарушение фибринолиза), характерные для хронического ДВС-синдрома.
Диагностика.
Для оценки функции почек у взрослых в настоящее время используется формула Кокрофта-Голта (позволяет стандартизировать оценку СКФ), которая довольно точно отражает СКФ на начальных стадиях (1-3) ХБП: 1. СКФ = (140 — возраст в годах) х масса тела в кг / (72 х концентрация в крови креатинина в мг%) х 0,85 (у женщин) или: 2. СКФ = (140 — возраст в годах) х масса тела в кг / концентрация в крови креатинина в мкмоль/л) х 1,23 (у мужчин), Полученное значение желательно стандартизировать на поверхность тела пациента. Проба Реберга-Тареева в настоящее время используется только при некоторых ситуациях (нестандартные размеры тела пациента – отсутствие конечностей, выраженное ожирении или истощение, беременность, миодистрофия, пара- и квадриплегия, вегетарианская диета, быстрое снижение функции почек, наличие почечного трансплантата): СКФ= V/1440 х UCr/SCr, мл/мин, где V – объем мочи за сутки в мл, UCr – концентрация креатинина в суточной моче; SCr – концентрация креатинина в
сыворотке крови, забранной в конце пробы. Полученное значение желательно стандартизировать на поверхность тела пациента.
Общий анализ мочи: альбуминурия, протеинурия, микро/макрогематурия, цилиндры, лейкоцитурия, низкий разброс относительной плотности мочи, не отличающейся от таковой плазмы (гипоизостенурия).
Анализы крови: анемия (обычно нормоцитарная и нормохромная), может наблюдаться тромбоцитопения, повышение концентрации креатинина, мочевины, иногда — мочевой кислоты, калия, фосфатов и ПТГ, триглицеридов, холестерина; гипокальциемия; метаболический ацидоз, могут наблюдаться изменения гемостаза, характерные для ДВСсиндрома.
Визуализирующие исследования: УЗИ — почки обычно уменьшены в размерах (часто <10 см по длинной оси); исключения (большие почки, вопреки ХПН) при амилоидной нефропатии, диабетической нефропатии, поликистозе почек и ВИЧнефропатии. Визуализирующие исследования с использованием контраста (напр., КТ)
проводят только в случае крайней необходимости, из-за высокого риска контрастиндуцированной нефропатии.
Лечение. Включает: этиотропное лечение ХБП, замедление прогрессирования ХБП, профилактику осложнений ХПН и их лечение, подготовку к лечению и лечение методами почечной заместительной терапией, включая трансплантацию почек.
Общие принципы
1. Лечат сопутствующие заболевания.
2. Профилактика сердечно-сосудистых заболеваний (высокий риск у пациентов с ХБП), в том числе отказ от курения и систематическая физическая нагрузка.
3. Избегать нефротоксических препаратов. Помнить о необходимости коррекции дозы лекарств, которые выводятся из организма почками, в зависимости от уровня СКФ.
4. Противодействуют инфекциям путем проведения прививок:
1)ежегодная прививка от гриппа (у всех больных с ХБП);
2)прививка поливалентной пневмококковой вакциной (всех больных с рСКФ <30 мл/мин/1,73 м2, повторная через 5 лет);
3)прививка против гепатита В (всех пациентов с рСКФ <30 мл/мин/1,73 м2 или раньше, если наблюдается постепенное снижение рСКФ).
Диетическое лечение
Основная цель: обеспечение достаточного энергоснабжения — у взрослых с ХПН и с нормальным весом 35 ккал/кг массы тела в день (30–35 ккал/кг массы тела у лиц >60 лет)
— 50–60 % за счет углеводов, ≤30 % — жиров (из них животных ≤1/3). Рекомендуемое ежедневное потребление белков зависит от СКФ (мл/мин/1,73 м2): >60 →0,8–1,0 г/кг м.
т.; 25–60 →0,8 г/кг м. т.; <25 →0,6 г/кг м. т.; 2/3 животный белок.
Фармакологическое лечение
1. Лечение, снижающее уровень протеинурии: цель протеинурия <1 г/сут., оптимально <0,3 г/сут. Основное значение имеет лечение, направленное на устранение причины протеинурии (первичная или вторичная гломерулопатия). В любом случае, если нет противопоказаний, назначают иАПФ или БРА также у больных с нормальным артериальным давлением. У лиц с нормальной СКФ эти лекарственные средства должны назначаться в умеренных и максимальных дозах, если они хорошо переносятся пациентом. Проявлять осторожность → начинать с малых доз, часто контролируя концентрацию креатинина и калия в сыворотке крови. Препараты и дозы →табл. 2.20-7; мониторинг
→разд. 2.20.3.
2. Лечение гипертонии
Гипотензивная терапия предотвращает прогрессирование ХПН. Следует ограничивать натрий, назначать натрийуретики — фуросемид или дихлотиазид (гипотиазид). Из гипотензивных препаратов на ранних стадиях ХПН рекомендуется назначать блокаторы каль¬ циевых каналов (нифедипин, адалат, верапамил), р-адреноблокато- ры (атенолол, метопролол, бетаксолол), ингибиторы АПФ — эналаприл (2,5 — 20 мг), рамиприл (2,5 — 5 мг), каптоприл (12,5 — 50 мг). Однако при повышении уровня креатинина плазмы более 353,6 мкмоль/л (норма 44—115 мкмоль/л) ингибиторы АПФ при¬ менять не следует.
3. Лечение гиперлипидемии: цель — снижение сердечно-сосудистого риска.
1)У всех взрослых после диагноза ХБП определяют липидный профиль (общий уровень холестерина, ХС-ЛПНП, ХС-ЛПВП и триглицеридов);
2)У больных в возрасте ≥50 лет:
а) с рСКФ ≥60 мл/мин/1,73 м2 — используют статин согласно правилам для общей популяции →разд. 2.4.1;
б) с рСКФ <60 мл/мин/1,73 м2 без заместительной почечной терапии — используют только статин (аторвастатин 20 мг/сут., розувастатин 10 мг/сут., правастатин 40 мг/сут., флувастатин 80 мг/сут., симвастатин 40 мг/сут.) или симвастатин с эзетимибом
(20/10 мг/сут.).
3) У больных в возрасте 18–49 лет с ХБП без заместительной почечной терапии используют статин, если имеется сопутствующая ишемическая болезнь сердца (перенесенный инфаркт миокарда, коронарная реваскуляризация), перенесенный ишемический инсульт, сахарный диабет или предполагаемый риск серьезных сердечных событий в течение ближайших 10 лет превышает 10 %.

4)У всех взрослых после трансплантации почки используют статин.
5)Не начинают терапии статинами (отдельно или вместе с эзетимибом) у больных получающих диализ (не показано пользы), но продолжают терапию статинами, если они были использованы перед началом диализной терапии.
6)У больных с ХБП и значительной гипертриглицеридемией (>500 мг/дл) рекомендуют нефармакологическое лечение →разд. 2.4.3 и увеличение потребления рыбьего жира. Не используют фибраты для снижения сердечно-сосудистого риска. Рассмотреть терапию фибратами в отдельных случаях крайне высокой гипертриглицеридемии (>1000 мг/дл)
в целях предотвращения панкреатита. Не применяют статин совместно с фибратом (дополнительный риск
риск рабдомиолиза!).
рабдомиолиза!).
Избегают препаратов, о которых известно, что они повышают концентрацию статинов в крови, таких как амлодипин, дилтиазем, верапамил, амиодарон, антибиотики группы макролидов, циклоспорин А. Если применение этих препаратов все же необходимо, следует снизить дозу статина, либо отменить его. В случае применения амиодарона или амлодипина дозировка симвастатина не должна превышать 20 мг/сут., при применении дилтиазема или верапамила — 10 мг/сут. В случае применения циклоспорина следует избегать симвастатина, а дозировка аторвастатина не должна превышать 10 мг/сут.
4. Водно-электролитный баланс: интенсивно лечат заболевания, приводящие к обезвоживанию и снижению эффективного объема циркулирующей крови. Остерегайются передозировки диуретиков. Диурез пациента должен составлять ≈2 л в сут. Рекомендуют ограничить потребление натрия до <2 г/сут. (<5 г натрия хлорида), если нет дополнительной потери натрия.
5. Борьба с ацидозом: снижение ацидоза достигается за счет ограничения белка в диете и применения бикарбоната натрия 0,5–1,0 г/10 кг/сут. п/о в 3–5 приемов (может вызвать задержку натрия и воды). Следует поддерживать концентрацию HCO3– в крови
в пределах 22–24 ммоль/л.
6. Лечение нарушений кальций-фосфорного обмена и гиперпаратиреоза. Проводят мониторинг нарушений кальций-фосфорного обмена и функции паращитовидных желез каждые 6–12 мес. при G3-стадии ХБП, каждые 3–6 мес. при G4-стадии ХБП и каждые 1–3 мес. при стадии G5 и у больных, получающих лечение диализом, или чаще, в зависимости от вида нарушений, их тяжести и изменений, а также от используемого лечения. Решения о лечении принимают на основании выявленных изменений в концентрациях кальция, неорганических фосфатов (Pi) в сыворотке и ПТГ, принимая во внимание все параметры вместе, а не на основании одного исследования.
7. Для лечения анемии назначают препараты железа (драже «Ферроп-
лекс» и др.).Андрогенные препараты (тестостерона пропионат, раствор «Тетрастерон», или «Сустанон-250») активируют выработ¬ ку эритропоэтина.
Весьма эффективно применение рекомбинантного эритропоэтина (препараты, назначаемые в виде инъекций,— «рекормон» и «эпрекс»).
8. Борьба с инфекционными осложнениями является важной задачей.
У больных с ХПН в связи со значительным угнетением иммунитета часты инфекционные осложнения (пневмонии, инфекции мочевых путей), приводящие к значительному снижению функции почек. Следует применять антибиотики, не оказывающие нефротоксичес-кого действия: пенициллин, оксациллин, метициллин, эритромицин в обычных дозах.
В терминальной стадии ХПН возможно проведение хронического гемодиализа — метода, с помощью которого осуществляется внепочечное очищение крови. Метод основан на диффузии через полупроницаемую мембрану веществ, задерживающихся в крови при уремии. Сеансы гемодиализа продолжительностью 5 ч проводят обычно 3 раза в неделю.
Показания к проведению гемодиализа: 1) величина клубочковой фильтрации менее 5 мл/мин; 2) стабильное снижение суточного диуреза ниже 700 мл; 3) повышение уровня креатинина крови более 1,2 ммоль/л; 4) увеличение содержания калия в сыворотке крови более 7 ммоль/л (норма 3,4—5,3 ммоль/л); 5) симптомы начинающегося перикардита, эн¬цефалопатии и нейропатии.
К другим методам лечения ХПН относятся трансплантация почек и перитонеальный гемодиализ.
8. Интенсивная терапия в нефрологии: пульс-терапия: показания, методы, осложнения).
Пульс-терапия (1000 мг и более метилпреднизолона или преднизолона в день внутривенно в течение нескольких дней) была предложена в конце 60-х годов для купирования криза отторжения цочечного трансплантата. В терапевтической нефрологической клинике этот метод впервые применили Е. S. Cathcart и соавт. (1976) для лечения больных волчаночным нефритом. У всех 7 больных после 3 дней внутривенного введения по 1000 мг метилпреднизолона улучшились иммунологические показатели, у 5 из них улучшились функции почек. В течение последующих 6 лет появился ряд аналогичных сообщений, пульс-терапия проведена более чем 100 больным быстропрогрессирующим нефритом - как без системных признаков, так и с нефритом при системных заболеваниях. Положительные результаты отмечены в 50 - 100% случаев-
К настоящему времени мы располагаем опытом проведения 18 курсов пульстерапии у 14 больных быстропрогрессирующим нефритом (5 больных нефритом, не связанным с системными заболеваниями, и 9 больных волчаночным нефритом). У всех больных отмечалось быстрое ухудшение функции почек в течение нескольких предшествовавших недель или месяцев: средний уровень креатинина в сыворотке крови до проведения пульстерапии
составил 320 мкмоль/л (с колебаниями от 160 до 560 мкмоль/л). Лечение проводилось внутривенным введением 1 г метилпреднизолона или преднизолона ежедневно в течение 3 дней с последующим назначением поддерживающей дозы (30 - 40 мг/сут). У 11 из 14 больных к 10 - 14му дню после пульс-терапии уровень креатинина понизился (средний уровень креатинина составил 240 мкмоль/л), у 6 из них нормализовался или понизился более чем на 35%, что свидетельствует об эффективности терапии.
Лечение может варьироваться: вводят меньшие дозы, ударные дозы вводят не в 3 последовательных дня.а через день и т. д. При тяжелом волчаночном нефрите поддерживающая терапия кортикостероидами должна проводиться в более высоких дозах (40 - 50 мг/сут).
Метилпреднизолон необходимо вводить медленно [в течение 8 - 10 мин), можно капельно в 0,5% растворе глюкозы или в изотоническом растворе натрия хлорида.не наблюдали различий в эффективности или в частоте побочных явлений при введении метилпреднизолояа (урбазон) или преднизолона.Большинство авторов не отмечали сколько-нибудь тяжелых осложнений при введении сверхвысоких доз кортикостероидов, однако в двух наблюдениях при быстром введении 1 г метилпреднизолона (в течение нескольких минут) наступила остановка сердечной деятельности (причиной которой, возможно, является нарушение транспорта калия и кальция через клеточную мембрану; высказывается предположение о роли фосфатного буфера, содержащегося в препаратах раствора метилпреднизолона, в связывании кальция). У одной из наблюдавшихся нами больных ва 5-й день после пульс-терапии усилилась гипокальциемия (до 1,55 ммоль/л) с развитием судорожного синдрома, купированного введением препаратов кальция. Описаны тромбозы, боли в суставах, отек суставов при проведении пульстерапии. У другого больного со смешанным гломерулонефритом и высокорениновой гипертонией на 7-й день пульс-терапии отмечены резкое повышение АД и клиническая картина отека мозга; в другом случае после введения 1 г метилпреднизолона полностью прекратилась экскреция натрия с мочой.
R. Kimberly и соавт. (1979), располагающие наибольшим опытом по использованию пульс-терапии, отмечали преходящее снижение функции почек в ходе проведения курса, что, по-видимому, связано с изменением почечной гемодинамики. По нашим наблюдениям, у 4 больных также отмечалось преходящее повышение уровня креатинина в сыворотке крови (до 22% от исходного) сразу после проведения пульс-терапии.
10.Гемодиализ: виды, показания к проведению, осложнения
Гемодиализ (ГД) – процедура очистки крови вне организма с использованием искусственного фильтра (диализатора), через который проходит кровь пациента и освобождается от шлаков и избытка жидкости.
Виды гемодиализа:
Обычный диализ. Для него используют аппараты с целлюлозной мембраной площадью от 0,8 до 1,4 м2). У его фильтра низкий уровень проницаемости, сквозь него способны проходить только маленькие молекулы. Ток крови небольшой – 200-300мл/мин, а общая продолжительность сеанса – 4-5 часов. Высокоэффективный диализ.Проводится с помощью диализатора с поверхностью мембраны 1,5 -2,2 м2. Ток крови – 350-500м/мин. В обратном направлении диализат движется со скоростью в 600-800мл/мин. Продолжительность сеанса – 3-4 часа. Высокопоточный диализ.Для него используют только высокопроницаемые мембраны, через которые проходят даже вещества крупные молекулы. При высокопоточном гемодиализе можно не бояться ряда осложнений, например, амилоидоза туннельного синдрома запястного канала.С другой стороны, высокопроницаемая мембрана позволяет веществам из диализата попадать в кровь, потому аппарат должен быть стерильным.
Виды диализа: Гемодиализ:
Кровь циркулирует вне тела пациента - она проходит через машину, которая имеет специальные фильтры. Кровь поступает из пациента через катетер (гибкая трубка), которую вставляют в вену. Фильтры делают то, что делают обычные почки; они отфильтровывают продукты жизнедеятельности из крови. Затем отфильтрованную кровь возвращают пациенту через другой катетер. Пациент, по сути дела, подключен к искусственной почке. Пациенты должны быть подготовлены для гемодиализа. Кровеносные сосуды, как правило, в руке, должны быть увеличены. Лечение длится от 2 до 4 часов. За это время сотрудник измеряет пациенту кровяное давление и регулирует диализный аппарат, чтобы гарантировать, что необходимое количество жидкости удаляется из организма пациента. Пациенты могут читать, смотреть телевизор, спать или заниматься другими вещами во время лечения.
Перитонеальный диализ:
Стерильный раствор, который богат минералами и глюкозой проходит через трубку в брюшную полость, где брюшина выступает в качестве полупроницаемой мембраны. В брюшную полость вводится диализный раствор, который остается там от 4 до 12часов. Далее раствор сливают, а вместе с ним выводятся продукты обмена веществ и лишняя жидкость из тела. Несмотря на то, что перитонеальный диализ не столь эффективен, как гемодиализ, он осуществляется в течение более
длительных периодов времени. Перитонеальный диализ возможно проводить в домашних условиях самим пациентом. Это дает пациенту большую степень свободы и независимости, потому что он не должен приходить в клинику несколько раз в неделю. Он также может быть проведен во время поездки с минимальным количеством специализированного оборудования. Перед началом перитонеального диализа, пациенту проводят небольшую хирургическую процедуру, чтобы вставить катетер в брюшную полость.
Во время гемодиализа происходит удаление находящихся в крови веществ путём диффузии и конвекции, которые зависят от свойств гемодиализной мембраны, а также удаление лишней воды из организма (ультрафильтрация).
Диффузия во время гемодиализа осуществляется через искусственную избирательно проницаемую мембрану, с одной стороны которой находится кровь пациента, а с другой — диализирующий раствор. В зависимости от размера пор и других характеристик мембраны из крови могут удаляться вещества с различной молекулярной массой — от натрия, калия, мочевины до белков (β2-микроглобулин). Из диализирующего раствора в кровь пациента также могут переходить электролиты (натрий, калий, кальций, хлорид и т. д.) и крупномолекулярные вещества. Поэтому диализирующий раствор содержит определенную концентрацию электролитов для поддержания их баланса в организме пациента и проходит специальную очистку, чтобы не допустить попадания бактериальных токсинов или токсичных веществ в кровоток пациента. Следует отметить, что при диффузии из крови практически не удаляются связанные с белками и гидрофобные токсические вещества.
Конвекция осуществляется через ту же гемодиализную мембрану за счёт разницы в давлении со стороны крови и диализирующего раствора. Она позволяет удалить гидрофобные токсические вещества.
Ультрафильтрация происходит за счёт трансмембрального давления (давления крови на полупроницаемую мембрану), создаваемого роликовым насосом. Современные аппараты для проведения гемодиализа оснащены электронными блоками автоматического расчёта необходимого трансмембрального давления для снятия необходимого количества жидкости. Применяется при необходимости очищения крови от находящихся в ней вредных для организма веществ при следующих патологических состояниях:
Острая почечная недостаточность. Хроническая почечная недостаточность.
Отравления ядами и лекарствами (способными пройти через гемодиализную мембрану).
Тяжёлые нарушения электролитного состава крови.
Отравление спиртами
Гипергидратация, угрожающая жизни (отёк лёгких, отёк головного мозга и т. п.), не снижаемая консервативной терапией. Чаще применяется изолированная ультрафильтрация
Осложнения при гемодиализе: Перикардит Анемия
Болезни костей.Остеомаляция из-за нарушения обновления костной ткани и микроцитарная анемия возникают в результате алюминиевой
интоксикации (из-за поглощения алюминия из диализирующего раствора или
приема больших доз гидроксида алюминия)
Артериальная гипертония. Чтобы избежать артериальной гипотонии , нужно
точно рассчитывать объем плазмы, который можно безопасно удалить из сосудистого русла, и проводить гемофильтрацию без гемодиализа либо гемодиализ при относительно высокой концентрации натрия в диализирующем
растворе.
Накапливание калия в крови
Поражение нервной системы. Диализная деменция ( снижение интеллекта , эпилептические припадки , нарушения на ЭЭГ ).
Быстрое снижение осмоляльности плазмы может вызвать гипоосмолярный диализный синдром (оглушенность , спутанность сознания и эпилептические припадки ). Кроме того, быстрые изменения уровней электролитов, особенно калия, могут привести к нарушениям сердечного ритма.
У больных на гемодиализе нередко выявляют HBsAg и HCAg , что объясняется снижением иммунитета и частыми переливаниями крови.
Заболевания ЖКТ
1. Хронический гастрит: этиология, классификация, принципы диагностики.
Хронический гастрит (ХГ) — хроническое воспалительно-дистрофическое заболевание желудка, сопровождающееся структурной перестройкой его слизистой оболочки с прогрессирующей атрофией железистого эпителия, нарушениями секреторной, моторной и нередко инкреторной функций желудка.
Этиология. ХГ является полиэтиологическим заболеванием. В настоящее время к наиболее вероятным причинам, вызывающим ХГ, относятся следующие:
•инфицирование слизистой оболочки желудка Helicobacter pylori (HP); значительно реже инфицирование осуществляется вирусом герпеса, цитомегаловирусами или грибковой флорой;
•определенный генетический фактор, приводящий к образованию аутоантител к обкладочным клеткам;
• повреждающее действие дуоденального содержимого (желчных кислот, лизолецитина) на слизистую оболочку желудка при рефлюксе его содержимого после резекции желудка и органосберегающих операций.
Кроме этого, выделяют факторы, способствующие развитию ХГ. Их можно разделить на две большие группы — экзогенные и эндогенные. Не являясь причинными, они приводят к обострению и прогрессированию заболевания.
Кэкзогенным факторам относят: 1) нарушение; 2) курение и алкоголь; 3) профессиональные вредности (заглатывание ме¬таллической, хлопковой пыли, паров, щелочей и кислот); 4) длительный прием некоторых лекарственных средств (салицилаты, преднизолон, пре¬параты наперстянки).
Кэндогенным факторам относятся:
1) хронические инфекции (полости рта и носоглотки, неспецифичес-кие заболевания органов дыхания и туберкулез, хронический холецистит и пр.); 2) заболевания эндокринной системы (болезнь Аддисона, гипотиреоз, диффузный токсический зоб, болезнь Иценко —Кушинга, сахарный диабет); 3) нарушение обмена веществ (ожирение, дефицит железа, подагра); 4) заболевания, приводящие к тканевой гипоксии (сердечная и легочная недостаточность и пр.); 5) аутоинтоксикация (уремия).
Классификация.
Общепринятой клинической классификацией является Хьюстенская модификация гастритов, 1996 г.
Сиднейская система классификации хронических гастритов
Тип гастрита |
Этиологические |
Синонимы (прежние |
|
факторы |
классификации) |
||
|
|||
|
|
|
|
|
|
Поверхностный |
|
Неатрофический |
Helicobacterpylori |
Хронический антральный |
|
Гастрит типа В |
|||
|
Другие факторы |
||
|
Гиперсекреторный гастрит |
||
|
|
||
|
|
|
|
|
|
Гастрит типа А |
|
Атрофический |
Иммунные механизмы |
Диффузный гастрит тела желудка, |
|
аутоиммунный |
ассоциированный с В12-дефицитной |
||
|
|||
|
|
анемией и с пониженной секрецией |
|
|
|
|
|
Атрофический |
Helicobacter pylori |
Смешанный гастрит |
|
Нарушения питания |
|||
мультифокальный |
типа А и В |
||
Факторы среды |
|||
|
|
||
|
|
|

Особые формы
|
Химические |
Реактивный гастрит типа С |
|
||
Химический |
раздражители: |
|
|||
|
|
||||
Желчь (ДГР) |
Реактивный рефлюкс-гастрит |
|
|||
|
|
||||
|
Приём НПВП |
|
|||
|
|
|
|||
|
|
|
|
|
|
Радиационный |
Лучевое поражение |
|
|
||
|
|
|
|
|
|
|
Идиопатический |
Гастрит, ассоциированный с |
|
||
Лимфоцитарный |
Иммунные механизмы |
|
|||
целиакией |
|
||||
|
Глютен |
|
|
||
|
|
|
|
||
|
|
|
|
|
|
|
Болезнь Крона |
|
|
||
|
Саркоидоз |
|
|
||
Гранулематозный |
ГранулематозВегенера |
Изолированный гранулематоз |
|
||
|
Инородные тела |
|
|
||
|
Идиопатический |
|
|
||
|
|
|
|
|
|
Эозинофильный |
Пищевая аллергия |
Аллергический |
|
||
Другие аллергены |
|
||||
|
|
|
|||
|
|
|
|
|
|
Другие |
Бактерии (кроме |
|
|
||
Helicobacter pylori) |
|
|
|||
инфекционные |
|
|
|||
Грибы, Паразиты |
|
|
|||
|
|
|
|||
|
|
|
|
|
|
Гигантский |
Болезнь Менетрие |
|
|
||
гипертрофический |
|
|
|||
|
|
|
|
|
|
Диагностические критерии: |
|
|
|
||
|
|
При хронических гастритах выраженных клинических |
|
||
|
|
симптомов не наблюдается, возможныесимтомы: |
|
||
|
|
• |
при хроническом антральном поверхностном H.pylori- |
|
|
|
|
ассоциированном гастрите возможны «язвенноподобный» |
|
||
|
|
вариант диспепсии (тупые боли в эпигастриии/или в |
|
||
|
|
пилородуоденальной зоне» или дискинетический вариант |
|
||
Жалобы |
|
«желудочной диспепсии» - чувство быстрого насыщения, |
|
||
|
переполнения после еды, вздутия живота, тошнота; |
|
|||
|
|
• |
при хроническом атрофическом мультифокальном |
|
|
|
|
гастрите возможны симптомы «желудочной диспепсии» – |
|
||
|
|
чувство быстрого насыщения, переполнения после еды, вздутия |
|
||
|
|
живота, тошнота; |
|
|
|
|
|
• |
при аутоиммунном атрофическом – симптомы В-12- |
|
|
|
|
дефицитной анемии и могут быть симптомы «желудочной |
|
||
|
|
диспепсии» (смотреть выше). |
|
||
|
|
|
|
|
|
|
|
• |
при хроническом антральном поверхностном H.pylori- |
|
|
|
|
ассоциированном гастрите в анамнезе: отягощенная |
|
||
|
|
наследственность по гастродуоденальной патологии (ГДП). |
|
||
Анамнез |
|
Нарушение режима питания, сухоедение злоупотребление |
|
||
|
острой, копченной и жаренной пищи, газированных напитков; |
|
|||
|
|
|
|||
|
|
• |
при хроническом атрофическом мультифокальном |
|
|
|
|
гастрите – в анамнезе длительное течение |
|
||
|
|
хроническогоантрального поверхностногоH.pylori- |
|
||
|
|
|
|
|
|

|
ассоциированного гастрита; |
||
|
• |
при аутоиммунном атрофическом гастрите – наличие |
|
|
аутоиммунных заболеваний (аутоиммунныйтиреоидит, гипо- |
||
|
или гиперфункция щитовидной и паращитовидных желез, СД |
||
|
Iтипа, аутоиммунная (пернициозная) анемия). |
||
|
|
|
|
|
• |
при хроническом антральном поверхностном H.pylori- |
|
|
ассоциированном гастрите могут быть при пальпации живота |
||
|
умеренная болезненность в эпигастральной и в пилоро- |
||
|
дуоденальной области, метеоризм; |
||
Физикальное |
• |
при хроническом атрофическом мультифокальном |
|
гастрите – "полированный" язык, или обложенный густым |
|||
обследование |
|||
белым налетом.При пальпации живота умеренная разлитая |
|||
|
|||
|
болезненность в эпигастральной области; |
||
|
• |
при аутоиммунном атрофическом гастрите –признаки |
|
|
авитаминоза, глоссит, фуникулярныймиелоз, симптомы анемии, |
||
|
гепатомегалия, реже –спленомегалия. |
||
|
|
|
|
Лабораторные исследования – тест на H.pylori:
|
Взятый при эндоскопии биоптат помещается в специальный |
быстрый уреазный тест в |
раствор с содержанием мочевины и при добавлении индикатора |
биоптатах СОЖ |
происходит изменение цвета от слабо розового до темно- |
|
красного при наличии H.pylori |
|
|
Инструментальные исследования
|
• |
При поверхностном антральномH.pylori ассоциированном |
Фиброэзофагогастродуо |
гастрите – гиперемия, геморрагии ОЖ |
|
деноскопия с |
• |
При атрофическоммультфиокальном и аутоимунном |
прицельной биопсией |
гастритах – бледность и истончение СОЖ, просвечивание |
|
|
сосудов |
|
|
|
|
|
• |
при поверхностном антральномH.pylori ассоциированном |
Гистологическое и |
гастрите – нейтрофильная инфильтрация межэпителиальных |
|
цитологическое |
пространств; |
|
исследование биоптата |
• |
при атрофических гастритах – атрофия железистого |
|
аппарата, кишечная метаплазия эпителия. |
|
Характер нарушений желудочной секреции определяют по данным |
||
фракционного исследования желудочного сока тонким зондом. Главный признак данного варианта гастрита — секреторная недостаточность желудка — приобретает достаточную надежность лишь при проведении гис-таминовой стимуляции. Исследование проводят следующим образом. Утром натощак после удаления содержимого желудка в течение часа изу¬чается базальная секреция. После получения базального секрета вводится гистамин 0,008 мг на 1 кг массы тела — субмаксимальный гистаминовый тест. Максимальный гистаминовый тест — 0,025 мг на 1 кг массы тела гистамина — применяется редко, так как возможны побочные явления, хотя за 30 мин до введения гистамина предварительно вводят антигистаминный препарат. На протяжении следующего часа собирают отделяющийся сок. Все исследование длится 2 ч.
При рентгеноскопии желудка выявляются нарушения его эвакуаторной и моторной функций. У больных ХГ с секреторной недостаточностью отмечаются усиленная моторика и ускорение эвакуации взвеси сульфатабария. Рентгеноскопия желудка также важна для отграничения ХГ от рака.
Локальное отсутствие сократимости желудка очень подозрительно на опухолевый процесс с инфильтративным, эндофитным ростом.
Клинический и биохимический анализы крови, исследование кала помогают установить вовлечение в патологический процесс других органов и систем. Так, при поражении поджелудочной железы в крови может быть увеличен уровень амилазы, ингибитора трипсина, а в кале — нейтрально¬го жира. Повторное исследование кала на скрытую кровь в случае отрица¬тельного ответа позволяет отвергнуть предположение о кровотечении. По¬ложительная реакция Вебера настораживает в отношении кровоточащего полипа, эрозивного гастрита, язвы или рака желудка.
Перечень дополнительных диагностических мероприятий:
·ОАК – по показаниям;
·определение сывороточного железа в крови – при анемии;
·анализ кала на скрытую кровь – при анемии;
·УЗИ печени, желчных путей и поджелудочной железы – по показаниям(при
хроническом аутоиммунном атрофическом гастритеи/или при сопутствующей патологии гапатобилиарнойсистемы); · биохимические анализы крови: общий билирубин и его фракций, общий белок,
альбумин, холестерин, АЛТ,АСТ, глюкозы, амилазы – (при хроническом аутоиммунном атрофическом гастрите и/илипри сопутствующей патологии гапатобилиарнойсистемы);
·Определение антител к париетальным клеткам–при хроническом аутоиммунном атрофическом гастрите;
·Определение в крови уровня гастрина-17 и пепсиногенаI(ПГ I) и пепсиногенаII(ПГ
II)– при мультифокальном атрофическом гастрите;
·интрагастральная рН-метрия – при тяжелой степени атрофического гастрита;
·рентгенологическое исследование верхних отделов ЖКТ с барием – по
показаниям (при пилоростенозе, наличии противопоказаний к эндоскопическим исследованиям и отказе пациента от ФЭГДС).
2. Хеликобактерный гастрит: клиника, диагностика, лечение.
Хронический гастрит (ХГ) — хроническое воспалительно-дистрофическое заболевание желудка, сопровождающееся структурной перестройкой его слизистой оболочки с прогрессирующей атрофией железистого эпителия, нарушениями секреторной, моторной и нередко инкреторной функций желудка.
Ассоциированный с HP — антральный гастрит (ХГ типа В).
При ХГ типа А при рентгенологическом исследовании отмечается угнетение моторики («вялый» желудок), тогда как при ХГ типа В — усиление моторики («раздраженный» желудок).
В зависимости от вовлечения в патологический процесс фундального или антрального отдела клиническая картина ХГ меняется. Так, при развитии процесса только в фундальном отделе отмечаются ранние, умерен-ной интенсивности разлитые боли в эпигастральной области; фундальный гастрит создает предпосылку для образования язвы желудка. При изменении слизистой оболочки антрального отдела центральное место в клинической картине занимают поздние боли, локализующиеся в пилородуоденальной ббласти, и синдром «ацидизма»; чаще встречается у лиц молодого возраста и предрасполагает к развитию язвы двенадцатиперстной кишки.
Клиническую картину распространенного ХГ составляют следующие основные синдромы: 1) желудочная диспепсия; 2) боли в эпигастрии; 3) ки-шечная диспепсия; 4) астеноневротический синдром. Реже встречаются ане¬мический синдром, проявления полигиповитаминоза и гипокортицизма.
В тяжелых случаях ХГ типа А нередко развивается В12-дефицитная анемия и выявляются характерные клинические признаки: бледность кожи, глоссит, неврологические нарушения и др.
При обострении ХГ клинические проявления выражены ярко:
1)желудочная диспепсия (у 90 % больных) проявляется тяжестью, давлением, распиранием в эпигастральной области после еды, отрыжкой, срыгиванием, изжогой, тошнотой, рвотой, изменением аппетита, неприят¬ ным вкусом во рту;
2)боли в эпигастрии носят неинтенсивный характер;
3)симптомы кишечной диспепсии встречаются менее чем у половины
больных (20 — 40 %) и проявляются метеоризмом: урчанием и переливани¬
ем в животе; нарушением стула (запоры, поносы, неустойчивый стул); 4) астеноневротический синдром выражен практически у всех боль¬
ных при обострении ХГ, о чем свидетельствуют раздражительность, неус¬ тойчивость настроения, мнительность, канцерофобия, быстрая утомляе¬ мость, плохой сон.
Клиническая картина гастрита с секреторной недостаточностью отличается от проявлений ХГ с сохраненной и повышенной секреторной функцией.
Диагностика исследуют желудочную секрецию. При этом выявляется повышение тощаковой и базальной секреции, общей кислотности: в стимулированную фазу ее показатели равны 80 — 100 титрационным единицам и более, базальной кислотной продукции — 1,5 — 5,5 ммоль и выше, уровня пепсина — 2,1—4,5 г/л и выше. Анализ ацидограммы (если определяют рН желудочного сока) показывает сле¬дующие изменения: при нормацидном состоянии рН базальной фазы 1,6 — 2,0; стимулированной — 1,2 — 2,0; при гиперацидном состоянии — соот¬ветственно 1,5 и 1,2.
При рентгенологическом исследовании пищеварительного тракта в желудке обнаруживают грубые ригидные складки, спазм привратника. Спастические явления прослеживаются и при прохождении бария по толстой кишке.
Фиброгастродуоденоскопия, проведенная в стадии обострения про-цесса, выявляет отек слизистой оболочки, очаги гиперемии, плотную фик-сацию слизи на складках слизистой оболочки желудка при поверхностном гастрите. При гипертрофическом гастрите отмечаются бархатистость или зернистость слизистой оболочки, утолщение складок, выраженная ги¬перемия.
Значение гастродуоденоскопии велико в дифференциации данного клинического варианта ХГ и язвенной болезни двенадцатиперстнойкишки. Обнаружение язвенной «ниши», рубца или рубцовой деформации луковицы двенадцатиперстной кишки исключает ХГ как нозологически самостоятельную патологию.
Морфологические исследования биоптата слизистой оболочки выявля¬ют при поверхностном гастрите дистрофические изменения поверхностного (ямочного) эпителия, а при более глубоком поражении желудка — вовлече¬ние в процесс желез. Клетки желез, преимущественно главных и париеталь¬ных, гиперплазируются, подвергаются вакуолизации и другим изменениям.
Лечение.
Немедикаментозное лечение и общие мероприятия включают:
Диета:
·питание полноценное и разнообразное;
·режим питания дробный, до 6 раз в сутки, малыми порциями;
·ограничение механических и химических раздражителей ЖКТ, стимуляторов желудочной секреции, веществ, длительно задерживающихся в желудке;
·исключение очень горячих и очень холодных блюд;
Исключаются |
Разрешаются |
|
|
• сокогонные продукты и блюда (мясные, |
• овощные, крупяные, |
рыбные, грибные бульоны) |
молочные супы |
|
|
• продукты с соединительной тканью (хрящи, кожа |
• отварное нежирное мясо и рыба |
||
птицы и рыбы, жилистое мясо) |
• |
яйцо всмятку, паровой омлет |
|
• жирные сорта мяса и рыбы |
• |
свежий некислый творог, сыры |
|
• |
маринады, соления, приправы |
• |
подсушенный пшеничный хлеб |
• свежий хлеб, изделия из теста из муки грубого |
• |
белые сухари, несдобное печенье |
|
помола, пшено |
• |
хорошо разваренные каши |
|
• |
блины, пироги, пирожные |
• вермишель и лапша из белой муки |
|
• |
овощи, содержащие грубую клетчатку (горох, |
• овощные и картофельное пюре |
|
фасоль, бобы, репа), грибы |
• |
салаты, винегреты с |
|
• незрелые и фрукты и ягоды с грубой кожицей, |
растительным маслом |
||
• |
кислые фруктово-ягодные соки |
• некислые фруктово-ягодные соки с |
|
• |
шоколад, какао, кофе, крепкий чай, газированные |
мякотью |
|
напитки |
• |
молоко и молочные |
|
|
|
продукты (ряженка, йогурты) |
|
|
|
• щелочные минеральные воды без |
|
|
|
углекислоты |
|
|
|
• |
некрепкий чай |
|
|
|
|
Медикаментозное лечение.
Учитывая различные этиопатогенетические факторы развития хронического гастрита медикаментозная терапия различается при различных формах хронического гастрита.
Принципы фармакотерапии неатрофического гастрита:
·эрадикационная антихеликобактерная терапия у НР–положительных
больных;
·обязательный контроль эффективности антихеликобактериной терапии через 4–6 недель;
·влияние на факторы риска (замена НПВП парацетамолом, селективными ингибиторами ЦОГ–2, сочетание НПВП с мизопростолом, обеспечение комплаентности больных и др.).
Принципы фармакотерапии атрофического гастрита:
·эрадикационная антихеликобактерная терапия у НР–положительных
больных;
·обязательный контроль эффективности антихеликобактерной терапии через 4–6 недель;
·применение витамина В12 с целью профилактики и лечения пернициозной
анемии.
Ингибиторы протонной помпы –ИПП являются самыми мощными антисекреторными препаратами Они назначаются с целью купирования болевого синдрома и диспепсических расстройств, а также для достижения быстрой ремиссии
[1, 2].
Блокаторы Н2гистаминовых рецепторов являются препаратами 2-й линии,
которые могут применяться в случаях непереносимости или противопоказаниях ИПП. Также блокаторы Н2гистаминовых рецепторов могут использоваться в качестве дополнительной терапии совместно с ИПП.
Антацидыспособны поддерживать уровень внутрижелудочного рН> 3 на протяжении 4-6 часов в течение суток, что определяет их недостаточно высокую эффективность при применении в качестве монотерапии. Тем не менее, больные сХГ принимают
антациды для купирования болей и диспепсических жалоб, что во многом объясняется быстротой их действия и безрецептурным отпуском [2].
Противомикробные препараты применяются при ХГ, ассоциированной с H. Pylori. С эрадикационной целью в комбинации с ИПП используются аминопенициллины (амоксициллин), макролиды (клатримицин) в качестве препаратов линии и препараты резерва при неэффективности стандартного лечения: фторхинолоны (левофлоксацин),нитроимидазолы (метронидазол), тетрациклины и препараты висмута.
Медикаментозная терапия ХГ, ассоциированного с H. Pylori
Успешность эрадикации H.Pylori, обуславливает безрецидивное течение, что является положительным прогностическим признаком в лечении ХГ.
Рекомендуемые схемы эрадикации(Маастрихт-V, 2015) Терапия первой линия(10-14 дней):
·3-х компонентная схема: ИПП +амоксициллин +кларитромицин;
·квадротерапия без висмута: ИПП+амоксициллин+кларитромицин +нитроимидазол.
Терапия второй линии(10-14 дней):
·3-х компонентная схема: ИПП+амоксициллин+фторхинолон
·квадротерапия без висмута: ИПП+амоксициллин+кларитромицин +нитроимидазол[8,9,10], (УД А);
·квадротерапия с висмутом: ИПП+амоксициллин+кларитромицин +висмута трикалиядицитрат.
Эффективность лечения повышается при назначении дважды в день повышенной дозы ИПП (удвоенной стандартной) [11,12], (УД B).
При 14-дневной терапии увеличение частоты эрадикации более значительно, чем при
10-дневной [11,12,13],(УД С).
Эрадикационная терапия H. pylori может приводить к развитию антибиотикоассоциированной диареи [14],(УД С). Добавление к стандартной тройной терапии пробиотика Saccharomycesboulardii повышает скорость эрадикации H.pylori [11,12, 13](УД D).
Перечень основных медикаментов, применяемых при ХГ
№ |
МНН |
Форма выпуска |
Режим дозирования |
УД |
|
|
|
|
|
|
|
Ингибиторы протонной помпы |
|
|
|||
|
|
|
|
|
|
|
|
Капсулы (в т.ч. |
|
|
|
|
|
кишечнорастворимые, с |
|
|
|
1 |
Омепрозол |
пролонгированным |
Перорально 20 мг 2 раза в сутки |
А |
|
высвобождением, |
|||||
|
|
|
|
||
|
|
гастрокапсулы) 10 мг, 20 мг и |
|
|
|
|
|
40 мг |
|
|
|
|
|
|
|
|
|
|
|
Капсулы (в т.ч. с |
|
|
|
2 |
Лансопразол |
модифицированным |
Перорально 15 мг 2 раза в сутки |
А |
|
|
|
высвобождением) 15 мг и 30 мг |
|
|
|
|
|
|
|
|
|
3 |
Пантопразол |
Таблетки, покрытые оболочкой |
Перорально 20 мг 2 раза в сутки. |
А |
|
(в т.ч. кишечнорастворимой); с |
|
||||
|
|
|
|
||
|
|
|
|
|
|

|
|
отложенным высвобождением |
|
|
|
|
|
20мг и 40 мг |
|
|
|
|
|
|
|
|
|
|
|
Таблетки / капсулы, покрытые |
|
|
|
4 |
Рабепразол |
кишечнорастворимой |
Перорально 10 мг 2 раза в сутки. |
А |
|
|
|
оболочкой 10 мг и 20 мг |
|
|
|
|
|
|
|
|
|
|
|
Таблетки / Капсулы (в т.ч. |
|
|
|
5 |
Эзомепразол |
кишечнорастворимые, твердые |
Перорально 20 мг 2 раза в сутки. |
А |
|
и пр.) 20 мг и 40 мг |
|||||
|
|
|
|
||
|
|
|
|
|
|
Блокаторы Н2гистаминовых рецепторов |
|
|
|||
|
|
|
|
|
|
|
|
Таблетки, покрытые оболочкой |
|
|
|
6 |
Фамотидин |
(в т.ч. пленочной) 20 мг и 40 мг |
Перорально 20 мг 2 раза в сутки. |
А |
|
|
|
|
|
|
|
|
|
Таблетки, покрытые оболочкой |
Перорально 150 мг 2 раза в |
|
|
7 |
Ранитидин |
(в т.ч. пленочной) 150мг и |
А |
||
сутки |
|||||
|
|
300мг |
|
||
|
|
|
|
||
|
|
|
|
|
|
Витамины |
|
|
|
||
|
|
|
|
|
|
|
|
|
Вводят в/м, п/к, в/в. |
|
|
|
Цианокобаламин |
Раствор для инъекций 0,02 % и |
П/к, при анемиях, связанных с |
|
|
8 |
(витамин В12) |
дефицитом витамина В12, |
А |
||
0,05 % |
|||||
|
|
вводят по 0,1 – 0,2 мг 1 раз в 2 |
|
||
|
|
|
|
||
|
|
|
дня |
|
|
|
|
|
|
|
|
Противомикробные препараты при хроническом гастрите, ассоциированным с H.pylori
|
|
Таблетки, в т.ч. покрытые |
Перорально 1000 мг 2 раза в |
|
|
8 |
Амоксициллин |
оболочкой, диспергируемые; |
А |
||
сутки |
|||||
|
|
капсулы 500мг, 1000мг |
|
||
|
|
|
|
||
|
|
|
|
|
|
|
|
Таблетки, в т.ч. с |
|
|
|
9 |
Кларитромицин |
модифицируемым |
Перорально 500 мг 2 р/сутки |
А |
|
|
|
высвобождением 500мг |
|
|
|
|
|
|
|
|
|
|
|
|
Квадротерапии с висмутом: 250 |
|
|
|
|
|
мг перорально 4 р/сутки |
|
|
10 |
Метронидозол |
Таблетки 250 мг |
Тройная терапия на основе |
А |
|
|
|
|
кларитромицина: 500 мг |
|
|
|
|
|
перорально два раза в сутки |
|
|
|
|
|
|
|
|
|
|
|
Перорально 500 мг 2 раза в |
|
|
|
|
|
сутки только при |
|
|
|
|
Таблетки, покрытые оболочкой |
подтвержденной устойчивости к |
|
|
11 |
Левофлоксацин* |
другим противомикробным |
С |
||
500мг |
|||||
|
|
препаратам и высокой |
|
||
|
|
|
|
||
|
|
|
чувствительностью к |
|
|
|
|
|
Левофлоксацину |
|
|
|
|
|
|
|
|
|
|
|
|
Перорально 100 мг 4 раза в |
|
|
|
|
|
|
|
|
сутки только при |
|
|
|
|
|
Таблетки, покрытые оболочкой |
|
подтвержденной устойчивости к |
|
|
||
12 |
Тетрациклин* |
|
другим противомикробным |
С |
||||
100 мг |
|
|
||||||
|
|
|
|
препаратам и высокой |
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
чувствительностью к |
|
|
|
|
|
|
|
|
Тетрациклину |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Назначают по 1 таб. 4 р/сутки за |
|
|
|
|
|
|
|
|
30 минут до приема пищи и на |
|
|
|
|
Висмута |
Таблетки, покрытые |
|
ночь или по 2 таблетки 2 раза в |
|
|
||
13 |
оболочкой, 120 мг |
|
|
сутки за 30 мин до приема |
В |
|||
|
трикалиядицитрат |
|
|
|
пищи. Максимальная разовая |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
доза 240 мг, максимальная |
|
|
|
|
|
|
|
|
суточная 480 мг. |
|
|
|
NB! * показание не зарегистрировано |
|
|
|
|
|
|
||
Перечень дополнительных медикаментов, применяемых при ХГ |
|
|
|
|||||
№ |
МНН |
|
Форма выпуска |
Режим дозирования |
УД |
|
||
|
|
|
|
|
|
|
||
|
|
|
Таблетки, в т.ч. |
|
|
|
||
2 |
Магния гидроксид и алюминия |
жевательные |
|
Разовая доза по |
А |
|
||
гидроксид |
|
Суспензия для приема |
требованию |
|
||||
|
|
|
|
|||||
|
|
|
внутрь |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблетки |
|
|
|
|
|
3 |
Кальция карбонат + натрия |
жевательные |
|
Разовая доза по |
А |
|
||
гидрокарбонат + натрия альгинат |
Суспензия для приема |
требованию |
|
|||||
|
|
|
||||||
|
|
|
внутрь |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Атрофический гастрит: этиология, патогенез, клиника, диагностика, лечение.
Этиология и Патогенез: Основную роль в патогенезе играют аутоиммунные механизмы. Это подтверждает сочетание гастрита с другими аутоиммунными заболеваниями, такими как аутоиммунный тиреоидит, В12-дефицитная анемия, полигландулярная эндокринная патология, дефицит IgA и пр. Наиболее характерный признак аутоиммунного гастрита - наличие AT к париетальным клеткам и внутреннему фактору Касла. Аутоиммунное поражение париетальных клеток слизистой оболочки желудка приводит к их гибели, атрофии фундальных желёз и ахлоргидрии. Аутоантитела к внутреннему фактору блокируют его соединение с витамином В12, что приводит к развитию витамин В12-дефицитной анемии.
