
Сборник задач по дисциплине «Химия воды с основами микробиологии» для практических занятий. Яценко В.Н., Бабкин В.Ф
.pdf2.Составить уравнения реакций гидролиза в ионной и молекулярной формах для хлоридов сурьмы и висмута.
3.Написать в ионной и молекулярной формах уравнения реакций гидролиза следующих солей:
а) |
Хлорида индия; |
в) |
Хлорида таллия (III); |
б) |
Хлорида галлия; |
г) |
Нитрата скандия; |
|
|
д) |
Нитрата индия. |
4.Какую реакцию на лакмус имеет раствор фторида таллия (II)?
5.Какая из солей, фосфат или гидрофосфат натрия, в большей степени подвергается гидролизу? Почему? Составьте уравнения реакций гидролиза обеих солей в ионной и молекулярной формах.
6.Карбонат или гидрокарбонат калия в большей степени подвергается гидролизу? Почему? Написать уравнения гидролиза обеих солей в ионной и молекулярной формах.
7.При сливании растворов сульфата меди (II) и карбоната натрия наблюдается образование зеленого осадка гидроксикарбоната меди и выделение двуокиси углерода. Дать объяснение этому явлению и написать уравнения реакций в молекулярной и ионной формах.
8.При сливании растворов хлорида цинка и карбоната калия наблюдается образование белого осадка гидроксикарбоната цинка и выделение двуокиси углерода. Дать объяснение этому явлению и написать уравнение реакции в молекулярной и ионной формах.
9.При сливании растворов сульфата хрома (III) и сульфида калия образуется осадок гидроокиси хрома. Объяснить его образование и выразить происходящую реакцию молекулярным и ионным уравнениями.
10.Составить молекулярные и ионные уравнения реакции, происходящей при смешивании растворов хлорида алюминия и сульфида натрия.
11.При смешивании концентрированных растворов нитрата железа (III) и карбоната калия выделяется двуокись углерода и
21
образуется осадок гидроокиси железа. Объяснить его образование и выразить реакцию молекулярным и ионным уравнениями.
12.При смешивании растворов силиката натрия и хлорида аммония выпадает осадок кремниевой кислоты и выделяется аммиак. Объясните их образование и выразите реакцию молекулярным и ионным уравнениями.
13.Написать уравнение гидролиза хлоридов четырехвалентных циркония и титана в молекулярной и ионной формах, имея в виду, что продуктами гидролиза являются оксихлориды циркония и титана.
14.Что такое степень гидролиза?
15.Почему образующиеся при гидролизе основные соли, практически нерастворимые в воде, в большинстве случаев всё же остаются в растворе?
16.Как влияет на гидролиз: а) нагревание раствора?; б) давление раствора?
17.В какую сторону будет смещаться равновесие гидролиза в растворах карбоната натрия и сульфида калия при добавлении к ним щёлочи?
18.В какой среде и почему устойчивы цинкаты, аминаты, хромиты?
19.Какая из солей, сульфат ацетат или карбонат алюминия, в большей степени подвергается гидролизу? Почему?
7. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАЦИИ
В составе реагирующих веществ содержатся атомы, имеющие определенную степень окисления. Те реакции, в результате которых эти атомы не изменяют степень окисления, не являются окислительно-востановительными. Например:
+1+5-2+1 |
-2 +1 +1 +5 -2 +1 -2 |
+ = + .
В данном случае степень окисления каждого из атомов до и после реакции осталась без изменения.
+1+5-1 |
+1 -1 |
0 |
2 |
= 2 |
+3 . |
22
Здесь атомы хлора и кислорода изменяют степень окисления. Реакции, протекающие с изменением степени окисления атомов
входящих в состав реагирующих веществ, называются окислительновосстановительными.
Процесс отдачи электронов атомом, молекулой или ионом
называется окислением. Например: |
|
− = |
|
||
Если в |
−6 = |
; |
2 |
. |
|
− = |
реакции |
− 2ē = |
или ионы |
||
|
результате |
атомы, |
молекулы |
|
|
присоединяют электроны, то мы имеем дело с процессом восстановления. Например:
+2ē = ; +2ē = 2 ; +ē = .
Как видно, в данных случаях происходит принятие электронов атомами, молекулами и ионами – такие атомы, молекулы и ионы называются восстановителями.
Окислители это тоже атомы, молекулы и ионы которые в процессе реакции присоединяют электроны. Окислители восстанавливаются, а восстановители окисляются.
Число отданных электронов в реакции должно равняться числу принятых. Это лежит в основе подбора коэффициентов в уравнениях окислительно-восстановительных реакций. Например:
+ = + .
Подбор коэффициентов в уравнении реакции проводят в следующей последовательности:
1. Находят окислитель и восстановитель, для чего определяют элементы, меняющие свою степень окисления.
+2 |
+3 |
→ |
+4 |
+2 |
|
+ |
+ |
. |
2.Определяют электронный баланс и записывают схему перехода электронов.
+2 +4
− 2ē → .
+3 +2
+1ē → .
23
Электронного баланса число отданных и принятых электронов должно быть одинаково. Это записывается в виде схемы:
|
+2 |
−2ē → |
+4 |
|
|
|
+3 |
+2 |
1 |
– восстановитель |
|
|
|
|
|
2 |
– окислитель |
Окислителем и |
восстановителем |
могут быть атомы, молекулы |
|||
|
+1ē → |
|
|
|
|
одного и того же вещества, разных веществ, вступающих в данную реакцию.
Задачи для самостоятельного решения 1. Составить полные уравнения следующих реакций. Узнать
окислитель и восстановитель. Какой из элементов окисляется, какой восстанавливается?
ба)) |
+ |
→ |
+ |
|
+ |
; |
; |
|
|
|
|
|
в) |
+ |
+ |
→ |
→ |
+ |
|
|
+ |
+ |
|
; |
|
г) |
+ |
+ |
+ |
|
|
|
+ |
; |
||||
д) |
+ |
|
|
→ |
+ |
+ |
+ |
; |
|
|||
е) |
+ |
+ |
+ |
→ |
+ |
+ |
|
; |
|
|||
ж) |
+ |
+ |
→ |
→ |
|
+ |
+ |
|
; |
|
||
з) |
+ |
+ |
→ |
|
+ |
+ |
+; |
|
|
|
||
и) |
+ |
|
|
|
+ |
; |
|
|
|
|||
к) |
+ |
+ |
→ |
→ |
+ |
;+ |
+ |
|
|
|
|
|
л) |
+ |
|
|
|
|
+ |
|
; |
|
|
||
м) |
+ |
+ |
+ |
→ |
|
|
+ . |
|
|
|||
|
+ |
|
→ |
( |
|
) + |
+ |
|
|
|
||
2. Составить полные уравнения следующих реакций. Узнать окислитель и восстановитель. Какой из элементов окисляется, какой
восстанавливается? |
+ |
→ + |
|
+ |
+ ; |
|
|
ба)) |
+ |
+ |
; |
||||
в) |
+ |
+ |
→ |
+ |
+ |
; |
|
г) |
+ |
+ |
→ |
+ |
+ |
+ |
; |
д) |
+ |
+ |
→ |
+ |
+ |
+ |
; |
|
+ |
+ |
→ |
+ |
+ |
+ |
|
24
же)) |
+ |
+ |
→ + |
|
+ |
+ |
+ |
; |
; |
|
з) |
+ |
+ |
→ |
+ |
+ |
; |
|
|
|
|
и) |
+ |
+ |
→ |
; |
+ |
|
|
|
|
|
к) |
+ |
→ |
+ |
+ |
+ |
|
+ |
|
+ |
; |
л) |
+ |
+ |
→ |
|
|
. |
|
|||
3. |
+ |
+ |
→ |
|
+ |
+ |
|
|
|
|
|
Составить |
полные |
уравнения |
следующих |
реакций. Узнать |
|||||
окислитель и восстановитель. Какой из элементов окисляется, какой восстанавливается?
а) |
+; |
|
+ |
→ ( ) + ( ) + |
+ |
|||
в) |
+ |
|
+ |
→ |
+ |
( |
) + |
; |
б) |
+ |
|
+ |
→ |
+ |
( |
) + |
; |
г) |
|
;+ |
||||||
д) |
+ |
; |
+ |
→ |
+ |
+ |
+ |
+ |
ж) |
+ |
+ |
→ |
( |
) + |
( ) |
||
+ |
|
+ |
→ + ( ) + |
+ |
. |
|||
е) |
+ |
|
+ |
→ + |
( |
) + |
+ |
; |
|
+ |
|
|
|||||
4. Составить полные уравнения следующих реакций. Узнать окислитель и восстановитель. Какой из элементов окисляется, какой восстанавливается?
ба)) |
( |
) + |
+ |
→ |
|
+ ( |
+ |
) +; |
; |
|
|
в) |
+ |
+ |
→ |
+ |
|
+ |
+ |
; |
|
|
|
г) |
+ |
+ |
→ |
+ |
; |
+ |
|
|
|
|
|
д) |
( ) |
+ + |
→ |
( ) |
|
+ |
; |
|
|
|
|
е) |
+ |
+ |
→ |
+ |
|
; |
|
|
|
|
|
ж) |
+ |
+ |
→ |
+ |
|
+ |
+ |
; |
|
|
|
з) |
+ |
+ |
→ |
|
+ |
|
+ |
; |
|
||
и) |
( ) + + |
|
→ |
|
+ |
+ |
|
+ |
; |
||
к) |
( ) + + |
→ |
→ |
|
+ |
. + |
|
|
|||
|
+ |
+ |
+ |
|
+ |
|
|
|
|
|
|
5. Составить полные уравнения следующих реакций внутримолекулярного окисления–восстановления:
25

ба)) |
→ |
+ |
; |
|
|
+; |
|
; |
в) |
( ) |
→ |
+ |
|
|
|
|
|
г) |
|
→ |
+ |
+ |
|
; |
|
|
д) |
→ |
+ |
; |
|
|
|||
е) |
|
→ |
+ |
+ |
+ |
; |
|
|
ж) |
|
→ |
; |
|
|
|||
з) |
→ |
+ |
; |
|
|
|
|
|
и) |
→ |
+ |
|
|
|
+ |
; |
|
к) |
( |
) → |
+. |
|
|
|
||
|
→ |
|
+ |
8. ЭЛЕКТРОЛИЗ |
||||
|
Электролизом |
называется процесс окисления-восстановления, |
||||||
происходящий в результате прохождения электрического тока через электролит.
Образующиеся продукты окисления-восстановления или остаются на поверхности электродов, или выделяются в виде газов, или вступают в реакцию между собой и с другими веществами, находящимися в растворе, образуя вторичные продукты электролиза.
Так, например: |
|
1. Схема электролиза расплавленного |
: |
|
|
(–) катод ← + 2 |
→ анод (+) |
|
||
То |
|
+2ē= |
|
2 |
− 2ē = |
|
|
есть, в результате электролиза хлористый кальций |
|||||
разлагается |
на кальций |
(выделяющийся на |
катоде) |
и хлор |
||
(выделяющийся на аноде). |
|
|
|
|
||
2. Схема электролиза водного раствора |
: |
|
||||
Катодные потенциалы ионов |
и молекул |
различны. Так |
||||
для восстановления |
катодный потенциал – |
2,71 В. |
Для |
|||
26

этот потенциал составляет – 0,83 В. Поэтому при прохождении тока через раствор у катода восстанавливается вода.
2 |
|
(–) катод |
← +2 |
→ анод (+) |
|
В |
+2ē = +2 |
. |
2 |
− 2ē = |
|
|
|
растворе остается |
|
|
|
|
При прохождении |
электрического( ) |
тока |
через электролиты, |
|
процессы подчиняются закону Фарадея: «Электрический ток,
проходя через раствор электролита, восстанавливает на катоде и окисляет на аноде количество вещества, пропорциональное количеству прошедшего электричества и химическим эквивалентам этих веществ. При окислении или восстановлении грамм эквивалента любого вещества расходуется 96500 кулонов электричества».
= |
96500 |
× |
= |
96500 |
× × , |
|
|
|
|
|
4) |
где – число эквивалентов; |
– |
количество электричества, Кл; – |
|||
сила тока, А; – время прохождения тока, сек.
Гальванические элементы.
Устройство, где происходит превращение химической энергии в энергию электрического тока, называется гальваническим элементом.
Схема гальванического элемента представлена на рисунке.
27
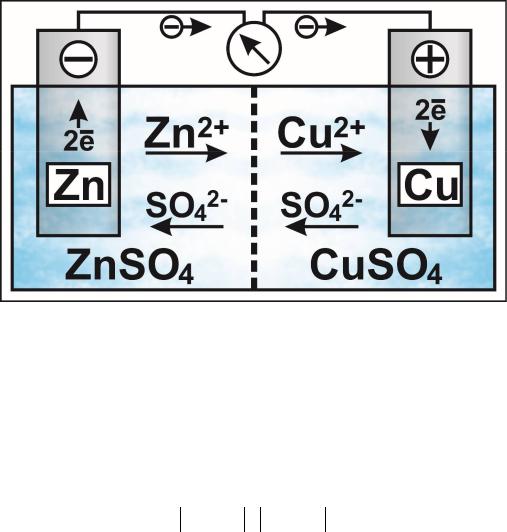
Схема медно-цинкового гальванического элемента
Уход электролитов с цинкового электрода приводит к его окислению:
+= + .
Гальванический элемент изображается в виде схемы. Схема медно-цинкового элемента имеет вид:
−
Для решения задач по данному разделу, необходимо пользоваться прил. 6, 7 данного пособия.
|
Задачи для самостоятельного решения |
1. Сколько граммов никеля выделяется при пропускании через |
|
раствор |
тока силой 5 А в течении 20 минут? |
2.Сколько времени нужно пропускать ток силой 20 А через раствор серной кислоты, чтобы выделить 22,4 л водорода, измеренных при нормальных условиях?
3.При пропускании через раствор соли серебра тока в 1 А в течении 5 часов на катоде выделяется 20,2 г серебра. Найти эквивалент серебра.
28
4. |
При пропускании тока через раствор |
на катоде за 2 |
ч |
||||||||||
40мин 50 сек образовалось 112 г |
. Определить силу тока. |
|
|||||||||||
5. |
Какие металлы и в какой последовательности будут |
||||||||||||
выделяться, если: |
|
|
|
|
|
|
|
|
|
|
|
|
|
а)железная пластина опущена в раствор, содержащий |
|||||||||||||
одновременно: |
|
|
опущена, |
и |
|
; |
|
|
|
|
|||
б)цинковая (пластина) , |
в |
раствор, |
|
содержащий |
|||||||||
одновременно: |
|
пластина) , |
|
|
и |
(раствор) ; |
|
|
|
||||
в)алюминиевая( |
,опущена в |
, |
содержащий |
||||||||||
одновременно: |
пластина) , |
|
опущена, |
и |
(раствор) ; |
|
|
|
|
||||
г)кадмиевая( |
|
в |
, |
|
содержащий |
||||||||
одновременно: |
,пластина, |
|
|
и |
|
; |
|
|
|
|
|
||
д)свинцовая |
|
опущена |
в |
раствор, |
|
содержащий |
|||||||
одновременно: |
|
|
|
|
и |
|
; |
|
|
|
|
|
|
е)серебряная пластина, , |
опущена в раствор, содержащий |
||||||||||||
одновременно: |
|
|
|
|
|
и |
|
|
|
? |
|
||
6. |
Сколько граммов, (серебра) , |
выделится( ) |
на( катоде) , если через |
||||||||||
раствор |
пропускать ток в 9 А в течении 30 мин? |
|
|
||||||||||
7. |
Через раствор |
при никелевом аноде пропустили ток 8 |
|||||||||||
А. Определить потерю в весе анода за 1 час. |
|
|
|
|
|
|
|||||||
8. |
Сколько кулонов электричества прошло через раствор |
, |
|||||||||||
если на катоде выделилось 5,62 г кадмия? |
|
|
|
|
|
|
|||||||
9. |
Какое количество серной кислоты образуется в растворе, если |
||||||||||||
через раствор |
|
пройдет ток в 2 А в течении 20 мин? |
|
||||||||||
10.Вычислить эквивалент железа, зная, что при пропускании через водный раствор его соли электрического тока в 5 А в течении 40 мин выделяется 2,315 г металла.
11.Какое количество цинка должно растворяться каждую минуту в гальваническом элементе для получения тока в 2 А?
12.Определить направление нижеприведенных реакций, имея в виду, что концентрации окислительной и восстановительной форм равны:
а) |
+ |
|
+2 |
; |
|
|
|
29 |
|
в) |
|
+ |
+ |
|
+2 |
; |
|
|
|
б) |
2 |
+ |
+2 |
|
|
+2 |
; |
|
+ |
г) |
; |
|
|
||||||
|
+5 ( |
) + |
+8 2 |
|
|||||
д) |
10 |
+8 |
+2 |
|
2 ( ) +2 |
. |
|
||
|
2 ( )9. |
+ |
|
|
|
||||
|
|
|
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ |
|
|||||
|
Комплексными |
соединениями |
называются |
|
определенные |
||||
молекулярные соединения, при сочетании компонентов которых образуются положительно и отрицательно заряженные сложные ионы, способные к существованию как в кристалле, так и в растворе.
иТак, 3– |
и |
образуют комплексное соединение |
[ |
. ] |
, |
|||
, |
и |
|
дают соединение |
|
||||
Центральный[ ] |
атом |
или |
ион в комплексном соединении |
|||||
|
6 |
[ ( |
) ] |
|
|
|||
называется комплексообразователем. Этим атомом или ионом может быть металл или неметалл.
Частицы непосредственно связанные с комплексообразователем называются аддендами. Число аддендов называется координационным числом данного комплексообразователя. Координационное число, также как и валентность элемента, может быть как постоянной, так и переменной величиной для данного атома или иона.
Комплексы, в состав которых входят одинаковые адденды получили название однородных комплексов. Комплексные соединения, содержащие во внутренней сфере два или более различных адденда, называются неоднородными.
[ |
( ) ] – |
однородное комплексное соединение; |
|
– неоднородное комплексное соединение. |
|||
[Заряд( |
комплексообразователя) ] |
численно равен и противоположен |
|
по знаку алгебраической сумме зарядов всех остальных входящих в
формулу ионов. Так, для |
[этом( |
эта сумма равна: + 4 + (– 6) = – |
|
2. Следовательно, железо в |
соединении) ] |
является положительно |
|
двухвалентным.
30
