
Учебники 80324
.pdf2.Определить плотность хлора по воздуху, считая, что средняя молекулярная масса воздуха 29.
3.Не считая примесей и потерь в производстве, вычислить, сколько поваренной соли требуется для получения 1 т хлора.
4.Баллон содержит 7,1 кг сжиженного хлора. Какой объем займет этот хлор при нормальных условиях?
5.Один объём воды растворяет 2,5 объема хлора. Какой будет процентная концентрация раствора, если условия, в которых находится хлор при растворении, были нормальными?
6.Смесь хлора с водородом при ярком освещении взрывается. В каком объемном отношении должны быть взяты эти газы, чтобы они полностью прореагировали? Составить уравнение реакции.
7.Была взорвана смесь, содержащая 1,5 объема хлора на 1 объем водорода. Какие газы и в каком объемном отношении образовались после взрыва?
8.Одним из веществ, используемых для отбелки тканей, служит гипохлорит натрия NaClO. Его получают при пропускании хлора через водный раствор гидроокиси натрия NaOH. Хлор и гидроокись натрия могут быть получены пропусканием электрического тока через водный раствор поваренной соли. Составить схему реакции, используемую для получения гипохлорита натрия из хлорида натрия
иводы. Сколько расходуется NaCl на получение 1 т 2% раствора
NaClO?
9.Какой газ имеет большую плотность − хлористый водород или воздух?
10.В лаборатории получили хлористый водород из поваренной соли при слабом нагревании с концентрированной серной кислотой. Для поглощения хлористого водорода был взят 1 л воды. Концентрация полученной соляной кислоты оказалась равной 25%. Какая была масса HCl? Сколько поваренной соли и серной кислоты израсходовано на получение соляной кислоты, если реакция шла до образования NaHSO4?
61
11. При современном способе получения соляной кислоты хлористый водород получают соединением хлора и водорода. Необходимые для этого хлор и водород получают пропусканием постоянного электрического тока через водный раствор поваренной соли. Процесс происходит по уравнению:
2 NaCl + 2 H2O = Cl2 + H2 + 2NaOH.
Сколько расходуется поваренной соли и воды для получения 1 т 35% соляной кислоты и сколько гидроксида натрия при этом образуется?
12.Имеются цинк, медь и магний, окислы этих металлов, их карбонаты и соляная кислота. Как получить из этих веществ соли: хлорид цинка ZnCl2, хлорид меди CuCl2, хлорид магния MgCl2? Составить уравнения реакций.
13.Сколько литров, при нормальных условиях, хлористого водорода содержится в 1 кг 10% раствора соляной кислоты?
14.Имеется несколько бесцветных растворов. Как установить, в каком из них содержится соль соляной кислоты?
15.Чего больше в солях, состав которых выражается следующими формулами: NaCl, KCl, MgCl2, CuCl2, PbCl2, флора или металла? В каком из них содержится наибольшее количество хлора?
16.В 1 л воды растворили 0,8 г хлорида калия, 27 г хлорида натрия и 3,2 г хлорида магния. Сколько хлора содержит 1 м³ этого раствора?
17.При анализе образца поваренной соли оказалось, что в ее состав входит 97% NaCl, 0,18% MgCl2, 0,19% CaCl2, 2,63% других, не содержащих хлор, примесей. Вычислить, не считая потери в производстве, сколько 35% соляной кислоты может быть получено из
1т этой соли.
18.Сколько может быть получено водорода из 1 кг 15% раствора соляной кислоты при взаимодействии с цинком и сколько потребуется цинка, содержащего 5% примесей?
19.К 1 мл соляной кислоты прибавили раствор нитрата серебра AgNO3 в избытке. Масса выпавшего осадка равнялась 0,287 г.
62
Вычислить, сколько HCl содержалось в 1 л этой кислоты, сколько это составляет молей.
20.Составить формулы оксидов хлора, в которых хлор одновалентен, четырехвалентен и семивалентен.
21.Написать формулу кислоты, ангидрид который имеет формулу Cl2O.
22.Составить формулу хлорноватистокислых солей гипохлоритов натрия, калия и кальция. Почему эти соли называются белильными? Составить уравнение реакции, протекающей при пропускании хлора через гидроокись кальция.
23.Вычислить плотность фтора по воздуху.
24.Сколько процентов фтора содержится во фтористом
кальции?
25.При взаимодействии фтористого кальция с серной кислотой получается фтористый водород. Можно ли эту реакцию проводить в стеклянной или фарфоровой посуде? Почему? Написать уравнения реакций.
26.Вычислить плотность фтористого водорода по воздуху и по водороду.
27.При некоторой температуре плотность фтористого водорода по водороду равна 13. Считая, что фтористый водород при этой температуре представляет собой смесь молекул HF и H2F2, вычислить, сколько процентов тех и других молекул содержится в смеси.
28.Фтор поступает в организм человека с продуктами питания и водой. В некоторых районах содержание фтористых солей в питьевой воде в пересчете на NaF составила 2 мг на литр. Считая, что человек в среднем потреблял в сутки 2 л воды, вычислить, сколько фтора вводилось ежедневно в организме человека.
29.Сколько атомов и молекул содержится в 1 мг брома?
30.Какое явление наблюдается при пропускании хлора через водный раствор бромида натрия?
63
31.5,5 г смеси, состоящей из 95% бромида натрия и 5% хлорида натрия, растворенного в воде. Через раствор пропущен 1 л (нормальные условия) хлора. Какое вещество взято в избытке? Что и
вкаком количестве оказалось в растворе после выделения из него всего полученного брома?
32.Среднее содержание бромидов в морской воде, в пересчете на бромид натрия, составляет 0,01%. Принимаю плотность воды равной 1 г/см3, вычислить, сколько брома может быть получена из 1 м3 морской воды и сколько молей это составляет.
33.Бром может быть получен из бромида натрия в результате реакции с двуокисью марганца и с серной кислоты по схеме реакции:
NaBr + MnO2 + H2SO4→ Br2 + Na2SO4 + MnSO4 + H2O.
Расставить коэффициенты и вычислить, сколько расходуется двуокиси марганца на получение 500 г брома.
34.Какой из газов – хлористый водород или бромистый водород имеет большую плотность и во сколько раз?
35.Одинаковое ли количество молекул: а) в 1 мг HCl и в 1 мг HBr; б) в 1 мл HCl и 1 мл HBr? Где она больше и во сколько раз?
36.Есть предположение, что в образце поваренной соли имеется примесь бромидов. Как в этом убедиться?
37.К двум растворам, содержащим: один − хлорид натрия, другой − бромид натрия, прибавили раствор нитрата серебра. Что произошло? Можно ли по результатам опыта установить, что содержалось в каждом из растворов? Составить уравнения реакций.
38.Через водный раствор йодида калия KI пропущен хлор. Какие явления наблюдались?
39.Содержание в морской воде солей йодистоводородной кислоты (йодидов) составляет в пересчете на KI 6,5 мг на литр воды. Вычислить, из какого объема морской воды может быть получен 1 кг йода.
40.В образце чилийской селитры содержится 0,2% йодата натрия NaIO3. Сколько йода можно извлечь из 1 т этой селитры?
64
41.Какой объем хлора (условия нормальные) требуется, чтобы вытеснить йод из 1 кг 2% раствора йодида калия?
42.Имеется желтоватый водный раствор и неизвестно, является он раствором брома или йода. Как это установить?
43.Какой объём (условия нормальные) занимает 1 г йодистого водорода?
44.Вычислить массу 1 л (условия нормальные) йодистого водорода.
45.Какими способами можно обнаружить присутствие йодидов
врастворе?
46.По каким признакам можно установить, какой из галогенов содержится в растворе, если к нему добавить раствор йодида калия?
47.Имеется соль галогеноводородной кислоты. Как установить, какая это соль?
48.Имеется два галогенида. Один из них бромид, другой – йодид. Указать два способа, с помощью которых можно отличить бромиды от йодидов.
49.В образце поваренной соли содержится примесь бромида натрия. Как освободиться от этой примеси?
50.К некоторому раствору прибавили хлорную воду. Раствор пожелтел, а после прибавления крахмала посинел. Что содержалось в растворе?
51.Смесь хлорида бария и бромида натрия, в которой масса бромида натрия равнялась 2,06 г, растворено в воде. Через раствор пропустили хлор в избытке, после чего раствор выпарили и прокалили. Что оказалась в остатке? Как и насколько отличалась масса полученного осадка от массы исходной смеси?
52.К раствору, содержащему 0,68 г хлорида цинка, добавили раствор, содержащий 1,5 г нитрата серебра. Какие вещества, и в каких количествах будут в растворе по окончанию реакции?
53.Из 1 кг йодида калия, содержащего 5% примесей, получено 700 г йода. Вычислить процент выхода йода.
65
19. УГЛЕВОДЫ
Углеводы − органические соединения, состав которых обычно выражается общей формулой Сn(Н2О)m (n и m ≥ 4). Углеводы − распространенные химические соединения. Они входят в состав животных и растительных веществ. Так, в организмах человека и животных содержание углеводов достигает 20%. Углеводы необходимы для протекания физиологических процессов в организме.
Они обычно подразделяются на моносахариды, а так же конденсированные ассоциации молекул моносахаридов − олигосахариды и полисахариды. Примеры моносахаридов могут служить: рибоза, глюкоза, фруктоза.
Задачи для самостоятельного решения
1.При спиртовом брожении глюкозы массой 270 г выделился газ − оксид углерода (IV). Необходимо определить объем выделившегося газа (условия нормальные).
2.В результате брожения глюкозы выделилось 276 г этанола. Учитывая, что выход продукта брожения составил 80%, определить массу глюкозы вступивший в процесс брожения.
3.В воздухе объемная доля кислорода составила 21%. Рассчитать объем воздуха необходимого для окисления 45 г исходной глюкозы (условия нормальные).
4.Для получения глюкозы был взят картофель массой 1620 кг.
Вкартофеле содержалось 20% крахмала. Необходимо рассчитать количество образовавшейся глюкозы при условии 75% выхода продукта реакции.
5.Произвели гидролиз древесины массой 810 г до образования глюкозы. В древесине содержалось 50% целлюлозы. Определить количество спирта, полученного при гидролизе. Учесть, что после реакции в растворе содержится 8% воды, причём выход продукта (этанола) составил 70%.
6.Для получения спирта в количестве 115 кг была использована кукуруза. Образующийся спирт имел массовую долю 96%. При
66
данном процессе выход спирта 80%, а крахмала в зернах кукуруза −
70%.
7.В процессе фотосинтеза лист растения, имеющий площадь 1 дм², поглощает CO2 объемом 44,8 м² (условия нормальные). Определить количество глюкозы, образующейся в процессе фотосинтеза.
8.При получении тринитроцеллюлоза, масса которого 990 кг, использовали целлюлозу и азотную кислоту. Плотность азотной кислоты равнялась 1,15 г/мл, массовая доля HNO3 составила 80%. Определить количество целлюлозы и азотной кислоты, пошедших на эту реакцию.
9.После сбраживания глюкозы получен этанол. Образовавшийся спирт окислили до кислоты. Образовавшемуся раствору кислоты прилили избыток KHCO3, в результате чего выделился газ объемом 8,96 л (условия нормальные). Какое количество глюкозы было подвергнуто брожение.
10.Газ, полученный в результате спиртового брожения глюкозы, пропустили через раствор NaOH в количестве 60,2 мл, имеющего плотность 1,33 г/мл. В растворе содержалось 30% гидроксида натрия. Определить количество раствора, в котором было 60% этанола, полученного в результате реакции.
11.К глюкозе, полученной из 8,1 г крахмала (выход продукта 70%), добавили аммиачный раствор окиси серебра. Определить количество образовавшегося в результате реакции серебра.
12.Молочная кислота 81 г, была получена из глюкозы в результате брожения. Необходимо рассчитать количество крахмала, вступившего в реакцию гидролиза с образованием глюкозы. Причём
выход реакции гидролиза крахмала 80%, глюкозы 60%.
13. Взято 1,62 т отходов древесины. Рассчитать количество триацетата полученного при этом. Выход образующегося эфира составил 75%. Количество целлюлозы в древесных отходах 50%.
14. Глюкоза, полученная в результате гидролиза крахмала весом 324 г, подвергнута спиртовому брожению. Причём выход гюкозы
67
составил 80%. Результат брожения составляет 75%. Было получено 600 г спирта. Сколько этанола содержится в образовавшемся растворе?
15.Порцию гюкозы, дающую при сгорании 3 моль углекислого газа, подвергли брожению. Образовавшийся в результате этого этанол с выходом 80% подвергли межмолекулярной дегидратации, при этом получили 11,84 г простого эфира. Вычислить, с каким выходом (%) прошла реакция спиртового брожения.
16.При маслянокислом брожении глюкозы образовалось 8,96 л смеси газообразных веществ (условия нормальные). Какая масса глюкозы была взята для проведения брожения, если известно, что выход реакции брожения составил 55%?
17.Порцию глюкозы разделили на две части: одну из них подвергли маслянокислому брожению, вторую молочнокислому. Массы кислот оказались равными. Известно, что одна из реакций прошла с выходом 75%. Вычислить выход второй реакции.
18.Написать уравнение реакции взаимодействия глюкозы с гидроокисью кальция.
19.Каким методом можно восстановить глюкозу в шестиатомный спирт? Написать уравнение реакции.
20.Выразить уравнением процесс спиртового брожения глюкозы и вычислить, сколько глюкозы расходуется на получение 1 кг спирта.
21.Написать уравнение гидролиза свекловичного сахара и вычислить, сколько глюкозы и фруктозы может быть получено из 1 кг сахара.
22.Написать итоговое уравнение полного гидролиза крахмала и вычислить, сколько глюкозы может быть получено из 1 т картофеля, содержащего 20% крахмала, при выходе 70%.
23.Сколько этилового спирта может быть получено из 1 т пшеницы, содержащей 70% крахмала, если потери в производстве составляют 15%?
68
24.Какое количество древесных отходов, содержащих 50% клетчатки, расходуется на получение 1 т гидролизного спирта (потери в производстве составляют 30%)? Какое количество картофеля, содержащего 20% крахмала, это сэкономит, если при использовании картофеля потери в производстве будут 15%?
25.Какое количество клетчатки и азотной кислоты расходуется на получение 1 т тринитроклетчатки, если потери в производстве составляют 12%?
26.Этерификация клетчатки в ацетилцеллюлозу практически производится не уксусной кислотой, а уксусным ангидридом. Имея это в виду, составить уравнение реакций взаимодействия клетчатки с уксусным ангидридом с образованием диацетилцеллюлозы.
20. ЖИРЫ
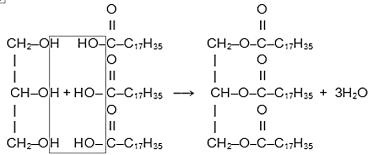
Жиры – сплошные эфиры, которые образуются высшими карбоновыми кислотами (в основном стеариновой кислотой C17H35COOH, которая является насыщенной кислотой, пальмитиновой кислотой C15H31COOH и олеиновой кислотой C17H33COOH) и трехатомным спиртом – глицерином. Общее название этих соединений – триглицериды. Образование соединений такого типа можно представить на основе взаимодействия глицерина с стеариновой кислотой по уравнению:
Глицерин Стеариновая кислота Стеариновый триглицерид
Таким образом, реакция идет с отщеплением трех молекул воды от реагирующих веществ (как показано на схеме) и образованием сложного эфира – стеаринового триглицерида.
69
Если же в реакцию с глицерином вступают непредельные кислоты, то получаются жидкие жиры – масла.
Жиры содержатся во всех растениях и животных организмах.
Задачи для самостоятельного решения
1.Приведите уравнение реакции гидролиза жира, протекающего
впищеварительном тракте (в общем виде).
2.Написать пример реакции переработки жидкого жира в твердый.
3.Если жир, имеющий плотность 0,85 г/мл (условия нормальные), растворяет углекислый газ в пропорции 1:1, то каково содержание углекислого газа в образовавшемся растворе в %?
4.Гидролизу подвергается 34,6 г триглицерина, состоящего из глицерина и олеиновой, стеариновой и масляной кислоты. Определить количество карбоната натрия, пошедшего на данную реакцию.
5.В состав растительного жира входит триолеилглицерин, а также 10% примесей, которые не подвергаются гидролизу. Исходное количество жира составляло 150 г. Кислотный гидролиз данного жира произошёл с выходом продукта реакции 75%. Какова масса полученных веществ?
6.Образец жира массой 41,6 г подвергли кислотному гидролизу. Исходное вещество состояло из глицерина, 2 остатков пальметиновой кислоты, а так же остатком олеиновой кислоты. В результате гидролиза получили 3,68 г глицерина. Каков процентный (%) выход данной реакции?
7.Жир состоит из глицерина, двух остатков линолевой кислоты и остатка пальмитиновой кислоты. Масса данного жира равна 299 г. Данный образец подвергли кислотному гидролизу, в результате чего было образовано 245 г смеси кислот. Чему будет равен процентный выход гидролиза?
8.Образец жира подвергли щелочному гидролизу. В результате
реакции образовалось: стеорат калия 48,3 г, олеанта калия 96,0 г. Сколько глицерина получилось в результате этой реакции?
70
