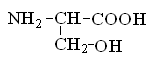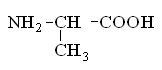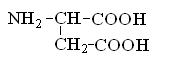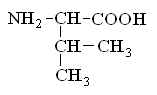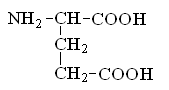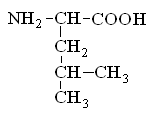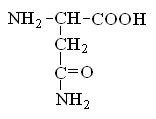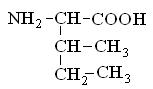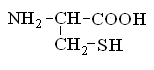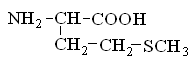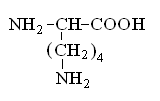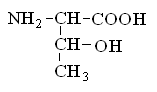- •Биохимия и биотехнологии
- •Введение
- •Техника безопасности и правила работы в биохимической лаборатории
- •Практическая работа №1 углеводы
- •В присутствии щелочи
- •Состав жиров и масел
- •Опыт №3. Определение йодного числа
- •Пример расчета йодного числа
- •Контрольные вопросы
- •Практическая работа №3 Аминокислоты и белки
- •Протеиногенные α-аминокислоты
- •Качественные реакции на белки
- •Контрольные вопросы
- •Практическая работа №4 физико-химические свойства ферментов
- •Контрольные вопросы
- •Практическая работа №5 витамины
- •Контрольные вопросы
- •Библиографический список
- •1. Комов, в.П., Биохимия: учебник для студентов вузов / в.П. Комов, в.Н. Шведова – м.: Дрофа, 2008. – 639 с.
- •2. Кнорре, д.Г. Биологическая химия: учебник для студентов вузов / д.Г. Кнорре, с.Д. Мызина. – м.: Высшая школа, 1992. – 416 с.
- •Оглавление
- •Биохимия и биотехнологии
- •394006 Воронеж, ул. 20-летия Октября, 84
Практическая работа №3 Аминокислоты и белки
Белки представляют собой высокомолекулярные полимерные органические соединения, структурными единицами которых являются α-аминокислоты.
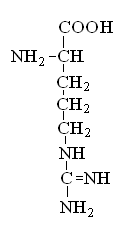
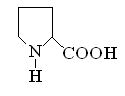
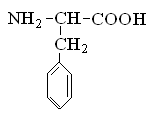
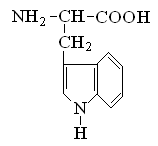
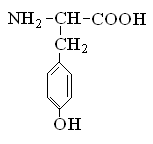
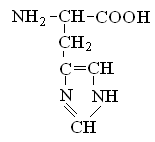
Гетерофункциональные соединения, молекулы которых содержат одновременно амино- и карбоксильную группы называются аминокислотами. Общее число, встречающихся в природе аминокислот, достигает 100. При этом в организме человека найдено около 70 аминокислот, из которых 20 входят в состав белка. Они относятся к α-аминокислотам и называются протеиногенными (табл. 3).
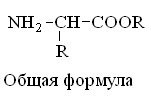
Таблица 3
Протеиногенные α-аминокислоты
Название |
Формула |
Название |
Формула |
|
|
глицин |
|
серин |
|
|
|
аланин |
|
аспаргиновая кислота |
|
|
|
валин |
|
глутаминовая кислота |
|
|
|
лейцин
|
|
аспаргин |
|
|
|
Окончание табл. 3 |
|||||
Название |
Формула |
Название |
Формула |
|
|
Изолейцин |
|
глутамин |
|
|
|
цистеин |
|
аргинин |
|
|
|
метионин |
|
лизин
|
|
|
|
треонин |
|
пролин |
|
|
|
фенилаланин |
|
триптофан |
|
|
|
тирозин |
|
гистидин |
|
|
|
Аминокислоты в молекуле белка соединены между собой пептидными связями (–СО–NH–), образуя полипептидные цепи. Пептидная связь возникает между карбоксильной группой одной аминокислоты и аминогруппой другой, что сопровождается выделением молекулы воды. В белках различают несколько уровней структурной организации.
Первичная структура белка определяется числом и последовательностью аминокислотных остатков, соединенных между собой при помощи пептидной связи. Вторичная структура возникает за счет образования водородных связей между группами N–H и О=С данной полипептидной цепи, что приводит к упорядоченному расположению гибкой полипетидной цепи в виде спиральной или складчатой структуры. Третичная структура возникает в результате взаимодействия между боковыми цепями аминокислотных остатков полипептидных цепей.
К таким взаимодействиям относятся водородные, дисульфидные и ионные связи, ван-дер-ваальсовы и гидрофобные силы. В результате таких взаимодействий полипептидная цепь свертывается очень сложным, но вместе с тем определенным образом, приобретая характерную пространственную конфигурацию.
Межмолекулярные взаимодействия между отдельными полипептидными
цепями, обладающими вторичной и третичной структурой, могут приводить к образованию агрегатов, то есть к возникновению четвертичной структуры белка. Структура белковой молекулы очень лабильна и легко разрушается под влиянием различных физических и химических воздействий, в результате чего изменяются ее биологические и физико-химические свойства.
Литература: [2, гл. II, § 2.1-2.6]; [3, гл. VI, § 15-20].
Цель работы – определить химическую природу белков; доказать, что в состав белков ходят α-аминокислоты.
Опыт №1. Действие азотной кислоты на аминокислоты
В пробирку помещают 2 капли раствора аминокислоты (например, глицин), 2 капли раствора нитрита натрия NaNO2 и 2 капли соляной кислоты НСl. При встряхивании содержимого пробирки выделяются пузырьки газа.
Химизм реакции:
NaNO2 + НСl → НNO2 + NaСl
NН2 – СН2 – СООН + НNO2 → НO – СН2 – СООН + N2 + Н2O
глицин гликолевая кислота
На этой реакции основано количественное определение аминогрупп в аминокислотах, а также в белках и продуктах их распада.
Опыт №2. Отношение белков к кислотам и щелочам
К 2-3 мл раствора белка добавьте по каплям при встряхивании концентрированную уксусную кислоту СН3СООН, при этом наблюдается выпадение белка в осадок в виде мути и хлопьев. При дальнейшем добавлении кислоты осадок белка снова растворяется.
Полученный кислый раствор разделите на две части. Одну часть нагрейте до кипения и добавьте к ней 1-2 капли раствора сульфата аммония (NH4)2SO4. Белок свертывается.
К другой части кислого раствора белка осторожно добавьте по каплям при постоянном встряхивании разбавленный раствор щелочи. При постепенной нейтрализации кислоты образуется осадок белка, снова растворяющийся в избытке щелочи.
Происходящие процессы можно объяснить следующим образом. Белки являются амфотерными электролитами, их основные свойства обусловлены наличием аминогруппы, а кислотные свойства − присутствием карбоксильных групп.
R– NН2 + Н2O ↔ RNН3+ + OН–
RСООН ↔RСОО– + Н+
При подкислении раствора белка степень кислотной диссоциации белка снижается, а степень основной диссоциации повышается, при этом частицы белка заряжаются положительно. Наоборот, при избытке щелочи усиливается диссоциация кислотной группы, а основной снижается. При некотором значении рН раствора эти два процесса уравновешиваются, и частицы белка не несут на себе заряд. Это так называемая изоэлектрическая точка, при которой коллоидные частицы белка наименее устойчивы и легко коагулируют, т.е. свертываются (рис. 6).
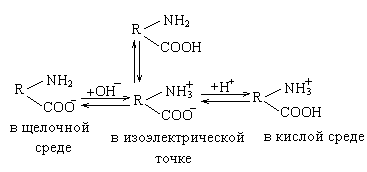
Рис. 6. Схема амфотерных свойств белка
Буферные свойства раствора белка, связанные с его амфотерностью, особенно наглядно обнаруживаются в следующих опытах:
а) к 3 мл дисстилированной воды добавьте 1 каплю соляной кислоты НСl. При добавлении к этому раствору несколько капель индикатора конго наблюдается появление ярко-синего окрашивания. Этот синий раствор медленно прилейте к раствору белка и отметьте изменение окраски. В данном случае белок ведет себя как основание;
б) к 3 мл дисстилированной воды добавьте каплю раствора щелочи. Полученный раствор при добавлении к нему капли раствора фенолфталеина окрашивается в розовый цвет. Прилейте щелочной раствор к раствору белка, отметьте изменение окраски и в этом случае, где белок ведет себя уже как кислота.
Опыт №3. Биуретовая реакция белков
К 1-2 мл раствора белка добавьте равный объем концентрированного раствора щелочи и затем каплю (не больше) раствора сульфата меди СuSO4. Жидкость окрашивается в ярко-фиолетовый цвет.
Биуретовая реакции обнаруживает в молекуле белка пептидные группы –СО – NН – . Продукты распада белка – полипептиды также дают биуретовую реакцию, причем цвет образующихся медных комплексов определяется числом аминокислот, связанных пептидной связью. Дипептиды дают синюю окраску, трипептиды – фиолетовую, а тетрапептиды и более сложные пептиды – красную.
Опыт №4. Ксантопротеиновая реакция белков
К 1 мл раствора белка добавьте 1-2 капли концентрированной азотной кислоты. Появляется белый осадок или раствор мутнеет. Затем нагрейте смесь на горелке до кипения и кипятите ее 1-2 мин. При этом раствор и осадок окрашиваются в ярко-желтый цвет.
Охладив смесь, осторожно по каплям добавьте к кислой жидкости избыток (1-2 мл) раствора щелочи. Выпадает осадок, образующий с избытком щелочи ярко-оранжевый раствор.
Ксантопротеиновая реакция обнаруживает наличие в белке ароматических ядер. Желтое окрашивание появляется в результате нитрования этих ядер азотной кислотой и образования полинитросоединений. Переход в щелочной среде желтой окраски в оранжевую обусловлен образованием более интенсивно окрашенных анионов.
По результатам проведенных реакций заполните табл. 4.
Таблица 4