
Исследование термодинамических параметров газов. методические указания к выполнению лабораторных работ по дисциплине «Техническая термодинамика». Китаев Д.Н., Мартыненко Г.Н
.pdfМИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«Воронежский государственный технический университет»
Кафедра теплогазоснабжения и нефтегазового дела
ИССЛЕДОВАНИЕ ТЕРМОДИНАМИЧЕСКИХ ПАРАМЕТРОВ ГАЗОВ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к выполнению лабораторных работ по дисциплине «Техническая термодинамика» для студентов направлений подготовки 08.03.01 «Строительство»,
13.03.01«Теплоэнергетика и теплотехника»,
21.03.01«Нефтегазовое дело»
всех форм обучения
Воронеж 2021
УДК 621.1(07)
ББК 31.3я7
Составители: Д. Н. Китаев, Г. Н. Мартыненко
Исследование термодинамических параметров газов: методические указания к выполнению лабораторных работ по дисциплине «Техническая термодинамика» для студентов направлений подготовки 08.03.01 «Строительство», 13.03.01 «Теплоэнергетика и теплотехника», 21.03.01 «Нефтегазовое дело» всех форм обучения / ФГБОУ ВО «Воронежский государственный технический университет»; сост.: Д. Н. Китаев, Г. Н. Мартыненко. – Воронеж: Изд-во ВГТУ, 2021. – 37 с.
В методических указаниях представлены лабораторные работы по дисциплине «Техническая термодинамика», а также их назначение, краткие теоретические сведения, методика проведения, порядок оформления результатов опытов и анализ точности полученных результатов.
Предназначены для студентов бакалавриата направлений 08.03.01 «Строительство», 13.03.01 «Теплоэнергетика и теплотехника», 21.03.01 «Нефтегазовое дело» всех форм обучения.
Ил. 8. Табл. 6. Библиогр.: 5 назв.
УДК 621.1(07) ББК 31.3я7
Рецензент – Т. В. Щукина, канд. техн. наук, доцент кафедры жилищно-коммунального хозяйства ВГТУ
Печатается по решению редакционно-издательского совета Воронежского государственного технического университета

ВВЕДЕНИЕ
Методические указания к лабораторным работам составлены в соответствии с программами курсов «Техническая термодинамика» бакалавриата направлений 08.03.01 «Строительство», 13.03.01 «Теплоэнергетика и теплотехника», 21.03.01 «Нефтегазовое дело».
Целью лабораторных работ являются углубленное усвоение материала по соответствующим разделам упомянутых курсов, а также приобретение навыков
впроведении экспериментальных исследований, получении и обобщении данных.
Вкаждой работе указано ее назначение, приведены краткие теоретические сведения, методика проведения, порядок оформления результатов опытов, анализ точности полученных результатов.
Перед каждой лабораторной работой студент должен изучить соответствующие теоретические части курса, понять цель работы, сущность происходящих процессов, порядок проведения исследования, ожидаемые результаты. Студент должен ознакомиться с измерительными средствами, используемыми в данной работе, четко представлять особенности их работы, точность измерения
идругие характеристики. Преподаватель, ведущий лабораторные занятия, прежде чем допустить студента к выполнению работы, проверяет его подготовку и знание им правил техники безопасности при проведении работы. Лабораторная работа выполняется студентом самостоятельно или группами по 3-4 человека (по указанию преподавателя). Результаты замеров, полученные при проведении работы, до их обработки должны быть проанализированы с целью выявления грубых ошибок измерений и после этого при необходимости усреднены.
ОПРЕДЕЛЕНИЕ ОШИБОК ИЗМЕРЕНИЙ
Выявление грубых ошибок измерений (при числе измерений значений величины n ≤ 25) производится в следующем порядке.
Вычисляется среднее значение измеряемой величины Nср по формуле
∑n Ni
Nср = |
i=1 |
, |
|
n |
|||
|
|
где Ni – значение измеренной величины; n – число измерений. Вычисляется среднеквадратическая ошибка σ
∑n (Ni − Nср )2
σ = |
i=1 |
|
. |
|
n −1 |
||
|
|
|
Определяется величина максимального относительного отклонения δmax
3
δmax = (Ni − Nср ),
σ
где Ni – крайнее (наибольшее или наименьшее) значение измеренной величины. Полученное по уравнению (3) значение δmax сравнивают с табличным δтаб
(см. табл. 1). Если выполняется условие δmax ≤ δтаб , то значение измеренной ве-
личины не считается грубой ошибкой, в противном случае «подозрительное» значение Ni отбрасывается и в дальнейших расчетах не используется.
Таблица 1
Значения величины δтаб
n |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
δтаб |
1,41 |
1,72 |
1,96 |
2,13 |
2,27 |
2,37 |
2,46 |
2,54 |
2,61 |
2,66 |
2,71 |
2,76 |
2,8 |
Все полученные экспериментальные данные должны иметь размерность, соответствующую международной системе единиц (СИ). Соотношения между часто встречающимися единицами измерения приведены в прил. 1.
Результаты наблюдений и соответствующие расчеты студент должен показать преподавателю, проводящему лабораторную работу, и только после этого приступить к оформлению отчета. Оформление отчета по лабораторным работам производится в тонкой тетради или на отдельных листах, которые после выполнения всех работ подшиваются.
Отчет по работе, выполняемый каждым студентом индивидуально, должен включать в себя следующие разделы:
–задание;
–схему экспериментальной установки с обозначениями;
–опытные данные (журнал наблюдений);
–обработку опытных данных (расчеты);
–анализ результатов по работе (выводы).
Журнал наблюдений должен быть подписан преподавателем. Оформленный отчет по выполненной лабораторной работе предъявляется преподавателю не позднее следующего лабораторного занятия. Без отчета о выполненной работе студент не допускается к последующей работе.
По правильно оформленному индивидуальному отчету студенту предлагается ответить на несколько вопросов, при положительном ответе на которые отчет по работе считается принятым, а лабораторная работа – зачтенной. Перечень некоторых вопросов к лабораторным работам приведен в конце каждой работы.
4
ЛАБОРАТОРНАЯ РАБОТА № 1 ОПРЕДЕЛЕНИЕ ГАЗОВОЙ ПОСТОЯННОЙ ВОЗДУХА
1.1. Задание
а) экспериментально определить удельную газовую постоянную воздуха; б) вычислить универсальную газовую постоянную; в) оформить отчет по работе.
1.2. Краткие теоретические сведения
Основными термодинамическими параметрами газа, определяющими его состояние, являются абсолютное давление Р, абсолютная температура Т и удельный объем υ. Эти параметры находятся между собой в зависимости, ана-
литически выражаемой уравнением состояния F (P,υ,T )=0 .
Для 1 кг идеального газа уравнение состояния примет вид |
|
Pυ = RT , |
(1.1) |
где R – удельная газовая постоянная, Дж/(кг·К).
Удельная газовая постоянная представляет собой работу, совершаемую в изобарном процессе одним килограммом газа, при его нагреве на 1 градус. Данная величина зависит только от природы газа.
Уравнение состояния идеального газа (1.1) носит название уравнения Клапейрона. Уравнение (1.1) может быть записано для киломоля вещества, тогда оно называется уравнением Менделеева – Клапейрона и примет вид
|
PVµ = RµT , |
(1.2) |
где V |
– объем киломоля газа, м3/кмоль, соответствующий давлению Р и тем- |
|
µ |
|
|
пературе Т; Rµ – универсальная газовая постоянная, Дж/(кмоль·К).
При нормальных условиях (Р=760 мм рт.ст.=0,101325 МПа, Т=273,15К) объем одного киломоля любого идеального газа Vµ = 22,4 м3/кмоль, а значение
Rµ = 8314 Дж/(кмоль·К).
Величины R и Rµ являются важнейшими термодинамическими констан-
тами, используемыми в теплотехнических расчетах, и они связаны между собой соотношением
R = |
Rµ |
, |
(1.3) |
|
µ |
||||
|
|
|
где μ – молекулярная масса газа, кг/кмоль.
Для чистых газов молекулярная масса соответствует массе молекулы, выраженной в килограммах, то есть непосредственно определяется из таблицы
5
Д.И. Менделеева. Для смесей идеальных газов вводится понятие кажущейся молекулярной массы μсм, под которой понимается молекулярная масса воображаемого газа, заменяющего действительную смесь и состоящего из одинаковых, средних по массе молекул. Кажущаяся молекулярная масса определяется по выражению
µсм = ∑n |
µiri , |
(1.4) |
i=1 |
|
|
где µ i – молекулярная масса компонента смеси, кг/кмоль;ri – объемная доля
компонента; n – число компонентов смеси.
Для воздуха кажущаяся молекулярная масса равна 28,96 кг/кмоль.
1.3.Описание экспериментальной установки
иметодика выполнения лабораторной работы
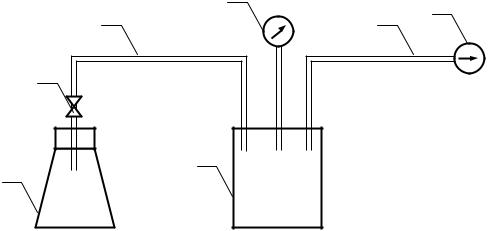
Экспериментальная установка (рисунок) состоит из промежуточного сосуда 1, на котором установлен вакуумметр 2, колбы 3 с вентилем 4 (объем колбы Vк = 980 см3), вакуумного насоса 5 и соединительных трубок 6 и 7. Для взвешивания колбы используются аналитические весы, а для измерения параметров окружающего воздуха требуется барометр и термометр.
6 |
2 |
7 |
5 |
|
|||
|
|
4
1
3
Схема установки для определения газовой постоянной воздуха: 1 – промежуточный сосуд; 2 – вакуумметр; 3 – колба; 4 – вентиль; 5 – вакуумный насос; 6,7 – соединительные трубки
Численное значение газовой постоянной воздуха может быть определено из уравнения (1.1). Для этого необходимо измерить атмосферное давление Р и комнатную температуру t, а также определить удельный объем воздуха υ.
Определение удельного объема производится исходя из следующих соображений. Предположим, что воздух, заключенный в какой-либо сосуд (в лабо-
6
раторной работе – колба), в исходном состоянии имеет параметры P1,υ1,T1 . Искомая величина υ1 может быть определена исходя из понятия удельного объема (объем единицы массы)
υ = V |
, |
(1.5) |
m |
|
|
где V – объем воздуха, м3; m – масса воздуха, кг.
Поскольку прямым взвешиванием массу воздуха измерить невозможно, для ее нахождения используем закон Бойля-Мариотта, связывающий параметры газа в изотермическом процессе. Расширим воздух в колбе, выполнив откачку с помощью вакуумного насоса, а так как этот процесс достаточно медленный, будем полагать, что температура при этом остается неизменной. В конечном состоянии (после откачки) воздух в колбе будет иметь параметры P2 ,υ2 ,T1 , а в силу изотермичности процесса можно записать
P1υ1 = P2υ2 . |
(1.6) |
Так как объем колбы до и после откачки один и тот же (уменьшилась лишь масса воздуха в колбе), то с учетом понятия удельного объема очевидно, что между давлением и массой существует прямо пропорциональная зависи-
мость вида |
P1 |
= |
P2 |
. Отсюда следует, что начальная (искомая) масса воздуха |
||||||||
m |
m |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
1 |
|
2 |
|
|
|
|
|
|
|
|
m может быть определена из соотношения m = P m2 |
. Или, меняя отношение |
|||||||||||
1 |
|
|
|
|
|
|
|
|
1 |
1 P |
|
|
m2 |
|
|
|
|
|
∆m , получим |
2 |
|
||||
на отношение приращений |
|
|
||||||||||
P |
|
|
|
|
|
∆P |
|
|
|
|
||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m = P |
∆m |
= P |
М1 −М2 . |
(1.7) |
|||
|
|
|
|
|
1 |
1 |
∆P |
1 |
P − P |
|
||
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
В последнем выражении вместо разности масс воздуха в начальном и конечном состоянии фигурируют массы воздуха с колбой (М1,М2). Очевидно, что такая замена не вносит погрешности, поскольку при расчетах отклонений масса самой колбы исключается. По найденному значению массы воздуха в колбе до откачки определяется удельный объем
υ1 =Vк / m1 . |
(1.8) |
7
Последовательность проведения опыта
1.Взвешивается колба с краном 4 и трубкой 6 (кран 5 открыт). Результат
взвешивания М1 заносится в журнал наблюдений. По барометру измеряется атмосферное давление Р1 и температура воздуха Т1.
2.Колба 3 через трубку 6 соединяется со штуцером на промежуточном сосуде 1 (кран 4 открыт). С помощью вакуумного насоса 5 вращением маховика
по часовой стрелке из колбы откачивается воздух до давления р2= - 0,4 кгс/см2 (по вакуумметру).
3. Закрывается кран 4, отсоединяется трубка 6 от штуцера на промежуточном сосуде1. Выполняется повторное взвешивание колбы после откачкиМ2.
4. Открывается кран 4, и последовательность операций 2 – 3 повторяется еще два раза, при этом разряжение в колбе создается равным - 0,5 кгс/см2 и - 0,6 кгс/см2 соответственно.
Журнал наблюдений
|
Экспериментальные данные |
|
|
Расчетные данные |
|
|
||||||||||||
№ опыта |
Р1 |
|
р2 |
Т1 |
М1 |
М2 |
Р2 |
М |
Р |
m1 |
υ1 |
υí |
R |
Rμ |
Rср |
Rμср. |
||
ммрт.ст. |
Па |
кгс/см |
|
Па |
К |
кг |
кг |
Па |
кг |
Па |
кг |
м3/кг |
м |
/(Джкг·К) |
кмоль/(Дж ·К) |
/(Джкг·К) |
кмоль/(Дж ·К) |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
кг / |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Техника безопасности. При создании вакуума в колбе 3 необходимо медленно вращать маховик вакуумного насоса во избежание резкого падения давления внутри колбы и ее разрушения. При наличии вакуума в колбе оберегать ее от толчков и ударов, так как ее разрушение сопровождается «хлопком» и может привести к порезам осколками стекла.
1.4.Обработка результатов эксперимента
1.Перевести экспериментальные данные (Р1, р2, Т1) в систему единиц СИ.
2.Избыточное давление р2 преобразовать в абсолютное, добавив к нему барометрическое Р1.
3.Определить изменения М, Р.
4.Вычислить по формуле (1.7) массу воздуха в колбе до откачки m1.
5.Определить удельный объем воздуха в колбе до откачки по формуле (1.8).
8

6. Привести удельный объем воздуха в условиях лабораторной работы к нормальным условиям по формуле
υ=υ Р1 273,15 .
н1 Т1 101325
7.Из уравнения (1.1) определить удельную газовую постоянную воздухаR.
8.Вычислить значение универсальной газовой постоянной Rµ , используя
выражение (1.3) (значение кажущейся молекулярной массы воздуха принять равным μ = 28,96 кг/кмоль).
9.По результатам трех опытов установить среднее значение газовых постоянных R и Rµ . Сравнить полученные результаты со справочными данными.
10.Выполнить статистическую обработку экспериментальных данных по формулам (1) и (2)(данный расчет выполняется по требованию преподавателя).
11.Оформить отчет по работе.
1.5.Контрольные вопросы
1.В чем физический смысл универсальной и удельной газовых постоянных?
2.Что такое киломоль (моль) воздуха?
3.Почему величина Rµ получила название универсальной газовой посто-
янной?
4.Дать определение идеального газа.
5.Почему при определении массы воздуха в колбе приходится прибегать
кзакону Бойля-Мариотта вместо прямого взвешивания?
6.Дать определения основных положений о смесях идеальных газов: парциальных давлений, объемов и взаимосвязи между ними (законы Дальтона и Амага).
7.Назвать способы задания газовых смесей. Знать взаимосвязь между объемными, массовыми и мольными долями смеси газов.
8.Знать единицы измерения основных термодинамических параметров.
ЛАБОРАТОРНАЯ РАБОТА № 2 ОПРЕДЕЛЕНИЕ СРЕДНЕЙ ОБЪЕМНОЙ ИЗОБАРНОЙ
ТЕПЛОЕМКОСТИ ВОЗДУХА
2.1. Задание
а) экспериментально определить среднюю объемную изобарную теплоемкость воздуха в интервале температур от 30 до 50 °С;
б) рассчитать средние изобарные теплоемкости воздуха (массовую и мольную), а также соответствующие теплоемкости в изохорном процессе в том же интервале температур;
9
в) оформить отчет по работе.
2.2. Краткие теоретические сведения
Теплоемкость является одним из важнейших теплофизических параметров вещества и определяется количеством тепловой энергии, которую необходимо сообщить системе для повышения ее температуры на 1 градус, то есть
c = |
Q |
. |
(2.1) |
|
|||
|
∆t |
|
|
Различают теплоемкость среднюю cm (в интервале температур от t1 до t2)
c |
|
t2 |
= |
|
q |
, |
|
|
|||||
|
|
|
|
|||
m |
|
t |
|
t2 |
−t1 |
|
|
1 |
|
||||
|
|
|
|
|
||
и истинную с (при стремлении температурного интервала к 0)
c = lim |
q |
= dq . |
|
∆t |
|||
∆t→0 |
dt |
(2.2)
(2.3)
Вобщем случае теплоемкость зависит от свойств самого вещества, характера термодинамического процесса, при котором происходит подвод или отвод тепла, температуры и давления, и от того, к какому количеству вещества она относиться. Теплоемкость идеальных газов зависит от температуры.
Взависимости от принятой единицы количества вещества различают теплоемкости: массовую с, кДж/(кг·К); объемную с′, кДж/(м3К); мольную μс, кДж/(моль·К). Перечисленные теплоемкости связаны между собой следующим соотношением
|
µc |
(2.4) |
|
c = |
µ =с′ υ, |
||
|
где μ – масса одного киломоля вещества, кг/кмоль; υ - удельный объем, м3/кг.
Особое значение имеют теплоемкости изохорного cυ |
и изобарного - ср |
процессов, которые связаны между собой уравнением Майера |
|
cp =cυ + R , |
(2.5) |
где R – удельная газовая постоянная, кДж/(кг·К).
Отношение изобарной и изохорной теплоемкостей определяет показатель
адиабаты k |
|
|
|
|
cp |
= k . |
(2.6) |
|
c |
||
|
|
|
|
|
υ |
|
|
10
