
Охрана воздушного бассейна. метод. указания к выполнению лабораторных работ. Сотникова О.А., Шершнев В.Н
.pdfФедеральное агентство по образованию Государственное образовательное учреждение высшего профессионального
образования Воронежский государственный архитектурно-строительный университет
Кафедра теплогазоснабжения
ОХРАНА ВОЗДУШНОГО БАССЕЙНА
Методические указания к выполнению лабораторных работ
для студентов заочного факультета, обучающихся по специальности 270109 «Теплогазоснабжение и вентиляция»
Воронеж 2009
Составитель О.А.Сотникова
УДК 697.942 (083.75)
Охрана воздушного бассейна : метод. указания к выполнению лабораторных работ / Воронеж. гос. арх.-строит. ун-т.; сост.: О.А.Сотникова.
– Воронеж, 2009. – 26 с.
Лабораторные работы выполняются при изучении дисциплины «Охрана воздушного бассейна» студентами заочного факультета, обучающимися по специальности 270109 «Теплогазоснабжение и вентиляция».
Назначение работы – систематизация, практическое закрепление и расширение теоретических знаний по курсу «Охрана воздушного бассейна» и овладение навыками самостоятельных экспериментальных исследований.
Ил.9. Табл. 8. Библиогр.: 2 назв.
Печатается по решению редакционно-издательского совета Воронежского государственного архитектурно-строительного университета
Рецензент - В.Н.Шершнев, профессор кафедры отопления и вентиляции ВГАСУ
2
ВВЕДЕНИЕ
Лабораторные работы выполняются при изучении дисциплины «Охрана воздушного бассейна» студентами заочного факультета, обучающимися по специальности «Теплогазоснабжение и вентиляция».
Назначение лабораторных работ – систематизация, практическое закрепление и расширение теоретических знаний по курсу «Охрана воздушного бассейна» и овладение навыками самостоятельных экспериментальных исследований.
Методические указания предназначены в качестве руководства при проведении экспериментов, проводимых в лабораторных (лабораторная работа № 3) и производственных условиях (лабораторные работы №№ 1,2,4,5).
Отчет по каждой лабораторной работе должен содержать: 1.Таблицу(ы) с результатами измерений и наблюдений.
2.Основные расчетные зависимости, использованные при обработке опытных данных, и проделанные расчеты.
3.Краткий анализ сущности изученных процессов и объяснение полученных результатов.
4.Графики и диаграммы (в соответствии с заданием по каждой лабораторной работе).
5.Оценку погрешности определяемых в процессе опытов величин.
Лабораторная работа № 1
Изучение метода кондуктометрии
Цель работы: изучение основных приемов работы на компенсационном кондуктометре.
Задание:
1.Построить калибровочный график определения концентрации.
2.Определить содержание солей в контрольном растворе.
1.1. Краткие теоретические сведения
Метод кондуктометрии относится к физико-химическим методам анализа состава газообразных или жидких сред, в частности к электрохимическому методу. Он основан на измерении электропроводности раствора и его зависимости от концентрации содержащихся в растворе веществ. Как любой проводник, вода, содержащая примеси, обладает электрическим сопротивлением R. Характеристикой электрической проводимости раствора является электропроводность W, эти величины связаны между собой следующими уравнениями:
R = r |
L |
; |
(1.1) |
|
S |
||||
|
|
|
3
W = |
1 |
= |
1 |
× |
S |
= x |
S |
, |
(1.2) |
|
R |
r |
L |
L |
|||||||
|
|
|
|
|
|
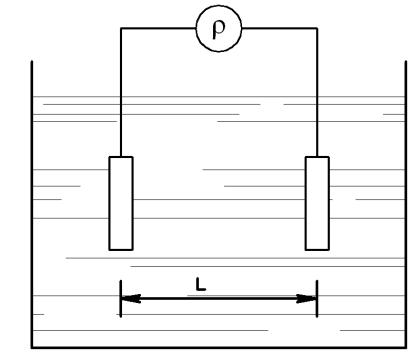
где r - удельное электрическое сопротивление раствора; L - расстояние между электродами (рис. 1.1); S - площадь сечения промежутка воды; x - удельная электропроводность
Рис.1.1. Принципиальная схема кондуктометра
Удельным электрическим сопротивлением называется сопротивление столба исследуемого раствора площадью сечения S = 1 см2 и длиной L= 1 см. Удельное сопротивление зависит от природы растворенных в ней веществ, их концентрации и температуры. Удельная электропроводность является величиной, обратной удельному электрическому сопротивлению r .
Достаточно точно для практических целей зависимость электропроводности раствора от его состава и температуры может быть описана таким образом:
x = x0 (1 + at + bt 2 ) , |
(1.3) |
где x0 - электропроводность дважды перегнанной дистиллированной воды; a и b - коэффициенты, зависящие от природы растворенных веществ и их концентрации.
Метод, основанный на измерении электропроводности раствора с целью получения значения концентрации растворенной в растворе примеси, на-
зывается кондуктометрией.
4
1.2. Методика проведения опыта и обработки результатов измерений
1.2.1. Состав экспериментального оборудования
Кондуктометр ММЗЧ-04 с контактным датчиком типа УК-02/1. Посуда: цилиндры для калибровочной кривой V = 6 мл – 6 шт.; колба
для рабочего раствора V = 250 мл – 1 шт.; пипетки 5 и 10 мл – по 1 шт.; лабораторный термометр для раствора.
1.2.2. Приготовление растворов
1.2.2.1. Приготовление рабочего раствора электролита
Концентрация рабочего раствора электролита – 10 г/л NaCl. Для приготовления такого раствора используют навеску массой 2,5 г, которую растворяют в колбе 250 мл дважды перегнанной дистиллированной водой.
1.2.2.2. Приготовление шкалы концентрации раствора
В шесть мерных цилиндров объемом V = 100 мл каждый вносят 1; 2; 5; 10; 20; 30 мл рабочего раствора и доводят объем до 100 мл дистиллированной водой.
Концентрации полученных растворов будут соответственно равны: 100; 200; 500; 1000; 2000; 3000 мг/л.
1.2.3. Порядок проведения работы
1.2.3.1. Построение калибровочной кривой для определения концентрации растворимых минеральных солей и других токсичных примесей и изучение влияния температуры исследуемого раствора на его электропроводность.
Образцы растворов последовательно помещаются в измерительный стакан кондуктометра. Измерительный стакан промывается вместе с датчиком прибора дистиллированной водой после каждой смены исследуемого раствора. Удельное электрическое сопротивление измеряют для каждого раствора шкалы концентраций, начиная с наименьшей концентрации при температуре около 15 °С .
Результаты измерений записывают в табл. 1.1.
Для большей точности определения рекомендуется измерения выполнять на разных пределах чувствительности прибора.
Затем проводят аналогичные измерения удельного электрического сопротивления растворов шкалы для температур исследуемых растворов при-
близительно: 20, 25, 30, 35 °С .
Точные значения температур заносят в табл. 1.1.
5
Используя данные табл. 1.1 и |
уравнение x = |
1 |
, построить калибровоч- |
|||||||||
r |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||
ный график x = f (C)t =const |
и x = f (t)C =const . |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Таблица 1.1 |
||
С, мг/л |
С1 |
С2 |
С3 |
|
С4 |
С5 |
|
|
С6 |
С7 |
С8 |
|
t, °С |
Удельное электрическое сопротивление r , Ом м |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
t1 = |
|
|
|
|
|
|
|
|
|
|
|
|
t2 = |
|
|
|
|
|
|
|
|
|
|
|
|
…. |
|
|
|
|
|
|
|
|
|
|
|
|
tn = |
|
|
|
|
|
|
|
|
|
|
|
|
1.2.3.2. Определение содержания примесей в контрольном растворе
В контрольном образце раствора необходимо вначале определить температуру термометра, а затем измерить удельное электрическое сопротивление кондуктометра. Используя эти два измеренных значения и ориентируясь на полученные выше зависимости x = f (C)t =const и x = f (t)C =const , находим концентрацию примесей в контрольном образце раствора.
Лабораторная работа № 2
Изучение метода фотометрии
Цель работы: изучение основных приемов работы на фотоэлектроколориметре.
Задание:
1.Построить график зависимости оптической плотности от длины волны и определить оптимальную длину волны, соответствующую максимальному значению оптической плотности.
2.Построить калибровочные графики для двух значений ширины кюветы фотоэлектроколориметра.
2.1.Краткие теоретические сведения
Методы анализа жидких и газообразных сред, основанные на светопоглощении, называются фотометрическими.
По закону Бугера-Ламберта-Бера интенсивность светового потока, выходящего из слоя, определяется по формуле
I t = I 0 × e -eCb , |
(2.1) |
6
где It - интенсивность светового потока, выходящего из слоя; I0 - интенсивность светового потока, падающего на слой; e - коэффициент, не зависящий от концентрации; C - концентрация вещества; b - толщина слоя.
Коэффициент поглощения k = e ×C пропорционален концентрации поглощающего вещества, например раствора или газа.
Логарифм отношения интенсивности I0/It называется оптической плотностью D и определяется по формуле
D= eСb . |
(2.2) |
Прибор, используемый для осуществления фотометрического метода в видимой части спектра, называется фотоэлектроколориметром (КФК).
Принцип действия прибора заключается в регистрации величины тока фотоэлемента, на который падает пучок монохроматического света, прошедшего через слой исследуемой жидкости или газа. КФК позволяет определять величину оптической плотности исследуемых сред.
2.2. Методика проведения работы и обработки результатов эксперимента
2.2.1. Состав экспериментального оборудования
Фотоэлектроколориметр; посуда: цилиндры для калибровочной кривой V = 100 мл – 8 шт., цилиндр – 1 шт. для разведения объемом 100 мл, цилиндр объемом V = 25 мл – 1 шт., пипетки 5 и 10 мл – по одной шт.
2.2.2.Приготовление растворов
2.2.2.1.Приготовление рабочего и разбавленного растворов красителя
Концентрация рабочего раствора красителя – 1000 мл/л.
Объем рабочего раствора красителя – 1000 мл. Для приготовления разбавленного раствора используют разведенный рабочий раствор в отношении 1:10. Для этого в цилиндр на 1000 мг вносят 10 мл рабочего раствора и доводят объем до 100 мг дистиллированной водой. Концентрация разбавленного раствора красителя Cк будет равна 100 мл/л.
2.2.2.2. Приготовление шкалы концентраций раствора красителя
Для приготовления шкалы концентраций используется разбавленный раствор красителя. В 8 мерных цилиндров вводят 0,5; 1; 2,5; 5; 10; 15; 20; 25 мл разбавленного красителя и доводят объем до 100 мл дистиллированной водой, это соответствует концентрациям (Ск) 1; 2; 5; 10; 20; 30; 40; 50.
7
2.2.3. Порядок проведения работы
2.2.3.1. Подбор длины волны светового пучка
Раствор красителя, имеющий концентрацию, близкую к исследуемому раствору, помещается в измерительную кювету КФК.
Проводят измерения оптической плотности раствора для всех длин волн. В качестве раствора сравнения используют дистиллированную воду.
Результаты измерений заносят в табл. 2.1.
Таблица 2.1 Зависимость оптической плотности D от длины волны l
l, нм
D
2.2.3.2. Построение калибровочных графиков
Используя данные табл. 2.1, строим график зависимости D = f ( l ). Определяем оптимальную длину волны l , которая будет соответство-
вать максимальному значению Dmax.
Измеряем оптическую плотность D каждого раствора шкалы при найденном по графику значении l и ширине кюветы L=10 мм. В качестве рас-
твора сравнения используют дистиллированную воду. Результаты измерений записывают в табл. 2.2.
Таблица 2.2 Зависимость оптической плотности D от концентрации красителя Ск
при ширине кюветы 10 мм
Ск, мг/л
D
Далее измерения повторяются для ширины кюветы L=20 мм,
табл. 2.3.
Таблица 2.3 Зависимость оптической плотности D от концентрации красителя Cк
при ширине кюветы L=20 мм
Ск, мг/л
D
8
Используя данные табл. 2.2 и 2.3, построить калибровочные графики в координатах D = f (Ск) для двух значений ширины кюветы. Объяснить полученные результаты.
Лабораторная работа № 3
Изучение процесса тепломассообмена в насадочном абсорбере
Цель работы: провести балансовые испытания насадочного абсорбера при различных плотностях орошения насадки.
Задание:
1.Составить уравнение теплового баланса абсорбера с использованием измеренных в опытах параметров.
2.На основе уравнения теплового баланса рассчитать приход и расход
теплоты для каждого режима с указанием небаланса D Q / Q в процентах.
3.Построить кривую изменения состояния воздуха при тепло- и массообмене с водой в абсорбере (в H – d-координатах).
4.Оценить погрешность определения расхода воздуха и промежуточ-
ного значения энтальпии Hпр при построении кривой тепломассообмена.
3.1.Краткие теоретические сведения
Насадочные абсорберы (их еще называют насадочными колоннами) относятся к диффузионным аппаратам, в которых соприкосновение газов с жидкостью происходит на смоченной поверхности насадки. Насадка характеризуется поверхностью в единице объема (удельная площадь поверхности) S, м2/м3, свободным объемом (порозностью) e ,м3/м3, линейными размерами одного элемента насадки (обычно – эквивалентным диаметром). Насадкой в опытном абсорбере служат нерегулярно уложенные кольца Рашига.
Выбирая скорость газа в свободном сечении абсорбера, следует учитывать, что с ее увеличением повышается коэффициент тепломассоотдачи, но в то же время возрастает унос частиц жидкости из абсорбера вместе с газом и увеличиваются затраты энергии на транспортирование газа, то есть гидравлическое сопротивление абсорбера растет.
Впроцессе охлаждения или нагрева воздуха в абсорбере одновременно
сконвективным переносом теплоты происходит конденсация пара из воздуха
или испарение воды в воздух, то есть с изменением температуры воздуха t1 изменяется и его влагосодержание d1. Поэтому при составлении уравнения теплового баланса абсорбера целесообразно использовать энтальпию воздуха Н1:
H1 = h1 + 0,001d1hп , |
(3.1) |
9
где h1, hп – соответственно энтальпия сухого воздуха и водяного пара при температуре t1.
В технических расчетах формулу (3.1) обычно заменяют приближенной зависимостью
|
|
H 1= t1 + 0,001d1 (2493 +1,97t1 ) . |
(3.2) |
|||
|
С учетом изложенного уравнение теплового баланса абсорбера имеет |
|||||
вид |
L(H1¢ - H1²) = G2 c2 (t2 |
² - t2 |
¢) , |
|
|
|
|
|
(3.3) |
||||
где L и H1¢ , |
H1² - соответственно расход, начальная и конечная энтальпия |
|||||
воздуха; G , с – соответственно расход и удельная теплоемкость воды; |
t |
¢ и |
||||
|
2 |
2 |
|
|
|
2 |
t2 |
²- ее начальная и конечная температуры. |
|
|
|
||
|
Построение кривой изменения состояния воздуха при его взаимодейст- |
|||||
вии с водой по опытным данным проводится графоаналитическим способом на основе уравнения теплового баланса.
На Н-d-диаграмму (рис. 3.1) наносится точка А, соответствующая начальным параметрам воздуха t1 и Н1 (t1 соответствует показаниям термопары 9; Н1 – энтальпия воздуха на входе, соответствующая показаниям мокрой термопары 8). На линии j = 100% отмечаются положения точек С и D, соот-
ветствующие изотермам t2¢ и t2², равным начальной и конечной температурам воды. Поскольку на лабораторном стенде осуществлен противоток, начало процесса смешения воздуха с водой на Н-d-диаграмме изображается прямой AD, соединяющей точку А, характеризующую состояние воздуха на входе в абсорбер, с точкой D на линии j = 100%, которая соответствует тем-
пературе воды на выходе из абсорбера t2 |
². |
|
|
Далее на этой прямой рассчитывают значение промежуточной энталь- |
|||
a |
|
|
|
пии H пр по уравнению теплового баланса |
|
|
|
LH1 + Gcp tпрa = H прa + Gcp t2 |
², |
(3.4) |
|
подставив в него измеренные в опыте промежуточные значения температуры воды t a пр, которые определяют по показаниям термопар 2-7. В уравнении (3.4) L – расход воздуха, кг/с; H1 - энтальпия воздуха на входе в абсорбер, Дж/кг; G - расход воды, кг/с; cр – удельная теплоемкость воды при заданной
температуре, Дж/(кг×°С ); t2² – температура воды на выходе из абсорбера, °С ; H a пр - энтальпия влажного воздуха в сечении, где установлена термопара 2; t a пр – температура, замеряемая термопарой 2.
10
