
- •Связь линейных и угловых характеристик движения:
- •2) Инерциальные системы отсчета. Понятия силы и инертной массы. Законы динамики. Силы в природе. Фундаментальные взаимодействия. Свойства сил упругости и тяготения. Свойства сил трения.
- •3) Центр инерции. Закон сохранения импульса системы материальных точек.
- •4) Работа переменной силы. Кинетическая энергия и ее связь с работой внешних и внутренних сил.
- •6) Закон сохранения механической энергии. Диссипация энергии.
- •Работа при вращении твердого тела ( )
- •8)Колебания математического и физического маятников.
- •9) Преобразования Галилея. Механический принцип относительности. Нарушение классического закона сложения скоростей. Опыты по определению скорости света. Опыт Майкельсона.
- •11) Статистический и термодинамический методы исследования. Термодинамические параметры. Идеальный газ. Термодинамическая система. Равновесные и неравновесные состояния и процессы.
- •12. Среднеквадратичная скорость молекул. Молекулярно-кинетическое толкование абсолютной температуры.
- •13. Основное уравнение молекулярно-кинетической теории (вывод). Число степеней свободы молекулы. Закон распределения энергии по степеням свободы. Внутренняя энергия идеального газа.
- •14. Работа газа при расширении. Количество теплоты. Первое начало термодинамики.
- •15. Классическая молекулярно-кинетическая теория теплоемкости. Удельная и молярная теплоемкости. Формула Майера. Границы применимости теории.
- •Формула Майера ( )
- •16. Изопроцессы идеального газа. Зависимость теплоемкости от вида процесса. Адиабатический процесс.
- •17. Тепловые двигатели и холодильные машины. Кпд. Обратимые и необратимые процессы. Круговой процесс. Цикл Карно для идеального газа и его кпд.
- •19. Закон Максвелла для распределения молекул идеального газа по скоростям теплового движения. Вероятностное толкование закона распределения Максвелла.
- •20. Барометрическая формула. Закон Больцмана для распределения частиц идеального газа во внешнем потенциальном поле.
- •Одной молекулы газа
- •Потенцирование:
- •21. Среднее число столкновений и средняя длина свободного пробега молекул идеального газа. Эффективный диаметр молекулы.
- •22. Явления переноса. Теплопроводность, диффузия, вязкость.
- •23. Реальные газы. Силы и потенциальная энергия межмолекулярного взаимодействия. Уравнение Ван-дер-Ваальса. Изотермы реального газа. Критическое состояние. (Внутренняя энергия реального газа.)
- •Уравнение Ван-дер-Ваальса – уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
23. Реальные газы. Силы и потенциальная энергия межмолекулярного взаимодействия. Уравнение Ван-дер-Ваальса. Изотермы реального газа. Критическое состояние. (Внутренняя энергия реального газа.)
Реальный газ не описывается в
точности уравнением Клапейрона —
Менделеева. С позиции молекулярной
теории строения вещества реальный газ
– это газ, свойства которого зависят
от взаимодействия и размеров молекул.
Состояние реального газа часто на
практике описывается обобщённым
уравнением Клапейрона — Менделеева:
 ,
где
,
где
 – коэффициент сжимаемости газа.
– коэффициент сжимаемости газа.
Внутренняя энергия газа [
]
– сумма кинетических энергий хаотического
(теплового) движения всех молекул газа
и энергий взаимодействия между молекулами
газа. При рассмотрении реальных газов
надо учитывать силы межмолекулярного
взаимодействия, которые проявляются
при
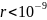 м.
На расстоянии
м.
На расстоянии
 силы притяжения и отталкивания равны.
силы притяжения и отталкивания равны.
 соответствует равновесному расстоянию
между молекулами на которых бы они
находились в отсутствии теплового
движения. При
соответствует равновесному расстоянию
между молекулами на которых бы они
находились в отсутствии теплового
движения. При
 преобладают силы отталкивания, при
преобладают силы отталкивания, при
 преобладают силы притяжения. В состоянии
устойчивого равновесия (
)
система из двух взаимодействующих
молекул обладает минимальной потенциальной
энергией (
преобладают силы притяжения. В состоянии
устойчивого равновесия (
)
система из двух взаимодействующих
молекул обладает минимальной потенциальной
энергией ( ).
Критерии различных агрегатных состояний
вещества:
).
Критерии различных агрегатных состояний
вещества:
 – газообразное,
– газообразное,
 – жидкое,
– жидкое,
 – твёрдое.
– твёрдое.
Уравнение Ван-дер-Ваальса – уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
С начала рассмотрим идеальный газ,
который удовлетворяет уравнению
 .
Предположим, что частицы данного газа
являются упругими сферами одинакового
радиуса
.
Предположим, что частицы данного газа
являются упругими сферами одинакового
радиуса
 .
Из объёма следует вычесть некую его
часть
.
Из объёма следует вычесть некую его
часть
 ,
которая зависит только от вещества, из
которого состоит газ. Таким образом,
получается следующее уравнение:
,
которая зависит только от вещества, из
которого состоит газ. Таким образом,
получается следующее уравнение:
 .
Далее Ван-дер-Ваальс рассматривает силы
притяжения между частицами газа и делает
следующие допущения:
.
Далее Ван-дер-Ваальс рассматривает силы
притяжения между частицами газа и делает
следующие допущения:
Частицы распределены равномерно по всему объёму.
Силы притяжения стенок сосуда не учитываются, что в общем случае неверно.
Внутри сосуда действующие силы притяжения других частиц компенсируют друг друга.
Частицы, находящиеся непосредственно
у края сосуда, притягиваются внутрь
силой, пропорциональной концентрации:
 .
Число частиц, находящихся непосредственно
у стенок, тоже предполагается
пропорциональным концентрации
.
Число частиц, находящихся непосредственно
у стенок, тоже предполагается
пропорциональным концентрации
 .
Можно считать, что давление на стенки
сосуда меньше на некоторую величину,
обратно пропорциональную квадрату
объёма:
.
Можно считать, что давление на стенки
сосуда меньше на некоторую величину,
обратно пропорциональную квадрату
объёма:

Изотерма реального газа – зависимость молярного объема газа от давления при постоянной температуре.
Критическая точка фазового равновесия – точка на диаграмме состояния веществ, соответствующая критическому состоянию, то есть конечная точка кривой сосуществования фаз, в котором две (или более) фазы, находящиеся в термодинамическом равновесии, становятся тождественными по своим свойствам. В частности, с приближением к критическому состоянию различия в плотности, составе и других свойствах сосуществующих фаз, а также теплота фазового перехода и межфазное поверхностное натяжение уменьшаются, а в критической точке равны нулю
https://ru.wikipedia.org/wiki/Реальный_газ
Потенциальная энергия межмолекулярных
сил взаимодействия вычисляется как
работа, которую совершают эти силы при
разведении молекул на бесконечность:
 .
Внутренняя энергия газа Ван-дер-Ваальса
равна
.
Внутренняя энергия газа Ван-дер-Ваальса
равна
 ,
где
,
где
 – молярная теплоёмкость при постоянном
объёме.
– молярная теплоёмкость при постоянном
объёме.
