
- •2. Что такое пирогенность воды и лекарственных средств, отчего она может возникнуть?
- •3.Почему наличие пирогенности инъекционных растворов недопустимо?
- •4. Каким способом определяют пирогенность воды и лекарственных средств?
- •5. Исследование лекарственных средств, не стерилизуемых в процессе производства: какие показатели определяются?
- •6. Методика определения общего количества бактерий, общего количества грибов.
- •7. Наличие, каких микробов не допускается в лекарственных средствах? Методика их выявления и идентификации.
Занятие 10 Санитарно-микробиологический контроль в фармацевтических учреждениях. Микробиологический контроль лекарственного сырья и готовых лекарственных средств (окончание).
1. Исследование лекарственных средств, стерилизуемых в процессе производства. Как производится посев на стерильность: в каких количествах, на какие питательные среды, условия и время инкубации, оценка результатов?
Лекарственные средства для инъекций, глазные капли, мази, плёнки, другие лекарственные средства, в отношении которых имеются соответствующие указания в нормативно-технической документации (НТД), должны быть стерильными.
Отбор образцов для анализа. Число образцов из каждой серии от 3 до 40, в зависимости от метода стерилизации, для автоклавированных средств - 10. Для исследования лекарственные средства должны быть приготовлены в виде растворов, суспензий или эмульсий.
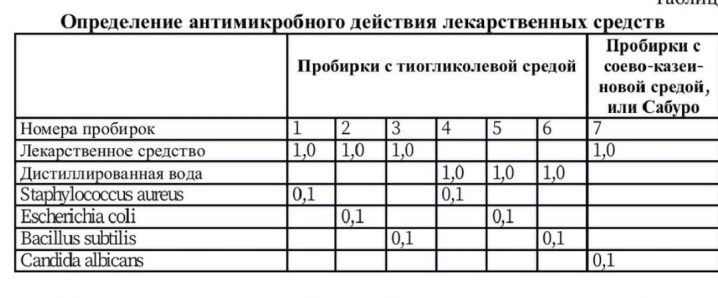
Определение антимикробного действия лекарственного средства. Во избежание неправильной оценки результатов анализа необходимо определить однократно для каждого наименования лекарственного средства обладает ли оно антимикробным действием. Для определения антимикробного действия из ампулы с лекарственным средством следует внести по 1 мл в 3 пробирки с 10 мл тиогликолевой среды и в 1 пробирку с 10 мл жидкой соево-казеиновой среды или среды Сабуро. Для контроля в 3 пробирки с тиогликолевой средой и в пробирку с 10 мл жидкой соево-казеиновой среды или среды Сабуро вносится по 1 мл стерильной дистиллированной воды (табл.). Затем во все пробирки следует внести по 0,1 мл взвеси тест-штамма, содержащего 1000 клеток в 1 мл. В пробирки с тиогликолевой средой вносятся штаммы Staphylococcus aureus; Bacillus subtilis; Escherichia coli; в пробирки с соево-казеиновой средой или средой Сабуро - Candida albicans. Посевы в тиогликолевой среде инкубируют при 30-35ºС в течение 2 суток, а на соевоказеиновой среде, или среде Сабуро, - при 20-25ºС в течение 3 суток. При отсутствии антимикробного действия лекарственного средства в опытных и контрольных пробирках должен наблюдаться рост перечисленных тест-микробов. В этом случае можно продолжать исследование и провести прямой посев данного лекарственного средства на стерильность.
При наличии антимикробного действия устраняют его. Для этого используют:
1. Соответствующие инактиваторы, указанные в частных фармакопейных статьях (например, пара-аминобензойная кислота для сульфаниламидов, пенициллиназа - для пенициллинов и цефалоспоринов).
2. При отсутствии соответствующего инактиватора препарат при посеве разводят, увеличивая объём питательной среды до 250 мл.
3. Если при этом
сохраняется антимикробное действие
лекарственного средства, для посева
используют метод мембранной фильтрации.
Посев лекарственных средств на стерильность (метод прямого посева). Испытуемый препарат, если необходимо, растворяют в соответствующем растворителе и высевают в количествах, указанных в таблице. Количество испытуемого препарата для посева в зависимости от объёма содержимого одной единицы (ампул, флаконов), составляющих серию. Посевы с тиогликолевой средой инкубируют при температуре от 30 до 35ºС, а в соево-казеиновой среде, или среде Сабуро, - от 20 до 25ºС. Продолжительность инкубации посевов в обеих питательных средах составляет 14 суток. Если во всех посевах роста нет, лекарственный препарат стерилен.
Метод мембранной
фильтрации. При определении стерильности
лекарственных средств, обладающих
антимикробным действием, и лекарственных
средств, разлитых в ёмкости больше 100
мл, используют метод мембранной
фильтрации. Лекарственное средство
фильтруют в асептических условиях через
2 стерильных мембранных фильтра, затем
смывают 3-4 порциями по 100 мл физ. раствора.
Каждую мембрану стерильными ножницами
разрезают пополам, половину помещают
в тиогликолевую среду, половину - в
жидкую соево-казеиновую среду, или среду
Сабуро. Посевы выдерживают в термостате
при тех же температурах в течение 7 суток
при ежедневном просмотре. Для контроля
полноты смывания другую мембрану
разрезают пополам и по половине мембраны
помещают в питательные среды, куда
засевают тест-микробы: Staphylococcus aureus и
Candida albicans. Наличие роста этих микробов
после инкубации в термостате указывает
на полноту смывания. Для контроля
стерильности условий фильтрования
производят фильтрование растворителя,
и фильтры засевают в те же питательные
среды.

2. Что такое пирогенность воды и лекарственных средств, отчего она может возникнуть?
Пирогенность - это способность химического агента или другого вещества вызывать лихорадочную ответную реакцию. Реакции могут быть опосредованы материалом, эндотоксином или другими веществами, такими как составляющие грамположительных бактерий и грибов. ИЛИ Способность вещества вызывать повышение температуры тела. Пирогены (греч. pyr – огонь, жар + genes – порождающий) бактериального происхождения – это эндотоксины грамотрицательных бактерий. В больших дозах эндотоксины вызывают интоксикацию. При внутривенном и внутримышечном введении малых доз отмечается повышение температуры тела, стимуляция фагоцитоза, активация комплемента по альтернативному пути, увеличение проницаемости капилляров.
Причины:
1.Загрязненная дистл вода ( неправильная эксплутация дистиллятора или несвежая дистлир вода)
2.микроорганизмы, попавшие в лекарственные иньекционные растворы в результате небрежного отношения к асептике технологического процесса и аптечных помещений.
3. Микроорганизмы, успевшие размножиться в лекарств. Препарате, если время между окончанием его приготовления и началом стерилизации было достаточно большим ( более 1,5 ч)
3.Почему наличие пирогенности инъекционных растворов недопустимо?
Стерильные инъекционные растворы могут вызывать повышение температуры тела (пирогенный эффект), что связано с наличием в них убитых бактерий или продуктов их распада. Поэтому дистиллированная вода для приготовления инъекционных растворов не должна содержать в 1 мл более 10-15 бактерий, а лекарственные препараты для парентерального введения должны подвергаться контролю не только на стерильность, но и на пирогенность - способность некоторых веществ при парентеральном введении вызывать повышение температуры тела, озноб, обильное потовыделение, головную болью, тошноту, учащением пульса.
4. Каким способом определяют пирогенность воды и лекарственных средств?
Испытание на пирогенность проводится путём введения кроликам (3) в краевую вену уха воды или лекарственного средства с измерением ректальной 45 температуры 3 раза с интервалом 1 час. При этом строго соблюдаются условия, исключающие возможность повышения температуры тела кроликов от случайных причин. Воду или раствор лекарственного вещества считают непирогенным, если после введения ни у одного из 3 подопытных кроликов ни при одном из трёх измерений не наблюдалось повышение температуры более чем на 0,6°С по сравнению с исходной температурой и в сумме повышение температуры у 3 кроликов не превышало 1,4°С. Если у одного или 2 кроликов температура повысилась более чем на 0,6°С и в сумме у 3 кроликов повышение температуры составляет более 1,4°С, испытание повторяют дополнительно на 5 кроликах; воду или раствор считают непирогенными, если сумма повышений температуры у всех 8 кроликов не превышает 3,7°С, а индивидуальное повышение температуры на 0,6°С.
5. Исследование лекарственных средств, не стерилизуемых в процессе производства: какие показатели определяются?
В отношении лекарственных средств, не стерилизуемых в процессе производства, проводится испытание на микробиологическую чистоту. Это испытание включает в себя количественное определение жизнеспособных бактерий и грибов, а также выявление определённых видов микроорганизмов, наличие которых недопустимо в нестерильных лекарственных средствах. Испытание проводят в асептических условиях. Лекарственные средства, обладающие антимикробным действием, и консерванты, входящие в состав некоторых лекарственных средств, могут подавлять рост отдельных видов микроорганизмов при проведении испытаний. Во избежание неправильной оценки результатов испытания определяют действие лекарственного средства в отношении тест-микробов. Для испытания антимикробного действия лекарственного средства, не стерилизуемого в процессе производства, применяют тест-микробы: B.subtilis, B.cereus, E.coli, S.aureus, Salmonella abony, Candida albicans, Aspergillus. Предварительно готовят разведения лекарственного средства: 1:10, 1:50, 1:100, 1:500, 1:1000. В пробирки с питательными средами вносят по 1 мл каждого разведения, в контрольные пробирки – по 1 мл стерильной дистиллированной воды. Затем во все пробирки вносят по 0,1 мл микробной взвеси тест-штамма. При обнаружении антимикробного действия лекарственного средства устраняют его и после этого производят посев на микробиологическую чистоту. При отсутствии антимикробного действия производят прямой посев. Количественное определение бактерий и грибов проводят двухслойным агаровым методом в чашках Петри.
