- •Оглавление
- •Часть 2. Инфекция и иммунитет. 2
- •Вопросы для подготовки к экзамену по микробиологии для студентов 3 курса лечебного факультета (с ответами)
- •Часть 2. Инфекция и иммунитет.
- •Понятие об инфекционном процессе. Факторы инфекционного процесса. Формы симбиоза макро- и микроорганизма. Роль макроорганизма и микроорганизмов в инфекционном процессе.
- •3 Фактор Окружающая среда
- •Патогенность и вирулентность бактерий. Количественное определение. Факторы патогенности бактерий. Микробные экзо- и эндотоксины. Свойства. Химический состав.
- •Местная и генерализованная инфекция. Понятие о бактериемии, токсинемии, сепсисе.
- •Виды инфекционного иммунитета. Характеристика.
- •Учение об иммунитете. История. Современное представление.
- •Факторы врожденного иммунитета (клеточные, гуморальные, функциональные)
- •Гуморальный иммунитет. Понятие. Особенности первичного и вторичного иммунного ответа.
- •Формы иммунного ответа. Понятие об иммунопатологии.
- •Серодиагностика инфекционных заболеваний. Принципы. Понятия о титре и диагностическом титре.
- •Серологические реакции
- •Смысл любой серологической реакции – визуализировать взаимодействие аг и ат в лабораторных условиях.
- •Понятие об антигенах и гаптенах. Адъюванты. Антигенная структура бактериальной клетки.
- •Интерфероны. Природа, свойства, механизм действия. Основные продуценты. Практическое применение.
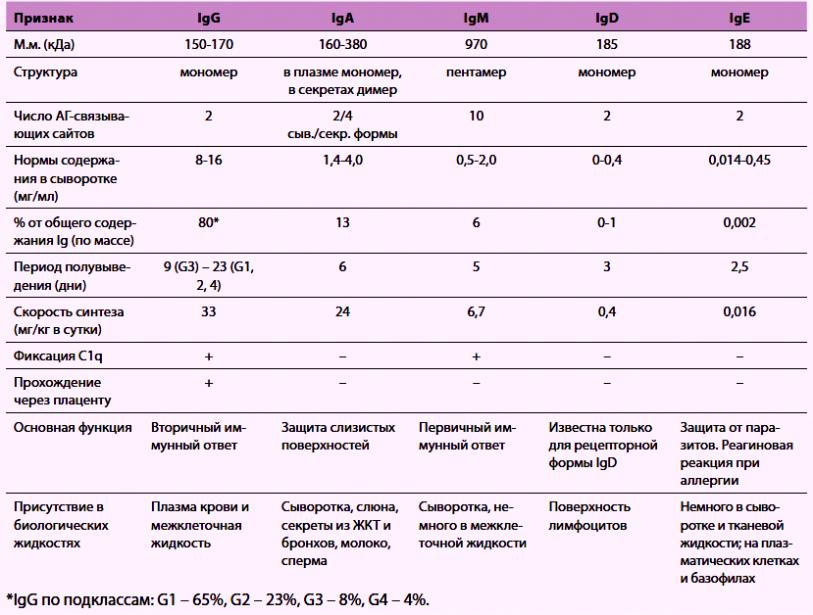
- •Классы иммуноглобулинов (антитела) Структура. Свойства. Функции.
- •Антитоксические сыворотки. Методы получения. Диаферм. Применение антитоксических сывороток в медицине
- •Реакция агглютинации, ее разновидности (ориентировочная, непрямая, развернутая). Механизм. Практическое применение.
- •Реакция непрямой (пассивной) гемагглютиниции. Механизм. Практическое использование.
- •Реакция преципитации. Механизм. Разновидности (кольцепреципитация, реакция преципитации в геле). Применение в медицинской практике.
- •Реакция иммунофлуоресценции (прямая и непрямая). Механизм. Использование в диагностике.
- •Реакция нейтрализации. Принцип. Механизм. Использование в микробиологии при бактериальных и вирусных инфекциях.
- •Реакция гемагглютинации и торможения гемагглютинации в вирусологии.
- •Иммуноферментный метод исследования. Принцип метода. Определение антигенов и антител с помощью ифа.
- •Гиперчувствительность замедленного типа. Механизм ее проявления. Аллергические пробы. Практическое использование в диагностике инфекционных заболеваний.
- •Гиперчувствительность немедленного типа. Анафилаксия. Механизм ее возникновения. Методы предупреждения.
- •Вакцины. Определение. Типы вакцин. Их получение. Вакцинопрофилактика и вакцинотерапия.
- •Анатоксины. Общая характеристика, получение и применение. Значение в профилактике инфекционных болезней.
- •Иммунные сыворотки. Классификация. Получение. Применение. Понятие о серотерапии и серопрофилактике.
- •Иммуноглобулины (гамма-глобулины) гомологичные и гетерологичные. Получение и применение.
Классы иммуноглобулинов (антитела) Структура. Свойства. Функции.
Ответ.
АТ – белки (гликопротеиды), образование которых индуцируется АГ.
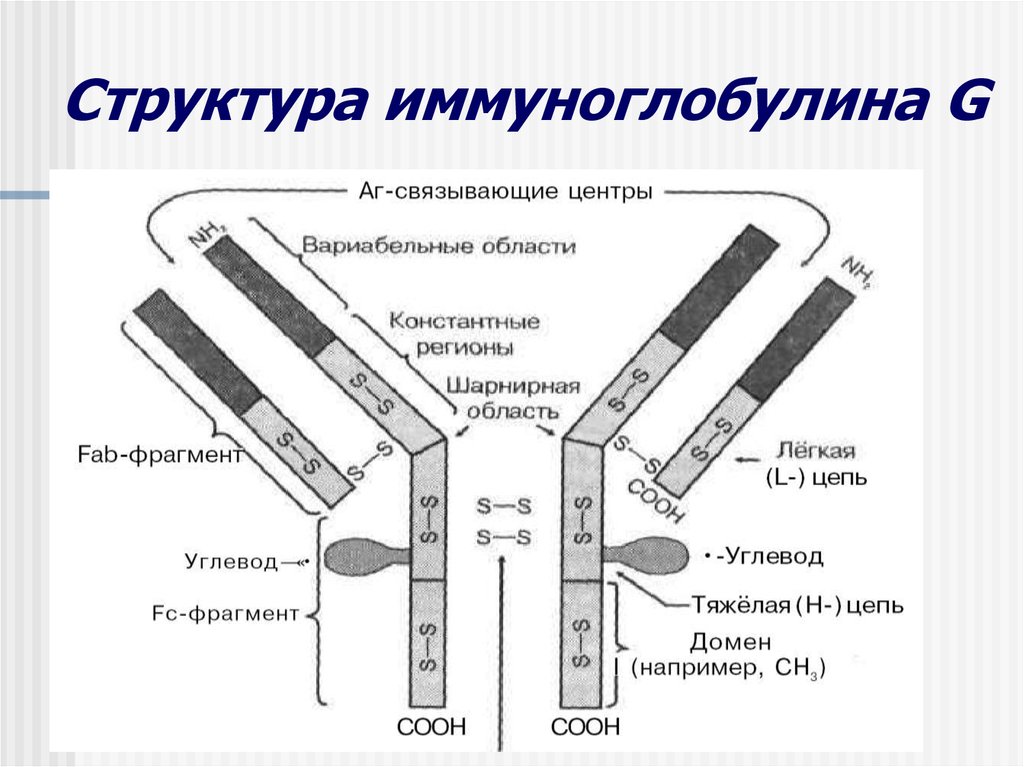
Белковая часть молекулы иммуноглобулина состоит из 4 полипептидных цепей – двух тяжелых Н-цепей (англ. Heavy chains) и двух легких L-цепей (англ. Light chains), различающихся по молекулярной массе. В одной молекуле иммуноглобулина каждая пара легких и тяжелых цепей идентична друг другу. Каждая полипептидная цепь состоит из в а р и а б е л ь н о й V- и стабильной, или к о н с т а н т н о й , С-части, которые на электронно-микроскопических снимках имеют форму буквы Y.
V-участок начинается с М-конца полипептидной цепи и заканчивается примерно на 110 аминокислотном остатке, как в легких, так и в тяжелых цепях. Они составляют активный центр — паратоп. Участки такой протяженности получили название доменов. Легкая цепь состоит из двух доменов, один из которых относится к V-участку, другой – к С-участку.
V-участок тяжелой цепи представлен одним доменом, в то время как С-участок включает 3 или 4 домена в зависимости от класса иммуноглобулина.
Каждая пара легких и тяжелых цепей связана дисульфидными мостиками, расположенными между их С-участками. В свою очередь обе тяжелые цепи также соединены друг с другом аналогичными мостиками между их константными участками, образующими шарнир. В пределах каждого домена полипептидная цепь уложена особым образом и виде петель. Три петли в вариабельных доменах легкой и тяжелой цепи составляют гипервариабельный участок, который входит в состав антигенсвязывающего центра.
При гидролизе иммуноглобулина G (IgG), вызванном протеолитическим ферментом папаином, легкие и тяжелые полипетидные цепи распадаются на три фрагмента: два Fab-фрагмента (англ. Fragment antigen binding) и один Fc-фрагмент (англ. Fragment crystalline).
Свободные концы каждого Fab-фрагмента (NH2 или N-концы) входят в состав вариабельных доменов, формирующих антигенсвязывающий АКГИВНЫЙ ЦЕНТР.
Fc-фрагмент имеет свободные концы (СОО-концы), представляющие собой полипептиды с одинаковыми аминокислотными последовательностями у антител разной специфичности, и не принимают участия в формировании антигенсвязывающего центра. Их функции заключаются в фиксации и последующей активации системы комплемента по классическому пути после образования комплекса антиген-антитело, в прикреплении иммуноглобулина G к Fc-рецепторам клеточных мембран и в прохождении IgG через плаценту. В области Fc-фрагментов антител локализуются участки (эпитопы), определяющие индивидуальную, видовую, групповую антигенную специфичность данного иммуноглобулина.
Классы имуноглобулинов.
1. Иммуноглобулины G – это мономеры, включающие в себя четыре субкласса (IgG1; IgG2; IgG3; IgG4), которые отличаются друг от друга по аминокислотному составу и антигенным свойствам. Антитела субклассов IgG1 и IgG4 специфически связываются через Fc-фрагменты с возбудителем (иммунное опсонирование), а благодаря Fc-фрагментам взаимодействуют с Fc-рецепторами фагоцитов, способствуя фагоцитозу возбудителя. IgG4 участвует в аллергических реакциях и неспособен фиксировать комплемент.
Свойства иммуноглобулинов G:
1) играют основополагающую роль в гуморальном иммунитете при инфекционных заболеваниях;
2) проникают через плаценту и формируют антиинфекционный иммунитет у новорожденных;
3) способны нейтрализовать бактериальные экзотоксины, связывать комплемент, участвовать в реакции преципитации.
7S, 1 АЦ, соединение в сыворотке крови – 80%.
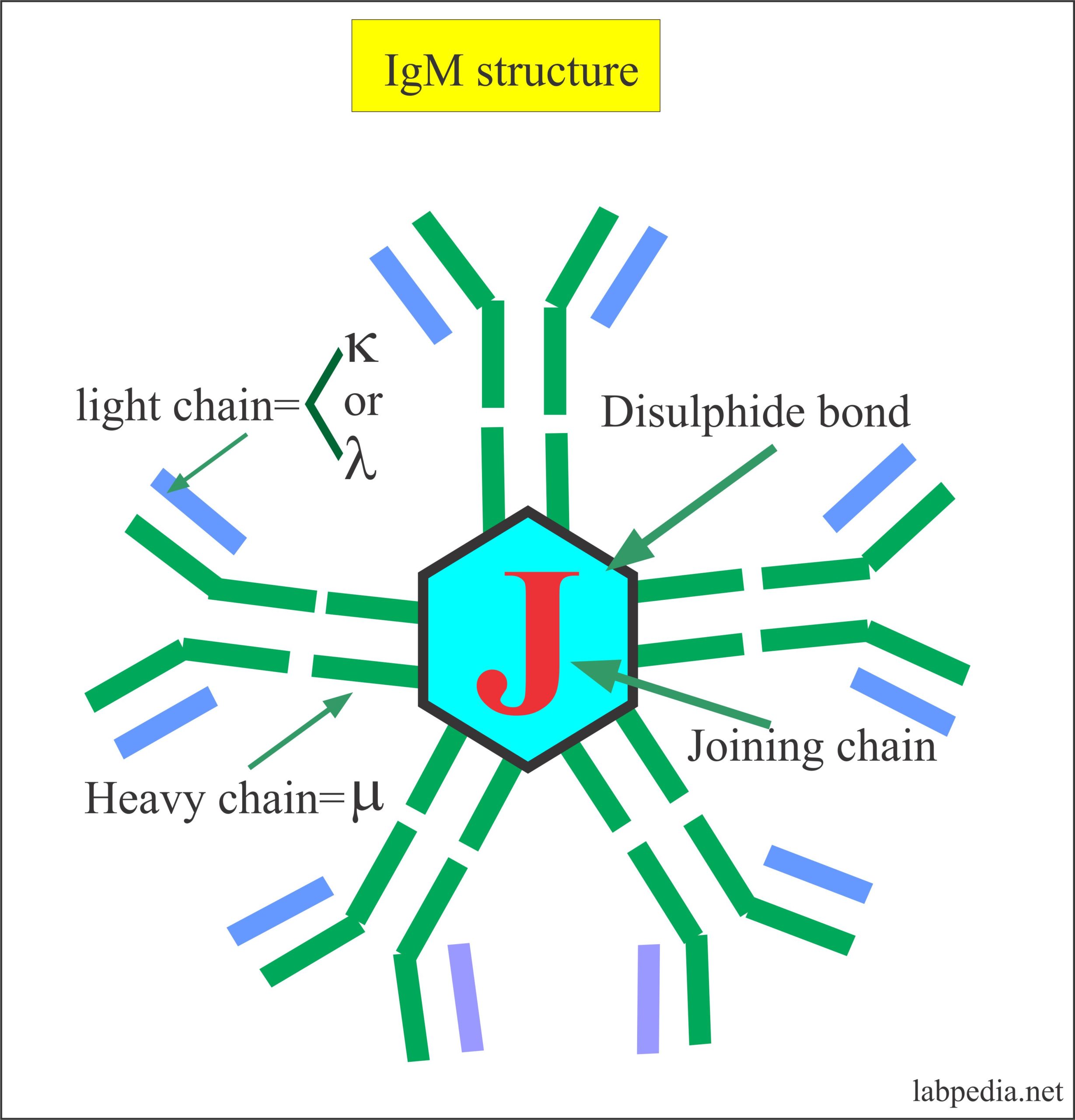
2. Иммуноглобулины М включают в себя два субкласса: IgM1 и IgM2.
Свойства иммуноглобулинов М:
1) не проникают через плаценту;
2) появляются у плода и участвуют в антиинфекционной защите;
3) способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент;
4) играют важную роль в элиминации возбудителя из кровеносного русла, активации фагоцитоза;
5) образуются на ранних сроках инфекционного процесса;
6) отличаются высокой активностью в реакциях агглютинации, лизиса и связывания эндотоксинов грамотрицательных бактерий.
19S, 5 АЦ, соединение в сыворотке крови – 13%.
3. Иммуноглобулины А – это секреторные иммуноглобулины, включающие в себя два субкласса: IgA1 и IgA2. В состав IgA входит секреторный компонент, состоящий из нескольких полипептидов, который повышает устойчивость IgA к действию ферментов.
Свойства иммуноглобулинов А:
1) содержатся в молоке, молозиве, слюне, слезном, бронхиальном и желудочно-кишечном секрете, желчи, моче;
2) участвуют в местном иммунитете;
3) препятствуют прикреплению бактерий к слизистой;
4) нейтрализуют энтеротоксин, активируют фагоцитоз и комплемент.
7-13S, 1,2,4 АЦ, соединение в сыворотке крови – 40%.

4. Иммуноглобулины Е (реагины) – это мономеры, содержание которых в сыворотке крови ничтожно мало. К этому классу относится основная масса аллергических антител – реагинов. Уровень IgE значительно повышается у людей, страдающих аллергией и зараженных гельминтами. IgE связывается с Fc-рецепторами тучных клеток и базофилов.
Свойства иммуноглобулинов Е: при контакте с аллергеном образуются мостики, что сопровождается выделением БАВ, вызывающих аллергические реакции немедленного типа.
7S, 1 АЦ, соединение в сыворотке крови – 75%.
5. Иммуноглобулины D – это мономеры. Функционируют в основном в качестве мембранных рецепторов для антигена. Плазматические клетки, секретирующие IgD, локализуются преимущественно в миндалинах и аденоидной ткани.
Свойства иммуноглобулинов D:
1) не проходят через плаценту;
2) обладают антивирусной активностью;
3) почти не активируют комплемент;
4) участвуют в дифференцировке В-клеток, способствуют развитию антиидиотипического ответа;
5) участвуют в аутоиммунных процессах.