
- •Химия и экология
- •Большую экологическую опасность с учетом масштабности действия представляет диоксид серы —SO2, антропогенные суммарные
- •Пространственное
- •Воздействие диоксида серы на окружающую среду проявляется в увеличении заболеваемости людей, снижении продуктивности
- •Основным окислителем соединений серы являются свободные радикалы. Сероводород последовательно в ряде стадий окисляется
- •Соединения азота в тропосфере
- •Соединения азота в тропосфере
- •Соединения азота в тропосфере
- •В связывании атмосферного азота большую долю составляет его промышленная фиксация в процессе производства
- •При сжигании природного топлива оксиды азота могут образовываться как за счет высокотемпературного окисления
- •Из других оксидов азота, оказывающих существенное влияние на глобальную экологическую ситуацию, следует выделить

Химия и экология
Лекция №7

Большую экологическую опасность с учетом масштабности действия представляет диоксид серы —SO2, антропогенные суммарные выбросы
которого в мире составляют около 150 млн т/г. Наибольшее количество — до 70% — выбрасывают с дымовыми газами топливно-энергетические установки, перерабатывающие угли и мазуты с большим содержанием серы, а также предприятия цветной и черной металлургии (15%) при переработке сульфидных руд.
Cu2S + 2О2 →2CuO + SO2 4FeS2 +11О2 → 2Fe2O3 + 8SO2
Наряду с массовыми загрязняющими выбросами медеплавильных заводов, при производстве серной кислоты, при травлении металлов, на литейных производствах, вредное влияние SO2 сказывается на нефтеперегонных,
кожевенных, суперфосфатных и др. заводах, при добыче нефти, в кузницах и котельных.
2

Пространственное
распределение концентрации диоксида серы в атмосфере неоднородно. В течение года более высокие концентрации наблюдаются вблизи крупных промышленных центров в зимние месяцы (максимальная нагрузка предприятий энергетики). В этот период среднемесячные концентрации диоксида серы в 3-6 раз превышают летние значения и составляют 8—16 мкг/м3.
Распределение по резервуарам (Мт) и миграционные потоки (Мт/год) |
3 |
|
серы в географической оболочке Земли |
||
|
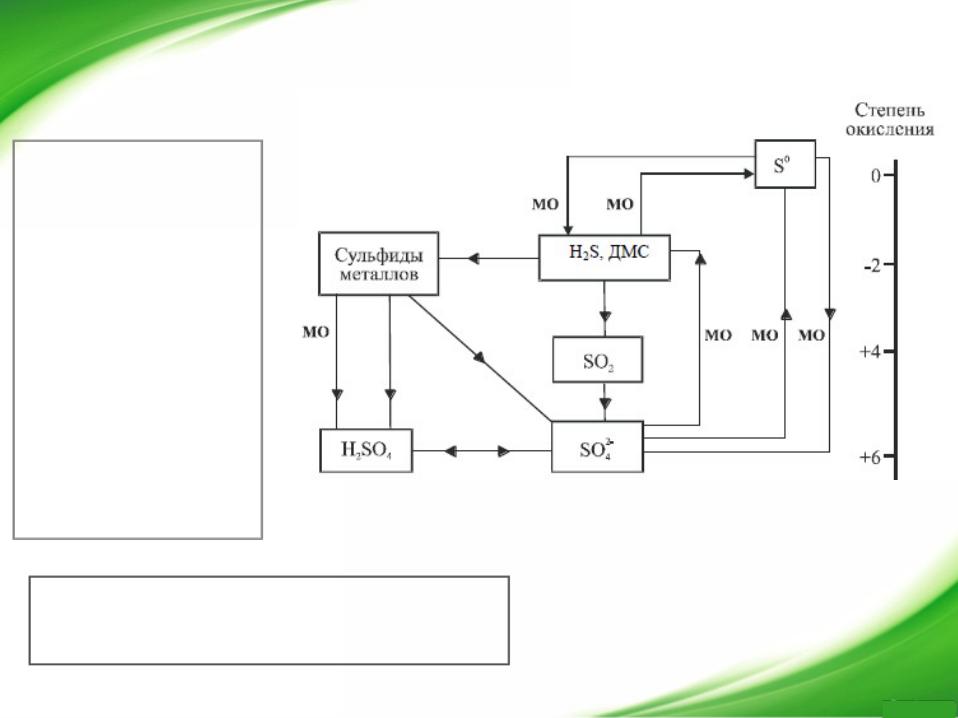
Воздействие диоксида серы на окружающую среду проявляется в увеличении заболеваемости людей, снижении продуктивности сельскохозяйственных угодий, ускорении коррозии металлоконструкций, разрушении архитектурных сооружений и памятников культуры.
Химические соединения, участвующие в цикле серы. МО – процессы, осуществляемые микроорганизмами, ДМС – диметилсульфид CH3SCH3
По некоторым данным одна тонна выбрасываемой серы может причинить ущерб в размере 2000 долларов.
4

Основным окислителем соединений серы являются свободные радикалы. Сероводород последовательно в ряде стадий окисляется до SO2.
Полученный в результате диоксид серы, как и SO2,
поступающий из других источников, окисляется далее.
H2S + OH → H2O + HS; HS + O2 → SO + OH; SO + H2O → SO2 + OH.
Окисление диоксида серы может протекать в газовой фазе — первый путь, в твердой фазе (окислению предшествует адсорбция) — второй путь и в жидкой фазе (окислению предшествует абсорбция) — третий путь.
Основной механизм процесса в газовой фазе (первый путь) связывали с образованием диоксида серы в возбужденном состоянии, который, реагируя с молекулярным кислородом, образует SO3.
Реакция с участием третьего тела М:
Образующийся SO3 вступает во взаимодействие с молекулой
воды:
SO3 + H2O → H2SO4
5

Соединения азота в тропосфере
Основное количество азота на Земле содержится в молекулярном состоянии в атмосфере — 75,6% (по массе, 3.87·106Гт) и только 0,01% приходится на литосферу. Азот имеется в почве, растениях и живых организмах, без азота не образуются белковые вещества, необходимые для построения протоплазмы клеток. Животные и большинство растений потребляют не свободный, а связанный азот, так как молекулы азота представляют собой чрезвычайно прочные и химически инертные частицы. В природе значительные количества молекулярного азота связываются в оксиды при естественных процессах — грозах, нитрификации почвы, лесных пожарах. Общее количество оксидов азота, образующихся в этих процессах, составляет около 770 млн тонн в год.
В атмосфере каждый год |
Кратковременное действие |
наблюдается до 3 млрд молний. |
высоких температур и |
Создаваемые ими высокие |
быстрое охлаждение |
температуры в несколько тысяч |
продукта реакции — оксида |
градусов инициируют процесс |
азота (II) — препятствуют |
взаимодействия молекулярного |
протеканию обратной |
азота и кислорода по |
реакции его разложения. В |
радикально-цепному механизму: |
свою очередь оксид азота (II) |
|
окисляется кислородом |
|
воздуха до оксида азота (IV): |
При взаимодействии с атмосферной влагой происходит образование азотистой и азотной кислот:
2NO2 + Н2O →HNO2 + HNO3
В почвах и водных экосистемах также происходит довольно быстрая нитрификация – окисление ионов аммония с образованием более доступных растениям нитритных и нитратных ионов:
4NH4++6O2→4NO2-+8H++4H2O 4NO2-+2O2→4NO3-
6

Соединения азота в тропосфере
Химические соединения, участвующие в цикле азота, отличающиеся по степени окисления
Цифрами обозначены процессы азотфиксации (1), нитрификации (2), включения в растительные ткани (3), аммонификации (4), денитрификации (5), стока из атмосферы при сухом и влажном осаждении на поверхность
(6) и осадконакопления (7)
7

Соединения азота в тропосфере
В природе молекулярный азот может также фиксироваться клубеньковыми бактериями бобовых растений, дрожжевыми и плесневыми грибками, сине-зелеными водорослями. Превращение молекулярного азота в состояние, усваиваемое растениями, происходит благодаря восстановительному процессу, в котором решающую роль играет фермент нитрогеназа:
N2+6e+8H+→2NH4+
Таким образом, в природе осуществляется азотфиксация и последующее включение атомов азота в неорганические молекулы и биомолекулы. После гибели растений и животных содержащие азот химические соединения подвергаются микробиологическому разложению и, как это показано на примере глицина, аммонификации:
H2NCH2COOH + 1,5O2 → NH3 +2CO2 +H2O
В не возмущенной человеком биосфере азотфиксация и нитрификация в масштабах планеты почти полностью уравновешиваются противоположным процессом, называемым денитрификацией. Денитрификация – это образование молекулярного азота из органических соединений, нитратов и нитритов в почвах и водных экосистемах в аэробных и анаэробных условиях.
Денитрификация не всегда приводит к выделению молекул N2. Она может также завершаться образованием оксидов азота:
[CH |
O] + 2NO |
3 |
- +6H+ → N O + CO |
+ H |
O, |
|
|
2 |
|
2 |
2 |
2 |
|
|
|
[CH2O] + 4NO2- +4H+ → 4NO + CO2 + 3H2O |
8 |
||||||

В связывании атмосферного азота большую долю составляет его промышленная фиксация в процессе производства аммиака, азотной кислоты и азотных удобрений. На эти процессы расходуется примерно 100 млн тонн азота в год.
Важной задачей является познание экологических аспектов действия одних из наиболее опасных и масштабных загрязнителей окружающей среды — оксидов азота NOx (NO,
NO2). |
В |
результате |
хозяйственной деятельности человека в настоящее время образуется около 60 млн т/год оксидов азота. Основным источником оксидов азота в промышленно развитых странах являются энергетика и транспорт, дающие около 90% выбросов; на долю химической промышленности приходится менее 5%.
Оксиды азота обладают выраженным общетоксичным и раздражающим действием. При контакте диоксида азота с влажной поверхностью легких происходит образование азотной и азотистой кислот, которые поражают альвеольную ткань, что приводит к отеку лёгких. С другой стороны, в организме может происходить образование солей этих кислот — нитратов и нитритов, которые вызывают значительные изменения в крови и влияют на сердечно-сосудистую систему. Кроме того, нитраты, поступающие в организм в повышенных дозах, способны повышать частоту инфекционных заболеваний, болезней кожи и подкожной клетчатки, лор-органов, ослабляют иммунитет.
9

При сжигании природного топлива оксиды азота могут образовываться как за счет высокотемпературного окисления азота воздуха по радикально-цепному механизму, так и в результате взаимодействия радикальных частиц, образующихся при пиролизе (пиролиз — разложение органических соединений при высокой температуре) с азотом воздуха:
N2 + НС· →HCN + N· |
N· + OH·→H· + NO |
Образование происходит через ряд промежуточных соединений. Одним из промежуточных продуктов окисления азота воздуха и азотсодержащих соединений топлива является такое чрезвычайно ядовитое вещество, как цианистый водород — HCN. Образование HCN отмечено при пиролизе пиридина и при окислении различных азотсодержащих соединений в смесях с топливом при недостатке кислорода. Независимо от природы азотсодержащей добавки (NO, NH3 CH3CN
или пиридин) связанный азот почти полностью переходит в HCN в реакционной зоне пламени. По мере удаления от этой зоны количество HCN уменьшается за счет превращения в N2 и NOX. В
продуктах сгорания азотсодержащего топлива при недостатке кислорода, наряду с HCN, N2 и
NOX, можно обнаружить также и аммиак. Описанные превращения могут быть представлены следующей схемой:
Азотсодержащие соединения, входящие в состав топлива (соединения основного |
|
характера — производные пиридина, хинолина, акридина, а также различные амиды, |
|
нитрилы, производные пиррола, индола, карбазола и другие), также являются |
10 |
источниками образования оксидов азота при его сжигании. |
