
- •Неметаллы IVA и IIIA групп
- •Неметаллы IVА- группы
- •Углерод
- ••Схемы строения различных модификаций углерода
- •Химические свойства углерода
- ••Окислительные свойства. 1. с Н2 (600оС, р, кат. Pt):
- •Соединения углерода
- •Соли угольной кислоты
- •Применение углерода и его соединений
- •Кремний
- •Кристаллическая решетка
- •Химические свойства кремния
- •Свойства водородных соединений
- •Кислородные соединения кремния
- •SiO2- кремнезем
- •Кремниевые кислоты и их соли
- •Стекло, керамика, цемент
- •Химические свойства бора
- •Получение и применение бора
- •Водородные соединения бора - бораны
- •Кислородные соединения бора
- •Бораты, бориды
- •BN – нитрид бора

Неметаллы IVA и IIIA групп
Углерод, кремний , бор
Автор: к.х.н., доцент Мартынова Т.В.
Неметаллы IVА- группы
Свойства |
C |
Si |
Ge |
|
|
|
|
Валентные е- |
2s2p2 |
3s2p2 |
4s2p2 |
|
|
|
|
Rатома, нм |
0,077 |
0,118 |
0,139 |
Энергия ионизации |
11,32 |
8,21 |
7,95 |
атома, эВ |
|
|
|
|
|
|
|
ОЭО |
2,6 |
1,9 |
2,0 |
|
|
|
|
Характерные СО |
-4,+2,+4 |
-4+2,+4 |
-4,+2+4 |
|
|
|
|
Углерод
Аллотропные модификации
Свойства |
Графит |
Алмаз |
Карбин |
Фуллерен |
Гибридиза- |
sp2 |
sp3 |
sp |
sp2 |
ция |
|
|
|
|
Структура |
Слои правильных |
Тетраэдричес |
Линейные |
С60- С70 полые |
|
шестиугольников |
кая, плотно |
макромоле- |
сферы |
|
|
упакованная. |
кулы(-С≡С-) |
|
|
|
|
или (=С=С=) |
|
Физические |
Серо-черное с |
Бесцветное, |
Кристаллы |
Черный |
свойства |
металлическим |
прозрачное, |
белого цвета |
мелкокристал |
|
блеском, жирное |
самое твердое |
или черный |
лический |
|
на ощупь, мягкое, |
из простых |
порошок, с |
порошок, с |
|
электропроводное, |
веществ с |
полупровод |
полупроводни |
|
тугоплавкое в-во. |
высоким |
никовыми |
ковыми |
|
Разновидности: |
лучепреломле |
свойствами. |
свойствами, |
|
сажа и древесный |
нием |
|
производный |
|
уголь |
|
|
графена |
|
|
|
|
|
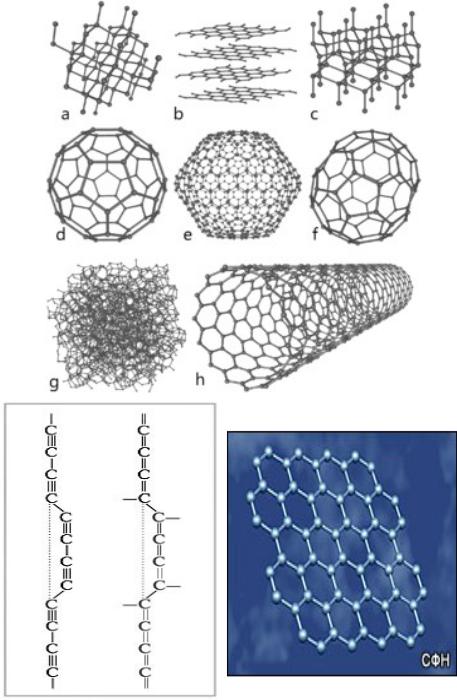
•Схемы строения различных модификаций углерода
a: алмаз, b: графит, c: лонсдейлит,
d: фуллерен — букибол C60, e: фуллерен C540, f: фуллерен C70
g: аморфный углерод, h: углеродная нанотрубка, i:карбин ( и β-карбин), j: графен.
Химические свойства углерода
•При обычных температурах инертен. При повышенных - проявляет восстановительные и окислительные свойства.
•Восстановительные свойства:
1. с H2O при 800-1000оС: С+Н2О↔СО+Н2 – водяной газ;
2.с кислотами–окислителями: C+4HNO3=CO2+2H2O+4NO2;
3.с кислородом и другими неметаллами: С+О2=СО2;
4.с оксидами Ме: C+2PbO=2Pb+CO2.
•Окислительные свойства. 1. с Н2 (600оС, р, кат. Pt):
C+2H2 = CH4 (метан)
2. образует карбиды с Ме 3C+Fe=Fe3C 2C+Ca=CaC2 4Al+3C=Al4C3
Соединения углерода
•СО – оксид углерода (II) –бесцветный газ, тяжелее воздуха, малорастворим в воде, ядовит.
•Получение: 2C+O2=t 2CO (при недостатке О2)
CO2+C=2CO
В лаборатории действием H2SO4 на муравьиную к-ту: HCOOH→CO+H2O.
•Химические свойства - восстановитель:
•2CO+O2=2CO2 (горение)
•CO+CuO=Cu+CO2 (получение металлов)
•CO+Cl2=COCl2 (фосген)
•Качественная р-ция (при комнатной t) : I2O5+5СО=5СО2+I2.
•Образует комплексы с d-Ме: [Ni(CO)4], [Co2(CO)9], [Fe(CO)5].
Соединения углерода +4
•CO2- оксид углерода (IV) (углекислый газ) – бесцветный, без запаха, тяжелее воздуха, легко сжижается и кристаллизуется, мало растворим в воде.
•Получение: 1) С+О2=t СО2;
2)CaCO3→t CaO+CO2;
3)CaCO3+2HCl=CaCl2+H2O+CO2;
4)спиртовое брожение: C6H12O6=2C2H5OH+2CO2.
• Химические свойства. 1)окислительные: CO2+2Mg=C+2MgO;
2)кислотные: CO2+NaOH =NaHCO3; CO2+CaO=CaCO3;
гидрокарбонат карбонат
CO2+H2O↔H2CO3↔H++HCO3-↔2H++CO32-
неустойчивоерН<7 практически не идет
Соли угольной кислоты
•Растворимые карбонаты (гидрокарбонаты, карбонаты щелочных металлов и аммония). подвергаются гидролизу:
Na2CO3+H2O=NaHCO3+NaOH
CO32- + H2O = HCO3- +OH-
•Многие карбонаты разлагаются под действием нагревания и под действием сильных кислот (см. способы получения СО2) :
Применение углерода и его соединений
•Алмазы –в ювелирных изделиях, при бурении скважин алмазными бурами, сверлении металлов, резании стекла алмазными инструментами.
•Графит – изготовление: тиглей для плавки металлов, электродов, карандашей, смазочных масел, черных красок.
•Уголь – топливо; коксованием получают : кокс для металлургии, светильный газ, каменноугольную смолу, содержащую бензол, фенол, нафталин и др.
•СО2 – в производстве сахара, газированных напитков, соды, при тушении пожаров.
•Na2CO3 – мыловарение, производство стекла.
