
гидролиз
.docxПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Санкт-Петербургский горный университет»
Кафедра общей химии
Л а б о р а то р н а я р а б о т а № 4
-
По дисциплине
Химия
Тема: Исследование гидролиза солей
Автор: студент гр. САМ-21-1 |
|
Аваргина Е.А. |
|
ОЦЕНКА: |
_______ |
|
|
Дата: |
|||
ПРОВЕРИЛ |
|
|
|
Санкт-Петербург
2021 год
Цель работы: ознакомиться с процессом гидролиза солей и его следствиями, научиться составлять уравнения гидролиза.
Общие сведения:
Гидролизом называют процесс химического взаимодействия солей с водой. Продуктами гидролиза являются малодиссоциированные соединения в растворе, иногда – осадки или газы. Соответственно соли, образованные сильной кислотой и сильным основанием, не гидролизуются. К ним относятся, например, хлориды, нитраты
сульфаты щелочных металлов, стронция и бария. Различают три типа гидролизующихся солей:
Гидролиз соли, образованной сильным основанием и слабой кислотой.
Гидролизуется анион слабой кислоты: А− + Н2О = НА + ОН−, в растворе появляются ионы ОН−, поэтому среда – щелочная, рН > 7. Например, Na2CO3 образован сильным основанием NaOH и слабой угольной кислотой H2CO3. Диссоциация карбоната натрия описывается уравнением:
 .
.
С водой карбонат-ион взаимодействует по реакции
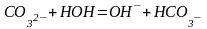 .
.
Распределяя катионы натрия по образующимся в ходе гидролиза анионам, получим молекулярное уравнение гидролиза:
Na2CO3 + H2O = NaHCO3 + NaOH.
Гидролиз соли, образованной слабым основанием и сильной кислотой.
Гидролизуется
катион слабого основания: М+
+ Н2О
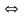 МОН
+ Н+,
в растворе появляются ионы Н+,
поэтому среда кислая, рН < 7. Например,
FeSO4
образован слабым основанием Fe(OH)2
и сильной кислотой H2SO4.
Сульфат железа (II) диссоциирует по
реакции:
МОН
+ Н+,
в растворе появляются ионы Н+,
поэтому среда кислая, рН < 7. Например,
FeSO4
образован слабым основанием Fe(OH)2
и сильной кислотой H2SO4.
Сульфат железа (II) диссоциирует по
реакции:
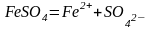
С водой реагирует остаток слабого основания – катион Fe2+:
Fe2+ + HOH → FeOH+ + H+.
Так как в ходе гидролиза образуются ионы H+, то среда в растворе FeSO4 будет
кислой.
Молекулярное уравнение гидролиза:
2FeSO4 + 2H2O = (FeOH)2SO4 + H2SO4.
Степень гидролиза солей этих двух групп невелика, не превышает нескольких процентов. Поэтому гидролиз многозарядных ионов протекает не далее первой ступени, то есть ограничивается взаимодействием иона только с одной молекулой воды.
Гидролиз соли, образованной двумя слабыми электролитами.
Гидролиз протекает как по катиону, так и по аниону: М+ + А− + Н2О = МОН + НА. Например, ацетат натрия CH3COONa образован слабым основанием NH4OH и слабой кислотой CH3COOH, соответственно с водой взаимодействует и катион аммония и ацетат-ион:
CH3COO− + NH+4 + H2O = CH3COOH + NH4OH
Молекулярная форма реакции:
CH3COONH4 + H2O = CH3COOH + NH4OH
Образующиеся слабые кислота и основание диссоциируют в разной степени, поэтому среда в растворе зависит от их относительной силы. Если кислота сильнее, то
константа диссоциации больше и среда слабокислая. Если сильнее основание, то среда слабощелочная.
Степень гидролиза соли, образованной слабой кислотой и слабым основанием многократно выше, чем у солей первых двух групп, гидролизующихся только по одному иону. Если продуктами гидролиза являются труднорастворимые соединения или газы, то гидролиз протекает полностью. Пример необратимого, полного гидролиза:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S.
Степень гидролиза солей зависит от ряда факторов, определяемых принципом Ле-Шателье.
Чем слабее кислота или основание, образующиеся в результате гидролиза, тем выше глубина протекания процесса.
увеличением количества воды, то есть с разбавлением раствора, степень гидролиза возрастает.
Поскольку гидролиз всегда протекает с поглощением тепла, является эндотермической реакцией, степень гидролиза повышается при нагревании раствора.
Гидролиз солей первой группы может быть подавлен добавлением кислоты, а во второй группе солей – добавлением щелочи.
При смешивании растворов солей первой и второй групп происходит взаимное усиление гидролиза.
Порядок выполнения работы
Опыт №1.
№ |
Формула соли |
Окраска |
pH ,по инд. |
Окраска |
Среда |
|
|
лакмуса |
бумаги |
фенолфталеина |
|
1 |
ZnSO4 |
Светло-сиреневый |
6 |
Жёлтая |
Кислая |
2 |
Al2 |
Бледно-розовая |
4 |
Оранжевая |
Кислая |
3 |
Na2CO3 |
Фиолетовая |
10 |
Сине-зелёная |
Щелочная |
4 |
(CH3COO)₂Pb |
Бледно-розовая |
5 |
Светлооранжевая |
Нейтральная |
№ |
Реакция |
1 |
ZnSO4
+
2H2O
→ Zn 1 ступень: ZnSO4
+
H2O
→ Zn(OH)S 2 ступень: Zn(OH)SO4
+
H2O
→ Zn
↓
+
|
2 |
Al2(SO4)3 + 6H2O → 2Al(OH)₃↓ + 3H2SO4(общий вид, по катиону) 1 ступень: Al2(SO4)3 + H2O → Al(OH)SO4 + H2SO4 2 ступень: Al(OH)SO4 + H2O → Al(OH)3↓ + H2SO4 |
3 |
Na2CO3 + 2H2O → 2NaOH + H2CO3(общий вид, по аниону) 1 ступень: Na2CO3 + H2O → NaHCO3 + NaOH 2 ступень: NaHCO3 + H2O → H2CO3+ NaOH |
4 |
(CH3COO)2Pb +2H2O → 2CH3COOH + Pb(OH)2↓(общий вид, по катиону и по аниону)
|
Опыт №3(В).
1 ступень:
SbCl3 → Sb3+ + 3Cl-
Sb3+ +HOH → SbOH2+ + H+
SbCl3 + H2O → Sb(OH)Cl2 + HCl
2 ступень:
Sb(OH)Cl2 → SbOH2+ + 2Cl-
Sb(OH)Cl2 + HOH → Sb(OH)2+ + H+;
Sb(OH)Cl2 + HOH → SbOCl↓ + HCl + H2O
SbOCl + 2HCl → SbCl3 + H2O
Опыт №4.
Al2(SO4)3 + 6H2O + 3Zn → 3H2↑+ 3ZnSO4 + 2Al(OH)3↓
2Al3+ + 3(SO4)2- + 6HOH + 3Zn → 3H2↑ + 3Zn2+ + 3SO42- + 2Al(OH)3↓
Происходит взаимное усиление гидролиза, равновесие смещается вправо, гидролиз усиливается и протекает полностью.
Опыт №5.
2FeCl3 + 3Na2CO3 + 3H2O→2Fe(OH)3↓ + 6NaCl + 3CO2↑
2Fe3++ 3CO32-+ 3HOH→2Fe(OH)3↓ + 3CO2↑
CuSO4 + Na2CO3 + H2O→Cu(OH)2↓ + Na2SO4 + CO2↑
Cu2+ + CO32 + 3HOH→Cu(OH)2↓ + 3CO₂↑
Вывод: В ходе опыта я ознакомилась с процессом гидролиза солей и его следствиями, научилась составлять уравнения гидролиза. Также я повторила и закрепила теорию по гидролизу солей.

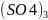
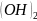 ↓+
↓+
 (общий
вид, по катиону)
(общий
вид, по катиону)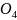 + H2SO4
+ H2SO4 S
S