
Laba_2_скорость хим реакций
.docxФедеральное агентство по образованию
Российской Федерации

Федеральное государственное бюджетное образовательное учреждение высшего образования
«Санкт-Петербургский горный университет»
Кафедра общей химии
Отчет
по лабораторной работе №2
«Исследования скорости химических реакций химического равновесия»
Выполнил: студент группы ЭРБ-16 Емельянов Е.А.
(должность) (подпись) (Ф.И.О)
Проверил: доцент Кужаева А. А.
(должность) (подпись) (Ф.И.О)
Санкт-Петербург
2016
Цель работы: изучить зависимость скорости реакций от концентрации реагентов и температуры, а также ознакомиться с влиянием концентрации реагентов на химическое равновесие.
Ход работы:
Опыт 1 - Влияние концентрации тиосульфата натрия на скорость его разложения в кислой среде.
В сухие пробирки был внесен тиосульфат натрия и вода и перемешан (Таблица №1). В первые три пробирки добавил одну каплю серной кислоты, четвертая была оставлена, как контрольная. С помощью секундомера засек время реакции - от момента добавления кислоты до появления явной мути за счет образующейся серы - по сравнению с контрольной пробиркой №4.
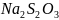 +
+
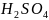 →
→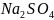 +
+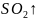 + S↓ +
+ S↓ +

Таблица 1
Номер пробирки
|
Число капель |
|||
|
|
|
Всего |
|
1 |
6 |
7 |
0 |
13 |
2 |
4 |
8 |
1 |
13 |
3 |
8 |
4 |
1 |
13 |
4 |
12 |
0 |
1 |
13 |
Таблица 2
Номер пробирки |
С( ) |
Время реакции τ, с |
2 |
1 |
180 |
3 |
2 |
100 |
4 |
3 |
70 |
Таблица 3
Номер пробирки |
С( ) |
ln |
Время реакции τ, с |
Скорость
реакции
|
2 |
1 |
0 |
180 |
0,006 |
3 |
2 |
0,693 |
100 |
0,01 |
4 |
3 |
1,10 |
70 |
0,014 |
Вывод по опыту 1: Скоростью реакции: чем больше тиосульфата в растворе, тем быстрее протекает реакция. Опыт показал, что есть зависимость между концентрацией тиосульфата натрия и скоростью реакции.
Опыт 2 - Влияние температуры на скорость реакции разложения тиосульфата натрия в кислой среде.
В одну пробирку было налито 10 капель н. раствора тиосульфата натрия, в другую - 10 капель 2н. раствора серной кислоты. Обе пробирки были помещены в химический стакан (термостат). Через 1,5 мин. кислоту быстро вылил в раствор тиосульфата натрия. Одновременно был включен секундомер и замечено время от начала реакции (слияния раствора и кислоты) до появления белой мути серы в пробирке.
Опыт был проведен еще дважды с повышением температуры на 10 К каждый раз соответственно.
Таблица 4
Номер пробирки |
Температура, ̊С |
Время реакции τ, с |
1 |
30 |
43 |
2 |
39 |
35 |
3 |
50 |
27 |
Таблица 5
№ п/п |
Температура Т, ̊К |
Время реакции τ, с |
Скорость реакции =1/τ, |
γ |
|
1 |
303 |
43 |
0,023 |
1,8 |
45,71 |
2 |
312 |
35 |
0,029 |
||
1,67 |
42,846 |
||||
3 |
323 |
27 |
0,037 |
Значение
температурного коэффициента (коэффициента
Вант-Гоффа) найдем по формуле
 =
=
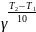 :
:
1).
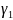 =
=
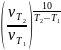 =
1,26 2).
=
1,26 2).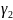 =
=
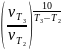 =
1,28 3).
=
1,28 3).
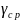 =
=
Значение
энергии активации найдем по формуле
 =
=
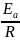 ·
·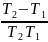 :
:
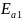 =
=
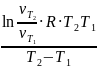 =20233 Дж/моль = 23,23 кДж/моль
=20233 Дж/моль = 23,23 кДж/моль
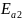 =
=
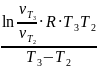 = 18547 Дж/моль = 18,55 кДж/моль
= 18547 Дж/моль = 18,55 кДж/моль

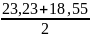 =
20,89 кДж/моль
=
20,89 кДж/моль
Вывод по опыту 2: Температура, при которой протекает реакция влияет на скорость реакции: чем выше температура, тем быстрее протекает реакция.
Опыт 3 - Влияние поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе.
Две порции мела помещены в пробирки. Одна целиком, вторая в виде порошка. В обе пробирки одновременно было добавлено 10 капель концентрированной соляной кислоты.
Ca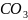 + 2HCl = Ca
+ 2HCl = Ca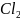 +
+
+
+
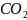 ↑
↑
Таблица 6
Номер пробирки |
Состав системы |
Время τ, с |
1 |
Мел кусочком + HCl |
240 |
2 |
Мел в порошке + HCl |
60 |
Вывод по опыту 3: Скорость растворения мела в этих двух случаях различна, так как площадь взаимодействия кислоты с веществом в порошковом состоянии больше, чем в состоянии, когда мел является кусочком.
Опыт 4 - Влияние катализатора на скорость реакции.
В двух пробирках нахоидтся по 10 капель 0,5 н. раствора роданида аммония и по 1 капле 0,5 н. раствора хлорида железа (III). В одну из пробирок была добавлена 1 капля 1 н. раствора сульфата меди, а затем в обе пробирки было добавлено по 10 капель тиосульфата натрия.
Fe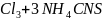 = Fe
= Fe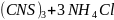
Таблица 7
Номер пробирки |
Состав системы |
Время τ, с |
1 |
10
капель
1
капля Fe |
60 |
2 |
10 капель , 0,5 н. 1 капля Fe , 0,5 н. 1
капля Cu |
10 |
Вывод по опыту 4: Катализатор (в данном случае это Cu ) увеличивает скорость протекания реакции.
Опыт 5 - Влияние концентрации реагентов на равновесие обратимой реакции между хлоридом железа (III) и тиоцианатом аммония.
В четыре пробирки было налито равное
число капель 0,0025 н. растворов хлорида
железа (III) и тиоцианата
аммония. Первая пробирка - контрольная,
оставлена без изменений, во вторую было
добавлено несколько капель концентрированного
раствора Fe в третью было добавлено несколько капель
концентрированного раствора
;
в четвертую на кончике шпателя был
добавлен кристаллический хлорид аммония,
после чего содержимое пробирки взболтал.
в третью было добавлено несколько капель
концентрированного раствора
;
в четвертую на кончике шпателя был
добавлен кристаллический хлорид аммония,
после чего содержимое пробирки взболтал.
Fe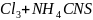 = Fe
= Fe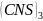 + 3
+ 3
Таблица 8
Номер пробирки |
Состав системы |
Добавленный реактив |
Наблюдения |
1 |
капель 0,0025 н. Fe капель 0,0025 н. |
Нет |
Изменений не произошло, цвет красный. |
2 |
Fe |
Потемнение раствора, смещение равновесия идет в сторону добавленного вещества. |
|
3 |
|
Большее потемнение раствора, смещение равновесия идет в сторону добавленного вещества. |
|
4 |
|
Осветление раствора, смещение равновесия идет в сторону исходных веществ. |
Вывод по опыту 5: Концентрация реагирующих веществ влияет на химическое равновесие: при увеличении концентрации реагентов химическое равновесие смещается в сторону добавленных веществ, а также в сторону веществ, взаимодействующих в реакции при увеличении концентрации продуктов реакции.
Вывод: проделав данный опыт, я ознакомился с влиянием концентрации реагентов на химическое равновесие и зависимостью между скоростью протекания реакции и температурой, концентрацией реагентов.

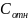 =
ln
=
ln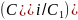
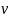 =1/τ,
=1/τ,
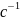
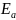 ,
кДж/моль
,
кДж/моль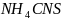 ,
0,5 н.
,
0,5 н.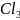 ,
0,5 н.
,
0,5 н.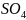 ,
1 н.
,
1 н.