
lab_po_fizike_12
.docПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО науки и высшего образования РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение
высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра физики
Отчет по лабораторной работе №12
По дисциплине физика
(наименование учебной дисциплины согласно учебному плану)
Тема: исследование эффекта Джоуля-Томсона при адиабатическом истечении газа
Автор: студент гр. СПС-18 ______________ Першин М. К.
(подпись) (Ф.И.О.)
ОЦЕНКА: _____________
Дата: 21 февраля 2019 г.
ПРОВЕРИЛ _доцент _____________ / Ломакина Е. С./
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2019 год
Цель работы: определить изменение температуры углекислого газа при протекании через малопроницаемую перегородку при разных начальных значениях давления и температуры; вычислить коэффициенты Ван-дер-Ваальса a и b по результатам эксперимента.
Явление изучаемый в работе – эффект Джоуля-Томсона
Определения:
Адиабатическое расширение – процесс расширения газа, при котором не происходит теплообмен с окружающей средой.
Теплообмен – процесс передачи тепла от более горячего тела к более холодному.
Реальный газ – газ, между молекулами которого действуют силы межмолекулярного взаимодействия, состоящие из сил притяжения и сил отталкивания.
Фазовые переходы – термодинамические процессы, приводящие к изменению агрегатного состояния вещества.
Законы и соотношения:
Уравнение
Менделеева-Клайперона –
формула зависимости между давлением,
молярным объёмом и абсолютной температурой
идеального газа.
![]()
Уравнение
Ван-дер-Ваальса
– формула зависимости между давлением,
молярным объёмом и абсолютной температурой
реального газа
![]()
Схема установки
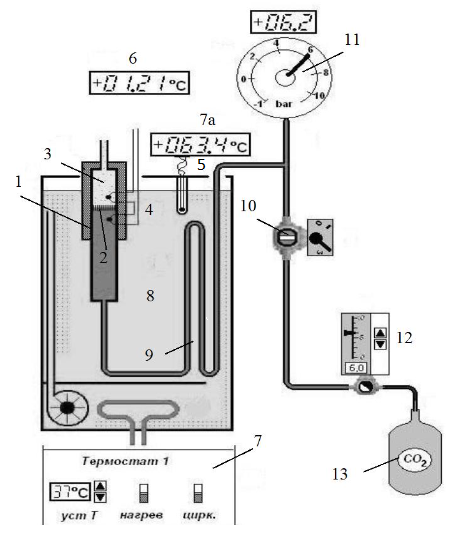
Рисунок 1 – Схема установки
1-трубка
2-пористая перегородка
8-термостатический объём
9-змеевик
5-термопара
7а-индикатор пульта 7
4-дифференциальная термопара
6-индикатор
13-баллон
12-редуктор
10-кран
11-манометр
Основные расчетные формулы
Формула температуры инверсии
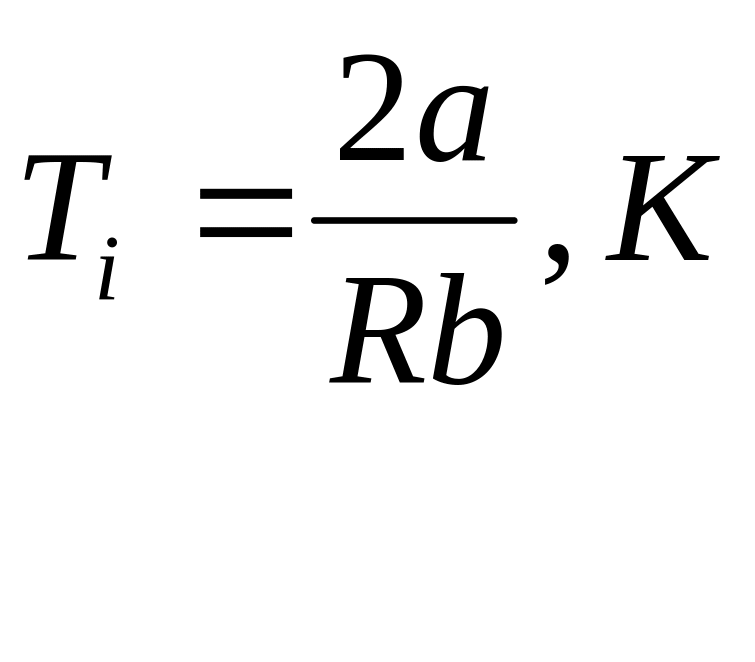
R-молярная
газовая постоянная [R]=![]()
а и b – постоянные
Ван-дер-Ваальса [a]=![]() ,
[b]=
,
[b]=![]()
Формула критической температуры
![]()
Формула коэффициента Джоуля-Томсона
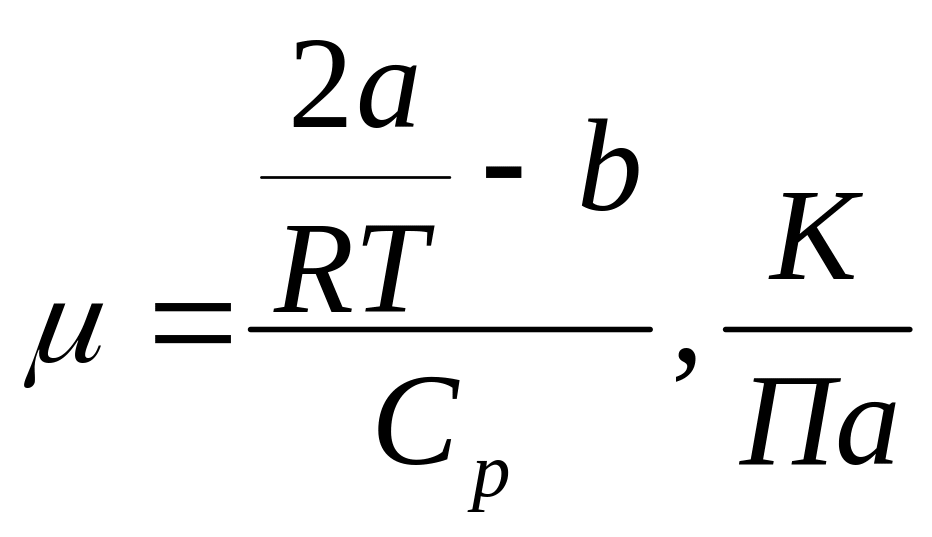
[Cp]=
Погрешность прямых измерений
Δp=0,05Мпа
ΔT=1оС
ΔΔT=0,01oC
Исходные данные
Углекислый газ
Таблица 1 – Результаты измерений и вычислений
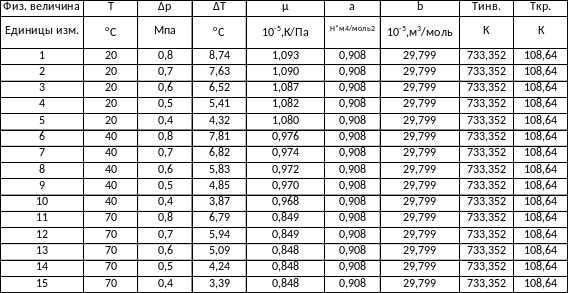 20оС=293
К
20оС=293
К
40оС=313 К
70оС=343 К
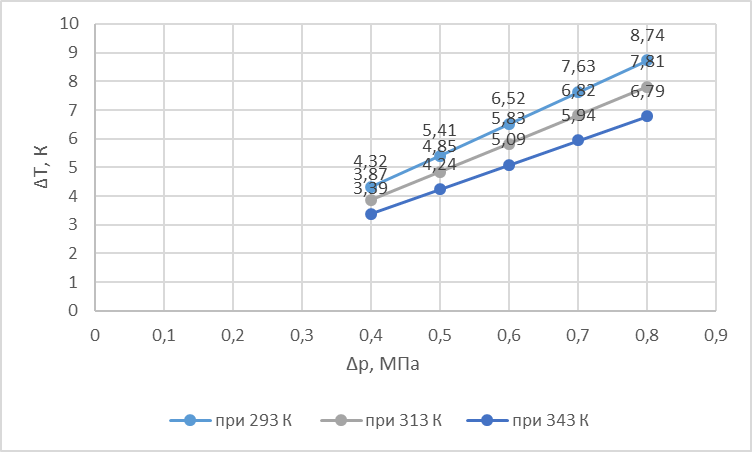
Зависимость прямая. Знак эффекта положительный, так как разность температур до и после пористой перегородки ниже нуля.
По углу наклона прямой
-при T=293K,
µ=tg(a)=1,105⸱10-5
![]()
-при Т=313К, µ=0,985⸱10-5
-при Т=343К, µ=0,85⸱10-5
Пример вычисления:
µ=![]()
например, µ1=![]()
Используя формулу
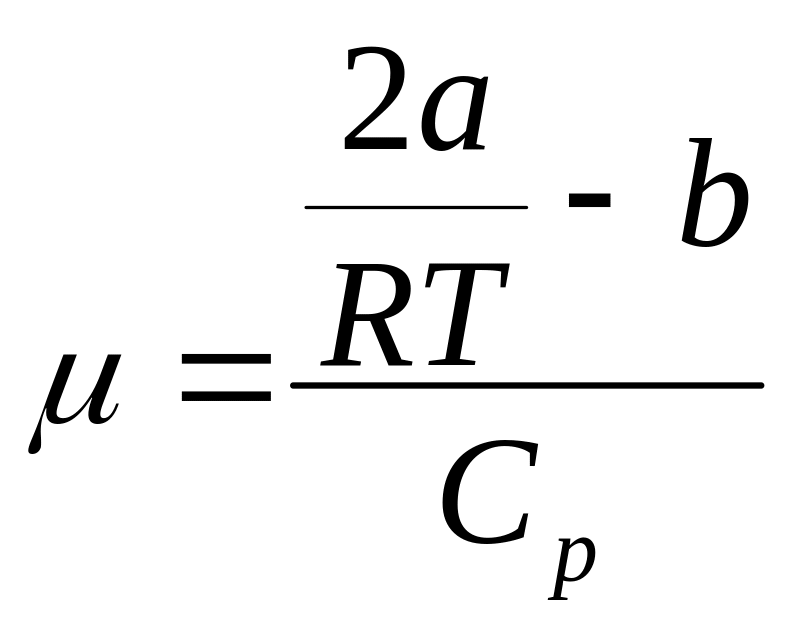 и экспериментальные данные, полученные
при трех значениях температуры, определяем
постоянные a
и b для
углекислого газа по двум парам температур:
Т1,
ΔТ1
и Т2, ΔТ2.
и экспериментальные данные, полученные
при трех значениях температуры, определяем
постоянные a
и b для
углекислого газа по двум парам температур:
Т1,
ΔТ1
и Т2, ΔТ2.
T1=293 K, T2=313 K, ΔT1=8,74 K, ΔT2=7,81 K, R=8,31 , Cp=41 , Δp=8⸱105Па.
![]()
![]()
![]()
![]()
Погрешность косвенных измерений:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Окончательные результаты:
a=0,908±0,236
b=29,799⸱10-5±165,057⸱10-5
Ti=733,352±4253,440 K
Tk=108,640±630,112 K
Вывод:
Выполнив лабораторную работу на исследование эффекта Джоуля-Томсона при адиабатическом истечении углекичлового газа, эксперементально определил коэффициенты Ван-дер-Ваальса.
Сравнив полученные результаты с табличными видно, что:
- коэффициент a отличается
от табличного значения на
![]()
-коэффициент b – на 596%
-Ti
на 64% меньше Тi
=
![]() Тк табл
Тк табл
-Tk на 64% меньше табличного значения
Из этого следует, что в данной лабораторной работе нельзя точно определить данные величины. Причина этому-погрешность измерительных приборов.
