
инфекция и иммунитет / Реакция связывания комплемента(теория)
.pdfРЕАКЦИЯ ЛИЗИСА И ГЕМОЛИЗА. РЕАКЦИЯ СВЯЗЫВАНИЯ КОМПЛЕМЕНТА. РЕАКЦИЯ ПРЕЦИПИТАЦИИ. ИММУНОЭЛЕКТРОФОРЕЗ. МЕТОДЫ ОЦЕНКИ ИММУННОГО СТАТУСА ОРГАНИЗМА.
Теория занятия
Реакции лизиса
Иммунный лизис - процесс растворения клеток с помощью специфических Ат (лизинов) в присутствии комплемента. Его вариантами являются бактериолиз и гемолиз.
Бактериолиз – лизис бактериальных клеток под действием бактериолизинов.
Гемолиз – процесс разрушения эритроцитов под действием гемолизинов. В результате происходит выход гемоглобина и жидкость в пробирке интенсивно окрашивается в красный цвет («лаковая кровь»).
Для реакции гемолиза используют:
1)взвесь эритроцитов барана;
2)гемолитическую сыворотку, полученную из крови кролика, иммунизированного эритроцитами барана;
3)комплемент – сыворотку морской свинки.
Реакция бактериолиза широкого распространения не получила, т.к. большинство бактерий устойчивы к лизису (чувствительны только спирохеты и холерные вибрионы).
Явление гемолиза используется как индикатор в реакции связывания комплемента и для определения титра комплемента исследуемых сывороток.
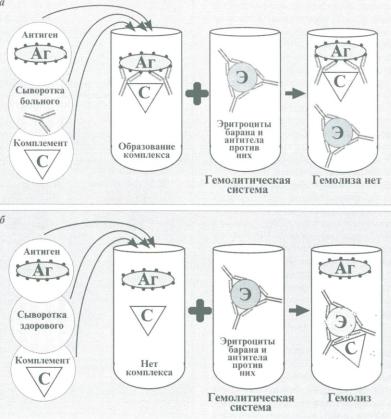
Реакция связывания комплемента (РСК)
РСК основана на связывании комплемента со специфическим комплексом антигенантитело. Это сложная двухэтапная серологическая реакция, в ней участвуют 5 компонентов, входящих в состав двух конкурирующих за комплемент систем: антиген, антитело, комплемент (первая, специфическая система); эритроциты и гемолитическая сыворотка (вторая, индикаторная гемолитическая система).
Комплемент получают из свежей сыворотки морской свинки или используют сухой комплемент, который разводят физиологическим раствором.
Антигены изготавливают из убитых микроорганизмов, их лизатов, экстрактов тканевых липидов.
На первом этапе готовят две системы в разных пробирках.
Если в специфической системе АГ и АТ соответствуют друг другу, они образуют комплекс, который адсорбирует комплемент. Образовавшийся комплекс мелкодисперсный и визуально не выявляется.
Вторая система (гемолитическая) служит для выявления этого комплекса. В этой системе лизис эритроцитов может произойти только в присутствии комплемента.
Все компоненты реакции берутся строго определенных соотношениях и количествах. Обе системы инкубируют в термостате 30 мин или 18-20 часов в холодильнике.
На втором этапе реакции гемолитическую систему добавляют к специфической. После инкубации в термостате в течение 30 мин учитывают результат.
При положительной РСК антитела сыворотки, соединившиеся с антигеном, образуют иммунный комплекс, который связывает комплемент и гемолиза не происходит (в пробирке осадок эритроцитов в виде «пуговки»).
РСК отрицательная – в случае отсутствия специфичности антител к антигену, при этом иммунный комплекс не образуется, комплемент остается свободным и вызывает лизис эритроцитов (в пробирке «лаковая кровь»).
Также, как и другие серологические реакции, РСК проводят для серодиагностики и сероидентификации. Наибольшее применение она имеет в диагностике вирусных инфекций
(гриппа, парагриппа, паротита, кори, краснухи, аденовирусной инфекции, и т.д.), сифилиса (реакция Вассермана), хронической формы гонореи (реакция Борде-Жангу), коклюша, лептоспироза, риккетсиозов, токсоплазмоза, бруцеллеза, листериоза,
Рис.1. Схема реакции связывания комплемента с сывороткой крови больного (а) и здорового (б)
микоплазменной пневмонии. Это объясняется высокой чувствительностью и специфичностью метода.
Реакция преципитации (РП)
РП – это иммунная реакция взаимодействия растворимого прозрачного АГ (преципитиногена) и специфических АТ (преципитинов) в присутствии электролита, приводящая к формированию иммунного комплекса, что проявляется образованием непрозрачного преципитата.
Существуют различные способы постановки РП:
•реакция кольцепреципитации;
•реакция в геле двойной иммунодиффузии по Оухтерлони;
•реакция в геле радиальной иммунодиффузии по Манчини;
•иммуноэлектрофорез.
РП в пробирках
Реакцию кольцепреципитации ставят в пробирках. АГ в этой реакции определяют при помощи неразведенной преципитирующей сыворотки, которую получают длительной гипериммунизацией кроликов. Эта реакция происходит в жидкой среде. Результат положительной реакции – образование в течение нескольких минут белого кольца преципитата на границе двух жидкостей.
Если в качестве антигенов в РП используют прокипяченные и профильтрованные экстракты органов или тканей, лизаты бактериальных культур, то такая реакция называется реакцией термопреципитации (реакция Асколи).

Высокая чувствительность реакции позволяет выявить АГ в разведениях 1:100 000 и даже 1:1 000 000, т.е. в таких малых количествах, которые не обнаруживаются химическим путем.
Рис. 2. Схема реакции кольцепреципитации.
РП в пробирках применяют для диагностики сибирской язвы, чумы, туляремии, в судебной медицине (для определения видовой принадлежности крови, спермы), в санитарной практике (для установления фальсификации продуктов).
РП в геле (по Оухтерлони)
Эта реакция проводится в агаровом геле. В чашку Петри наливают тонкий слой агара, в котором вырезают лунки на определенном расстоянии друг от друга и заполняют их соответственно антигеном и сывороткой. Например, в центральную лунку наливают известную сыворотку, а в периферические – определяемые антигены. Если антиген соответствует сыворотке, то в толще агара в результате иммунодиффузии между этими лунками образуются линии преципитата.
РП в геле (РПГ) используют: для определения неизвестных АГ и АТ в диагностике вирусных и бактериальных заболеваний; выявления токсигенных штаммов бактерий.
РПГ является точным методом диагностики полиомиелита, менингококковой инфекции, дифтерии, столбняка, газовой гангрены и других клостридиозов, трипаносомоза.
РП в геле радиальной иммунодиффузии (по Манчини)
Используется для определения концентрации иммуноглобулинов разных классов в сыворотке крови, компонентов комплемента и др. .
Рис. 3. Схема реакции радиальной иммунодиффузии по Манчини
В расплавленный агаровый гель добавляют иммунную сыворотку (например, антиглобулиновую сыворотку против иммуноглобулинов определенного класса) и наливают гель равномерным слоем на стекло. В застывшем геле вырезают лунки, в которые вносят антиген (например, исследуемую сыворотку с неизвестной концентрацией определяемого иммуноглобулина). В результате диффузии антигена и взаимодействии его с антителами в геле вокруг лунок образуются кольца преципитата. Диаметр кольца преципитации прямо пропорционален концентрации антител.
Иммуноэлектрофорез
Метод основан на предварительном электрофоретическом разделении смеси антигенов в геле с последующей их преципитацией антителами иммунной сыворотки, которую вносят в канавку, идущую вдоль направления движения белков. Антигены и антитела диффундируют навстречу друг другу и в месте встречи, при соответствии, образуют дуги преципитации.
Иммуноэлектрофорез позволяет выявлять и идентифицировать отдельные антигены в многокомпонентной системе.
Методы оценки иммунного статуса
Иммунный статус – это структурное и функциональное состояние иммунной системы индивидуума, определяемое комплексом клинических и лабораторных иммунологических показателей.
Таким образом, иммунный статус характеризует способность организма к иммунному ответу на определенный антиген в данный момент времени.
На иммунный статус влияют: возраст, биоритмы, социальные, экологические, климатогеографические и «медицинские» факторы. Несмотря на вариабельность иммунологических показателей в норме и влияние на них разнообразных факторов, иммунный статус можно объективно оценить путем постановки комплекса лабораторных тестов.
Оценка иммунного статуса включает количественную и качественную оценку основных факторов неспецифической защиты (фагоцитов, системы комплемента, естественных киллеров и др.), гуморального (В-система) и клеточного (Т-система) иммунитета.
Диагностику иммунологических расстройств начинают с анализа лейкограммы, результаты которой могут свидетельствать о патологических процессах, сопровождающихся иммунологической недостаточностью.
Например, лимфоцитарный лейкоцитоз наблюдается в последней стадии воспалительных заболеваний, при хронической лучевой болезни, коклюше, вирусных инфекциях. Нейтрофильный лейкоцитоз – свидетельство острых инфекционных и хронических заболеваний, острой кровопотери и др. Эозинофиллия (более 5%) наблюдается при аллергических заболеваниях, в разгар инфекционных заболеваний.
На следующем этапе оценивается иммунограмма для определения характера иммунологических расстройств.
Некоторые иммунологические тесты сложны для исполнения, требуют дорогостоящих реагентов и лабораторного оборудования, а также высокой квалификации персонала. Поэтому по рекомендации Р.В. Петрова все тесты разделены на 1-й и 2-й уровни.
К тестам 1-го уровня отнесены основные показатели состояния иммунной системы, они служат для первичного выявления лиц с иммунопатологией. Тесты 2-го уровня служат для более точной диагностики выявленных отклонений в состоянии иммунной системы.
Тесты для оценки ИС
Тесты 1-го уровня (ориентирующие):
*Определение количества лимфоцитов в периферической крови (абс.,%)
*Определение количества Т- и В-лимфоцитов (абс.,%)
*Определение основных классов сывороточных иммуноглобулинов (IgG, IgA, IgM)
*Оценка фагоцитарной активности нейтрофиллов
* Определение титра комплемента После анализа результатов тестов 1-го уровня определяют тактику дальнейшего
исследования. Тесты 2-го уровня (аналитические) ставят уже избирательно. Они могут включать:
*Определение субпопуляций Т- и В-лимфоцитов (Тх, Тс)
*Определение функциональной активности Т- и В-лимфоцитов в реакции бласттрансформации лимфоцитов (РБТЛ)
*Определение специфических IgE
*Определение циркулирующих иммунных комплексов (ЦИК)
*Определение компонентов комплемента
*Определение синтеза и секреции цитокинов и т.д.
Для оценки состояния факторов неспецифической резистентности определяют состояние системы фагоцитоза и комплемента.
Для оценки состояния клеточного звена иммунитета определяют количество Т-
лимфоцитов, их субпопуляций, бласттрансформацию Т-лимфоцитов под действием Т- клеточных митогенов, уровень цитокинов, содержание гормонов тимуса, ставят кожные пробы с аллергенами (например, пробу Манту с туберкулином).
Число Т-лимфоцитов и их субпопуляций определяют методом спонтанного розеткообразования с эритроцитами барана (Е-РОК), иммунофлюоресцентным методом (ИФМ) с помощью моноклональных антител, методом проточной цитометрии.
Для оценки функциональной активности Т-лимфоцитов используют реакцию бласттрансформации лимфоцитов (РБТЛ).
Для изучения гуморального звена иммунитета определяют содержание основных классов иммуноглобулинов в сыворотке, количество В-лимфоцитов в периферической крови, их бласттрансформацию под действием В-клеточных митогенов, титры специфических антител.
Для определения числа В-лимфоцитов в периферической крови используют кластерный анализ (выявление специфических СD-рецепторов с помощью моноклональных антител иммунофлюоресцентным методом), метод спонтанного розеткообразования с эритроцитами мыши (М-РОК), проточную цитометрию. Реакции основаны на определении на поверхности этих лимфоидных клеток рецепторов, характерных только для них. Характерной особенностью В-лимфоцитов является наличие на их поверхности Ig рецепторов, рецепторов к комплементу (С3) и эритроцитам мыши.
Функциональную активность В-лимфоцитов определяют в РБТЛ на ЛПС Гр- бактерий. Для определения концентрации иммуноглобулинов разных классов в сыворотке крови,
компонентов комплемента и др. используется РП в геле методом радиальной иммунодиффузии (по Манчини) и иммуноферментный анализ (ИФА).
Наличие специфических антител и их уровень определяют с помощью серологических реакций ( классических: РА, РНГА, РСК, РП,РТГА и др.; современных серологических реакций с меткой).
Реакции с использованием меченых антител или антигенов
К современным специфическим методам относятся серологические реакции с меткой. Все эти реакции основаны на специфическом взаимодействии антигенов и гомологичных им антител. Образующийся при этом иммунный комплекс выявляется с помощью особой метки, соединенной с антигеном или антителом. Современные реакции высокочувствительны, могут регистрироваться специальными приборами, протекают быстрее (экспресс-методы) и качественнее.
Основные виды меток:
•светящиеся красители-флюорохромы; используются в реакции иммунофлюресценции (РИФ);
•ферменты; используются в реакции иммуноферментного анализа (ИФА);
•радиоактивные изотопы; используются в реакции радиоиммунного анализа (РИА)
•электронно-плотные белки; используются в иммуноэлектронной микроскопии. Реакции ставят в двух направлениях:
-для определения неизвестного антигена;
-для определения неизвестных антител.
Используют прямые и непрямые методы. Непрямой метод заключается в выявлении комплекса антиген-антитело с помощью антиглобулиновой (против антитела) сыворотки, имеющей метку.
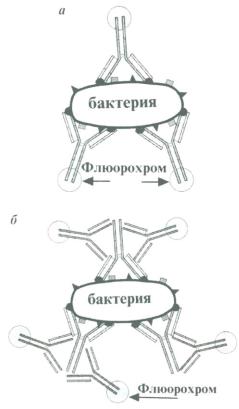
РИФ (метод Кунса)
В реакции используют люминесцентные сыворотки, антитела которых обработаны флюорохромом. Такие меченые АТ называют конъюгатом. На практике используют флюорохромы, имеющие желтую, желто-зеленую и красную флюоресценцию в ультрафиолетовых лучах.
Различают три основные варианта метода: прямой, непрямой, с комплементом.
Прямой метод основан на применении специфических сывороток, АТ которых метятся флюорохромами. При взаимодействии таких АТ с соответствующими АГ образуется специфический светящийся комплекс, видимый в УФ-лучах люминесцентного микроскопа. Этот метод используют только для определения антигена, т.е. обнаружения бактерий в мазках и выявления вирусов в зараженных клетках.
Рис. 4. Схема реакции прямой (а) и непрямой (б) иммунофлюоресценции .
Чаще применяют непрямой метод (РНИФ). Для выявления неизвестного АГ в исследуемом материале готовят фиксированный мазок из антигена, обрабатывают его антимикробной кроличьей специфической сывороткой, промывают, а затем на этот препарат наносят антиглобулиновую (антикроличью) сыворотку, меченую флюорохромом. Образуемый в результате комплекс имеет свечение в люминесцентном микроскопе, как при прямом методе. Непрямой метод используют также для выявления специфических АТ в исследуемой сыворотке. В этом случае применяют антиглобулиновую сыворотку против Ig человека.
Определение специфических АТ с помощью РНИФ широко применяется для диагностики заболеваний, передающихся половым путем, является основным методом диагностики геморрагической лихорадки с почечным синдромом.
Антикомплементарная РИФ предполагает применение меченых антител против комплемента морской свинки. Используется только в тех случаях, когда комплекс антигенантитело способен фиксировать комплемент. При добавлении к такой системе антикомплементарной меченой сыворотки также наблюдается специфическое свечение образовавшегося комплекса в люминесцентном микроскопе.
РИФ применяют в качестве экспресс-диагностики: гриппа, парагриппа, аденовирусной, ротавирусной, коронавирусной, герпесвирусной инфекций, паротита, кори, бешенства, сифилиса, гонореи, дизентерии, брюшного тифа, сальмонеллеза,холеры, бруцеллеза, чумы, сибирской язвы, туляремии, микоплазмоза и других инфекционных заболеваний.
Иммуноферментный метод, или анализ (ИФА)
ИФА основан на реакции АГ-АТ с применением конъюгатов, состоящих из АТ, меченых ферментом (пероксидазой, щелочной фосфатазой и др.). Используется для выявления АГ и АТ.
Иммуноферментный метод проводят в два этапа. На первом происходит взаимодействие АТ с АГ, на втором – ферментативная индикация образовавшегося комплекса.
Основными достоинствами этого метода являются:
•высокая чувствительность, позволяющая определять вещества в минорных концентрациях: 10-10 – 10-12 г/л;
•доступность для обычных диагностических лабораторий (экспрессивность и автоматизация этапов реакции);
•возможность использования минимальных объемов исследуемого материала (1-2 мкл). Существуют разные модификации этого метода: прямой, непрямой, жидкофазный,
твердофазный, конкурентный.
Наиболее распространен твердофазный ИФА, когда один из компонентов иммунной реакции (АГ или АТ) сорбирован на твердом носителе, например в лунках микропанелей из полистирола. При определении АТ в сыворотке больных в лунки с адсорбированным на дне антигеном последовательно добавляют сыворотку больного, затем антиглобулиновую сыворотку, меченую ферментом, и смесь растворов субстрата для фермента и индикатор. Каждый раз после добавления очередного компонента из лунок удаляют несвязавшиеся реагенты путем промывания. При наличии в сыворотке больного АТ образуется комплекс АГАТ, который выявляется с помощью антиглобулиновой меченой сыворотки. АТ этой сыворотки присоединяются к комплексу, при этом активизируется фермент, расщепляющий субстрат и меняется цвет среды в лунке, что свидетельствует о положительной реакции. Изменение цвета в лунках оценивается визуально и с помощью спектрофотометра: увеличение интенсивности окраски пропорционально количеству сорбированных на антигене специфических антител.
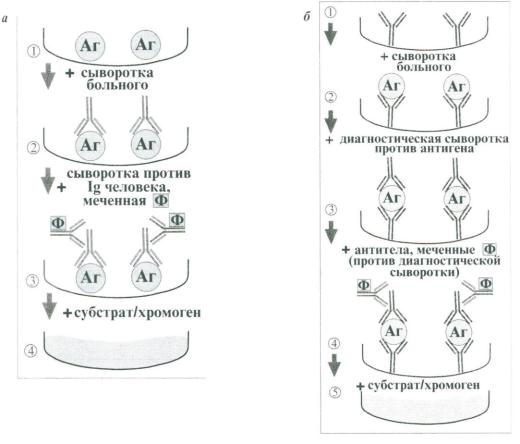
Рис. 5. Схема твердофазного иммуноферментного анализа:
а – определение антител больного в лунках планшетов с адсорбированным антигеном;
б – определение антигена в лунках планшетов с адсорбированными диагностическими антителами *
ИФА является одним из наиболее распространенных специфических методов диагностики многих инфекционных заболеваний бактериальной, грибковой, протозойной этиологии и, особенно вирусной. В частности его применяют для диагностики ВИЧ-инфекции, гепатитов А,В,С,D,E,G, респираторных, герпесвирусных и других инфекций, а также для определения гормонов, ферментов и других биологически активных веществ, содержащихся в исследуемом материале.
Иммуноблотинг (ИБ)
В практической диагностике вирусных инфекций иногда существует необходимость определять спектр специфических АТ. Для этого используют иммуноблотинг (от анл. blot – пятно) – высокочувствительный метод, сочетающий электрофорез и ИФА. Принцип этого метода основан на выявлении АТ к отдельным АГ возбудителя. ИБ используется как диагностический метод при ВИЧ-инфекции.
Антиген возбудителя разделяют на белковые фракции с помощью электрофореза в полиакриламидном геле, затем переносят из геля на активированную бумагу или нитроцеллюлозную мембрану и проявляют с помощью ИФА. В настоящее время эту процедуру не проводят, а используют коммерческие тест-системы – фирменные полоски с готовыми к исследованию «блотами» АГ. На эти полоски (стрипы) наносят сыворотку больного. Затем, после инкубации, отмывают от несвязавшихся АТ и наносят антиглобулиновую (против Ig человека) сыворотку, меченую ферментом. Образовавшийся на полоске специфический комплекс выявляют добавлением хромогена (субстрата для фермента). При этом в местах соответствия АГ-АТ образуются пятна, что соответствует
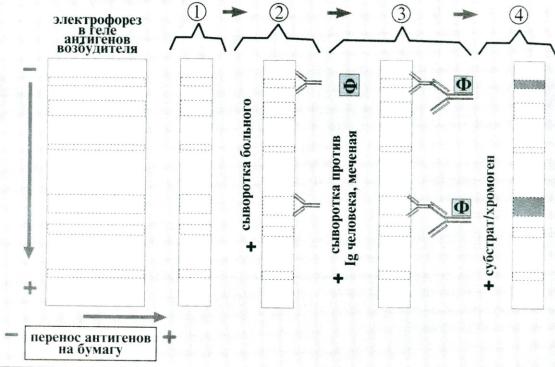
Рис. 6. Схема иммуноблотинга
обнаружению специфических АТ. Результаты ИБ оценивают как положительные, сомнительные и отрицательные в зависимости от количественного и качественного набора выявленных антител.
Иммуноблотинг используют при герпесвирусной инфекции, вирусных гепатитах и других инфекциях.
Радиоиммунный анализ (РИА)
Это высокочувствительный метод, основанный на реакции АГ-АТ с применением АГ или АТ, меченых изотопной меткой (125J, 14C, 3H и др.). После их взаимодействия отделяют образовавшийся комплекс и определяют его радиоактивность в счетчиках импульсов. Интенсивность излучения прямо пропорциональна количеству связавшихся молекул АГ и АТ.
Используют несколько вариантов метода: прямой, непрямой, твердофазный, конкурентный. Конкурентный метод РИА используют для выявления антигена гепатита В (HBV) у больных. Для этого к исследуемой сыворотке добавляют известную противовирусную сыворотку (анти-HBV). Смесь инкубируют 1-2 дня, затем добавляют HBV, меченый радиоактивным йодом, инкубируют ещё 1 сутки, затем вносят антиглобулиновую сыворотку к анти-HBV, что приводит к образованию преципитата. Образующийся при этом преципитат помещают в счетчик изотопов, и, поскольку он не содержит метки, изотопы не определяются. Диагноз в данном случае положительный. Если вируса в сыворотке нет, известная противовирусная сыворотка соединяется с вирусом гепатита В, меченым изотопом йода. Тогда в преципитате, образующимся под действием антиглобулиновой сыворотки, будет присутствовать радиоактивная метка, которую и выявляет счетчик. Диагноз в этом случае будет отрицательный.
РИА применяют для выявления микробных антигенов, гормонов, ферментов и др. Чувствительность метода 10-10 ─ 10-12 г/л. Метод используется ограниченно в связи с экологической опасностью.
