
инфекция и иммунитет / РСК (практика)
.pdf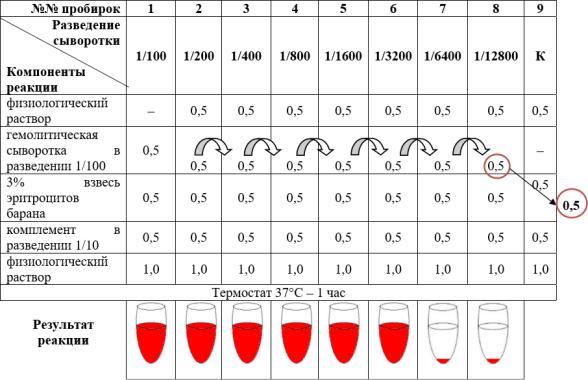
РЕАКЦИЯ ЛИЗИСА И ГЕМОЛИЗА. РЕАКЦИЯ СВЯЗЫВАНИЯ КОМПЛЕМЕНТА. РЕАКЦИЯ ПРЕЦИПИТАЦИИ. ИММУНОЭЛЕКТРОФОРЕЗ. МЕТОДЫ ОЦЕНКИ ИММУННОГО СТАТУСА ОРГАНИЗМА.
Практическая часть
Иммунный лизис – процесс растворения микробных клеток с помощью специфических Ат (лизинов) в присутствии комплемента. Его вариантами являются бактериолиз и гемолиз.
Бактериолиз – лизис бактериальных клеток под действием бактериолизинов. Гемолиз – процесс разрушения эритроцитов под действием гемолизинов. Реакция бактериолиза широкого распространения не получила, т.к. большинство
бактерий устойчивы к лизису (чувствительны только спирохеты и холерные вибрионы). Явление гемолиза используется как индикатор в реакции связывания комплемента.
Реакция связывания комплемента (РСК)
РСК основана на связывании комплемента со специфическим комплексом антигенантитело. Это сложная двухэтапная серологическая реакция, в ней участвуют две системы и 5 компонентов: антиген, антитела, комплемент, эритроциты и гемолитическая сыворотка.
Приготовление и титрование ингредиентов для РСК
Гемолитическая сыворотка приготавливается в производственных институтах путем 3-4 кратной внутривенной иммунизации кроликов 50% взвесью бараньих эритроцитов. Полученную сыворотку инактивируют нагреванием при 56°С для инактивации собственного комплемента. На этикетке ампулы обозначен титр сыворотки – ее максимальное разведение, которое обеспечивает полный лизис 3% взвеси эритроцитов в присутствии комплемента при 37°С в течение часа.
Для РСК гемолитическую сыворотку берут в тройном титре, т.е. в таком разведении, в котором гемолизинов в три раза больше, чем в титре.
СХЕМА РЕАКЦИЙ ДЛЯ ОПРЕДЕЛЕНИЯ ТИТРА ГЕМОЛИТИЧЕСКОЙ СЫВОРОТКИ

Пример. Произведен учет реакции гемолиза, поставленной для определения титра гемолитической сыворотки. В разведениях сыворотки от 1/100 до 1/3200 наблюдается гемолиз, в разведениях 1/6400 и 1/12800 – задержка гемолиза, как в контрольной пробирке (К). Следовательно, титр гемолитической сыворотки равен 1/3200, её тройной титр будет равен
1/1067
Комплемент получают из свежей сыворотки морской свинки или используют сухой комплемент, который разводят физ. раствором. Титр комплемента определяют с помощью реакции гемолиза.
Титр комплемента – наименьшее его количество в мл, которое обеспечивает гемолиз при участии гемолитической сыворотки в тройном титре. В РСК комплемент берут в рабочей дозе, которая на 25% больше титра.
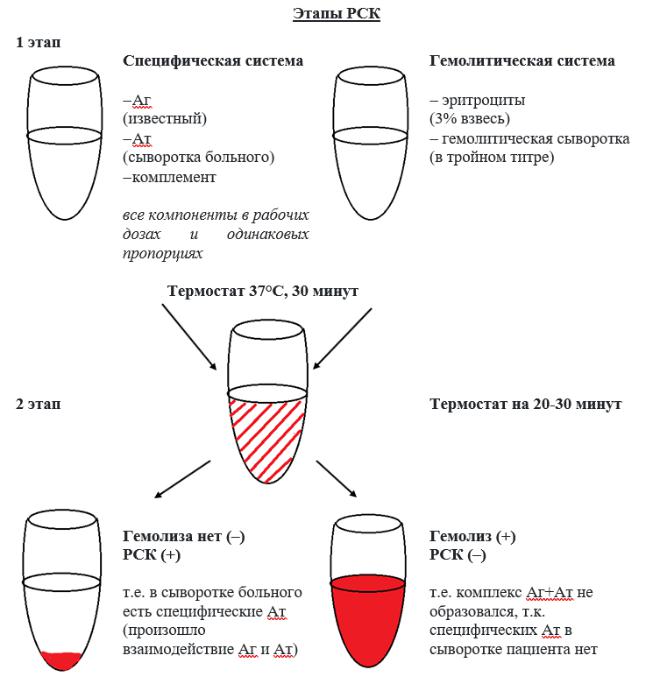
СХЕМА ПОСТАНОВКИ РЕАКЦИИ ДЛЯ ОПРЕДЕЛЕНИЯ ТИТРА КОМПЛЕМЕНТА
Примечание: гемолитическая система представляет собой смесь равных объемов гемолитической сыворотки в тройном титре и 3% взвеси эритроцитов барана в физиологическом растворе, выдержанную в термостате при 37°С
– 30 минут.
Пример. Произведен учет реакции гемолиза, поставленной для определения титра комплемента. Реакция положительная в пробирках № 1 – № 4 и отрицательная в пробирках № 5 и № 6 (контроль). Следовательно, титр комплемента равен 0,2 мл комплемента (разведенного 1/10), рабочая доза будет равна 0,25мл комплемента (в разведении 1/10).
Антигены изготавливают из убитых микроорганизмов, их лизатов, экстрактов тканевых липидов. Аг берут в рабочей дозе.
Взвесь эритроцитов барана получают из дефибринированной крови, отмывая эритроциты физ. раствором и готовят из них 3% взвесь.
Постановка основного опыта РСК
(для определения специфических антител в исследуемой сыворотке)
На первом этапе готовят две системы в разных пробирках.
Первая система (специфическая) состоит из микробного антигена и исследуемой сыворотки, в которой предполагается наличие антител. В неё вносят комплемент. При соответствии Аг и Ат они соединяются и связывают комплемент. Образовавшийся комплекс мелкодисперсный и визуально не выявляется.
Вторая система (гемолитическая, или индикаторная) служит для выявления этого комплекса. Она состоит из эритроцитов барана и соответствующей им гемолитической сыворотки. В этой системе лизис эритроцитов может произойти только в присутствии комплемента.
Все компоненты реакции берутся строго определенных соотношениях и количествах: по 0,5 мл и в рабочих дозах. Обе системы инкубируют в термостате 30 мин или 18-20 часов в холодильнике.
На втором этапе добавляют гемолитическую систему к специфической. Послеинкубации в термостате в течение 30 мин учитывают результат.
При положительной РСК антитела сыворотки, соединившиеся с антигеном, образуют иммунный комплекс, который связывает комплемент и гемолиза не происходит (в пробирке осадок эритроцитов в виде «пуговки»).
Если реакция отрицательная, т.е. антител в исследуемой сыворотке нет, комплемент остается свободным и вызовет гемолиз (в пробирке «лаковая кровь»).
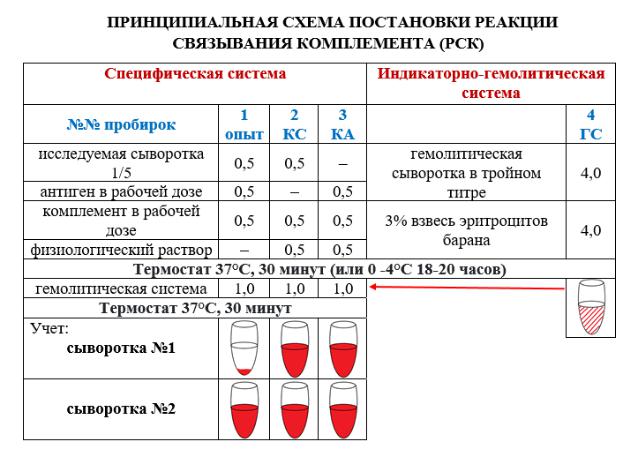
Пример. Произведен учет РСК, поставленной с сыворотками больных №1 и №2.
РСК с сывороткой №1 (+), т.к. в опытной пробирке задержка гемолиза, следовательно, комплемент связан в специфической системе комплексом Аг-Ат, что свидетельствует о присутствии в сыворотке специфических Ат и подтверждает диагноз заболевания.
РСК с сывороткой №2 (-), т.к. в опытной пробирке полный гемолиз, следовательно, комплемент не связан в специфической системе, а реализован в гемолитической, т.е. в исследуемой сыворотке нет специфических Ат и диагноз заболевания не подтверждается.
Применение РСК
Диагностика
•сифилиса (реакция Вассермана)
•хронической формы гонореи (реакция Борде-Жангу)
•вирусных инфекций (гриппа, парагриппа, аденовирусной инфекций и т.д.)
•сыпного тифа
•лихорадки Ку
•лептоспироза
•коклюша
•бруцеллеза и др. инфекций
Реакция преципитации (РП)
РП – это иммунная реакция взаимодействия растворимого прозрачного Аг (преципитиногена) и специфических Ат (преципитинов) в присутствии электролита, приводящая к формированию иммунного комплекса, что проявляется образованием непрозрачного преципитата.
Существуют различные способы постановки РП:
•реакция кольцепреципитации;
•реакция в геле двойной иммунодиффузии по Оухтерлони;
•реакция в геле радиальной иммунодиффузии по Манчини;
•иммуноэлектрофорез.

Постановка РП в пробирках
(реакция кольцепреципитации)
-в преципитационную пробирку наливают 0,5 мл преципитирующей сыворотки (сыворотка берется цельной).
-осторожно по стенке пробирки на иммунную сыворотку по капле наслаивают неизвестный растворенный Аг. Его берут в эквивалентном количестве, Аг должен быть прозрачным.
При положительной реакции через несколько минут на границе двух жидкостей образуется белое кольцо преципитата.
Если в качестве антигенов в РП используют прокипяченные и профильтрованные экстракты органов или тканей, то такая реакция называется реакцией термопреципитации (реакция Асколи).
Реакция кольцепреципитации служит для выявления неизвестного антигена по известнойсыворотке и позволяет уловить растворимый Аг в очень малых концентрациях. Титром преципитирующей сыворотки в такой реакции называется то наибольшее разведение Аг, которое еще улавливается в реакции преципитации.
Практическое применение РП в пробирках
•диагностика сибирской язвы
•диагностика чумы
•диагностика туляремии
•в судебной медицине (для определения видовой принадлежности крови, спермы)
•в санитарной практике (для установления фальсификации продуктов)
Постановка РП в геле (по Оухтерлони)
Эта реакция проводится в агаровом геле. В чашку Петри наливают тонкий слой агара, в котором вырезают лунки на определенном расстоянии друг от друга и заполняют их соответственно антигеном и сывороткой. Например, в центральную лунку наливают известную сыворотку, а в периферические – определяемые антигены. Если антиген соответствует сыворотке, то в толще агара в результате иммунодиффузии между этими лунками образуются линии преципитата.
Иммуноэлектрофорез
Принцип метода заключается в предварительном электрофоретическом разделении смеси антигенов. Затем в канавку, идущую вдоль направления движения белков, вносят преципитирующую сыворотку. Аг и Ат диффундируют в гель навстречу друг другу и, взаимодействуя, образуют дугообразные линии преципитации.
Практическое применение РП в геле
•определение неизвестных Аг и Ат в диагностике вирусных и бактериальных инфекционных заболеваний
•определение токсигенных штаммов (в диагностике дифтерии) и др.
Методы оценки иммунного статуса
Иммунный статус – это структурное и функциональное состояние иммунной системы индивидуума, определяемое комплексом клинических и лабораторных иммунологических показателей.
Оценка иммунного статуса включает количественную и качественную оценку основных факторов неспецифической защиты (фагоцитов, системы комплемента, естественных киллеров и др.), гуморального (В-система) и клеточного (Т-система) иммунитета.
Диагностику иммунологических расстройств начинают с анализа лейкограммы, результаты которой могут свидетельствать о патологических процессах, сопровождающихся иммунологической недостаточностью.
На следующем этапе оценивается иммунограмма для определения характера иммунологических расстройств.
Некоторые иммунологические тесты сложны для исполнения, требуют дорогостоящих реагентов и лабораторного оборудования, а также высокой квалификации персонала. Поэтому по рекомендации Р.В. Петрова все тесты разделены на 1-й и 2-й уровни.
К тестам 1-го уровня отнесены основные показатели состояния иммунной системы, они служат для первичного выявления лиц с иммунопатологией. Тесты 2-го уровня служат для более точной диагностики выявленных отклонений в состоянии иммунной системы.
Тесты для оценки ИС
Тесты 1-го уровня:
*Определение количества лимфоцитов в периферической крови (абс.,%)
*Определение количества Т- и В-лимфоцитов (абс.,%)
*Определение основных классов сывороточных иммуноглобулинов (IgG, IgA, IgM)
*Оценка фагоцитарной активности нейтрофиллов
*Определение титра комплемента
После анализа результатов тестов 1-го уровня определяют тактику дальнейшего исследования. Тесты 2-го уровня ставят уже избирательно. Они могут включать:
*Определение субпопуляций Т- и В-лимфоцитов (Тх, Тс)
*Определение функциональной активности Т- и В-лимфоцитов в реакции бласттрансформации лимфоцитов (РБТЛ)
*Определение специфических IgE
*Определение циркулирующих иммунных комплексов (ЦИК)
*Определение компонентов комплемента
*Определение синтеза и секреции цитокинов и т.д.
Для оценки состояния факторов неспецифической резистентности определяют состояние системы фагоцитоза и комплемента.
Количественную оценку фагоцитарной активности гранулоцитов и моноцитов проводят с использованием лейкоцитарной взвеси. Фагоцитирующие клетки смешивают с объектами фагоцитоза (частицы латокса, суспензия убитых нагреванием клеток бактерий) в соотношении 1:100 или 1:10. Инкубируют при 370 С при постоянном помешивании. Затем смесь центрифугируют и из осадка готовят мазок.
В мазке, окрашенном по Романовскому, подсчитывают: фагоцитарный показатель – процент фагоцитирующих клеток (норма 40-80%), фагоцитарное число – среднее количество поглощенных частиц на одну клетку (норма 1-5). В оценке фагоцитоза используют опсонофагоцитарный индекс-отношение фагоцитарных показателей, полученных с иммунной и неиммунной сывороткой. Должен быть в норме > 1.
Методы выделения лимфоцитов из периферической крови.
Лимфоциты из периферической крови выделяют методом градиентного центрифугирования. В качестве градиентов используют фиколл-верографин, верографин. Для этого венозную гепаринизированную кровь осторожно наслаивают на раствор градиента в силиконизированной посуде. Далее пробу подвергают цетрифугированию при определенном

режиме. В результате клетки крови разделяются на отдельные фракции.
Для оценки состояния клеточного звена иммунитета определяют количество Т- лимфоцитов, их субпопуляций, бласттрансформацию Т-лимфоцитов под действием Т- клеточных митогенов, уровень цитокинов, содержание гормонов тимуса, ставят кожные пробыс аллергенами (например, пробу Манту с туберкулином).
Число Т-лимфоцитов и их субпопуляций определяют методом спонтанного розеткообразования с эритроцитами барана (Е-РОК), иммунофлюоресцентным методом (ИФМ) с помощью моноклональных антител, методом проточной цитометрии.
Метод Е-РОК основан на наличии сродства между рецептором Т-лимфоцита и гликопротеинами мембраны эритроцита барана. При смешивании лимфоцитов и эритроцитов барана последние избирательно адсорбируются только Т-лимфоцитами, в результате чего образуются так называемые «Е-розетки». «Розеткой» считается лимфоцит, присоединивший не менее 3-х эритроцитов. Количество этих «розеток» соответствует количеству Т-лимфоцитов. У здоровых людей 40-70% Т-клеток от общего числа лимфоцитов. Абсолютное количество Т- лимфоцитов (АК) подсчитывают по формуле:
L х %Li х %Е-РОК
АК ═ —————————— , где:
104
L – абсолютное количество лейкоцитов,
Li – количество лимфоцитов в % (из гемограммы),
Норма: 0,7-1,4 × 109/л
Помимо определения количества Т-лимфоцитов и их субпопуляций, важное значение имеет соотношение регуляторных субпопуляций, т.е. хелперно-супрессорный индекс (СD4/СD8). Соотношение Т-хелперы/Т-супрессоры у здоровых людей составляет 1,8-2,2.
Определения соотношения Тх/Тс производят с помощью теофиллинового теста. В присутствии теофиллина Тс теряют способность к Е-розеткообразованию. Их называют теофиллинчувствительными. Тх являются теофиллинрезистентными и образуют Е-розетки.
Более точным методом для определения количества Т-лимфоцитов и их субпопуляций является ИФМ с применением меченых флюоресцином моноклональных антител меченых флюоресцином к антигенным детерминантам Т-лимфоцитов.
После совместной инкубации лимфоцитов с моноклональными антителами к специфическим СD3-рецепторам Т-лимфоцитов, готовят мазки, которые микроскопируют с помощью люминисцентного микроскопа. Обнаружение специфического свечения вокруг клеток
позволяет определить количество Т-лимфоцитов.
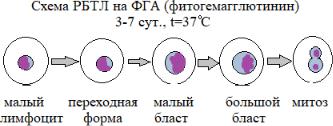
Для оценки функциональной активности Т-лимфоцитов используют реакцию бласттрансформации лимфоцитов (РБТЛ).
В основе РБТЛ лежит способность нормальных лимфоцитов периферической крови превращаться в недифференцированные зародышевые клетки типа бластов при культивировании их in vitro под действием специфических аллергенов и неспецифических стимуляторовмитогенов. Для активации Т-звена иммунитета используют митогены Кон-А, ФГА. Результаты учитываются через 48-72 часа. Чем больше бластных форм в мазках (окраска по РомановскомуГимза), тем выше функциональная активность Т-лимфоцитов. Норма: 4090%. Снижение показателей свидетельствует о патологии.
Для изучения гуморального звена иммунитета определяют содержание основных классов иммуноглобулинов в сыворотке, количество В-лимфоцитов в периферической крови, их бласттрансформацию под действием В-клеточных митогенов, титры специфических антител.
Для определения числа В-лимфоцитов в периферической крови используют кластерный анализ (выявление специфических СD-рецепторов с помощью моноклональных антител), метод спонтанного розеткообразования с эритроцитами мыши (М-РОК), проточную цитометрию. Реакции основаны на определении на поверхности этих лимфоидных клеток рецепторов,
характерных только для них. Характерной
особенностью В-лимфоцитов является наличие на их поверхности Ig рецепторов, рецепторов к комплементу (С3) и эритроцитам мыши.
Один из самых простых методов количественного учета В-лимфоцитов – метод спонтанного розеткообразования с эритроцитами мыши (М-РОК). При смешивании мышиных эритроцитов с лимфоцитами периферической крови человека эритроциты спонтанно присоединяются к поверхности В-клеток, в результате образуются розетки. Полученная смесь инкубируется в термостате, затем из нее готовится мазок и окрашивается по методу Романовского-Гимзы. В мазке подсчитывается количество розеток, что соответствует числу В- клеток в %.
Абсолютное количество В-лимфоцитов (АК) подсчитывают по формуле:
L х %Li х %М-РОК
АК ═ —————————— , где:
104
L – абсолютное количество лейкоцитов,
Li – количество лимфоцитов в % (из гемограммы),
Норма составляет 0,4 - 0,7 х 109/л.
Используется также ЕАС-РОК, которую ставят с эритроцитами быка, обработанными антиэритроцитарными антителами против них, а затем комплементом. Такие эритроциты адсорбируются избирательно на В-лимфоцитах, имеющих рецепторы к С3 фракции комплемента.
Более современным является ИФМ, в котором клетки идентифицируют с помощью моноклональных антител против соответствующих антигенных рецепторов В-лимфоцитов, выступающих в роли маркеров (CD-кластеры дифференциации). Все В-лимфоциты имеют
маркер CD19.
Функциональную активность В-лимфоцитов определяют в РБТЛ на ЛПС Гр- бактерий.
РП в геле методом радиальной иммунодиффузии (по Манчини)
Используется для определения концентрации иммуноглобулинов разных классов в сыворотке крови, компонентов комплемента и др. .
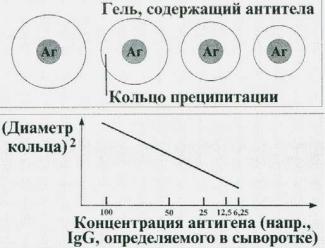
Рис. 6. Схема реакции радиальной иммунодиффузии по Манчини
В расплавленный агаровый гель добавляют иммунную сыворотку (например, антиглобулиновую сыворотку против иммуноглобулинов определенного класса) и наливают гель равномерным слоем на стекло. В застывшем геле вырезают лунки, в которые вносятантиген (например, исследуемую сыворотку с неизвестной концентрацией определяемого иммуноглобулина). В результате диффузии антигена и взаимодействии его с антителами в геле вокруг лунок образуются кольца преципитата. Диаметр кольца преципитации прямо пропорционален концентрации антител.
Показатели количества иммуноглобулинов разных классов для здоровых людей (г/л):
•Ig М – 0,65-1,65;
•IgG – 7,5-15,45;
•IgA – 1,25-2,5;
•IgD – 0-0,07;
•IgE – 0-0,0005.
Титр специфических антител определяют в серологических реакциях (описаны ранее).
Реакции с использованием меченых антител или антигенов
Ксовременным специфическим методам относятся серологические реакции с меткой. Все эти реакции основаны на специфическом взаимодействии антигенов и гомологичных им антител. Образующийся при этом иммунный комплекс выявляется с помощью особой метки, соединенной
сантигеном или антителом. Современные реакции высокочувствительны, могут регистрироваться специальными приборами, протекают быстрее (экспресс-методы) и качественнее.
Основные виды меток:
•светящиеся красители-флюорохромы; используются в реакции иммунофлюресценции
(РИФ);
•ферменты; используются в реакции иммуноферментного анализа (ИФА);
•радиоактивные изотопы; используются в реакции радиоиммунного анализа (РИА)
•электронно-плотные белки; используются в иммуноэлектронной микроскопии.
Реакции ставят в двух направлениях:
-для определения неизвестного антигена;
-для определения неизвестных антител.
Используют прямые и непрямые методы. Непрямой метод заключается в выявлении комплекса антиген-антитело с помощью антиглобулиновой (против антитела) сыворотки, имеющей метку.
