
Лекции по биохимии РостГМУ / 9. Лекция. Антиоксидантная защита организма
.pdf
АНТИОКСИДАНТНАЯ ЗАЩИТА
Повреждающие механизмы ПОЛ
Различают первичный и вторичный повреждающий механизмы ПОЛ.
I. Первичный механизм ПОЛ связан с непосредственным действием свободных радикалов или продуктов ПОЛ на клетку.
В результате действие первичного механизма идет деструкция полиненасыщенных жирных кислот (ПНЖК), входящих в состав мембранных фосфолипидов. Из «срезанных хвостов» ПНЖК, имеющих двойную связь, образуются промежуточные продукты ПОЛ: оксикислоты, этилен, кетоны, альдегиды. Из «срезанных хвостов», имеющих две и более двойные связи, образуется вторичный продукт ПОЛ – малоновый диальдегид (МДА).
МДА имеет две реакционно-способные альдегидные группы. Легко взаимодействует с белками, липидами, белково-липидными комплексами, образуя внутри- и межмолекулярные сшивки путём образования ковалентных связей по остаткам аминогрупп (радикалы лизина и концевые аминогруппы белков, аминогруппы фосфатидэтаноламинов).
Полимеризация белков, липидов и белково-липидных комплексов
Полимеризация белков, липидов и белково-липидных комплексов с образование Шиффовых оснований (третичный – конечный продукт ПОЛ). Уровень оснований Шиффа является информативным критерием, отражающим интенсивность ПОЛ.
Реакции образования внутри- и межмолекулярных сшивок можно представить следующим образом:
а) образование внутримолекулярной сшивки в молекуле белка:
|
NH2 |
O = C – H |
|
N = CH |
|
|
׀ |
|
׀ |
Pr |
+ |
CH2 |
Pr |
CH2 |
|
NH2 |
׀ |
2Н2О |
׀ |
белок |
|
O = C – H |
|
N = CH |
|
|
МДА |
связь прочная ковалентная, |
|
образовалось Шиффово основание
В результате ограничивается способность молекулы белка к изменению конформации, что приводит к утрате функции белка.

б) образование межмолекулярной сшивки между молекулами белков:
H |
H |
H |
H |
׀ |
׀ |
׀ |
׀ |
Pr-N H2 + O = C – CH2 – C = O + H2 N-Pr |
Pr-N=C-CH2-C=N-Pr |
||
|
-2H2O |
образовался димер, |
|
состоящий из 2-х остатков белковых молекул
в) образование межмолекулярных сшивок между молекулами фосфотидилэтаноламинов:
ФЭА-N H2 + O=CН–CH2–CН=O + H2 N-ФЭА |
ФЭА-N=CН-CH2-CН=N-ФЭА |
2H2O |
липофусцин |
В результате возрастает микровязкость мембраны, снижается её текучесть, что приводит к изменению функции мембраны. При старении организма этот процесс приводит к образованию ксантоматозных бляшек вследствие накопления липофусцина.
Полимерные белок-липидные комплексы стабильны и легко обнаруживаются флюориметрическими методами.
Все эти изменения приводят к нарушению функции ферментов, ассоциированных в мембране, и мембранных рецепторов. Образование комплексов делает мембрану ригидной (невосприимчивой к внешним сигналам), так как конформационные изменения белковых молекул (ферментов, транспортных систем, рецепторов), лежащие в основе биохимического ответа клетки на внешнее воздействие, осуществляются с трудом.
д) образование межмолекулярных белок-липидных сшивок:
Pr-NH2 + O=CH – CH2 – C=O + H2N-ФЭА |
Pr-N=CH-CH2-C=N-ФЭА |
2H2O
Окисление аминокислот и белков, содержащих сульфгидрильные группы
SH-группы входят в состав цистеина и метионина и выступают в качестве восстановителей, взаимодействуя со свободными радикалами:
Pr —SH + RO2˙→PrS˙ + ROOH (гидроперекись ЖК)
Образующиеся радикальные формы очень неустойчивы и легко взаимодействуют друг с другом:
PrS˙ + PrS˙ → Pr —S—S—Pr
В результате такого взаимодействия образуются неполярные ковалентные связи (дисульфидные мостики). Такой тип взаимодействия характерен для радикалов свободных аминокислот.
Радикалы аминокислот также могут подвергаться окислению молекулярным кислородом:
PrS˙ + О2 + Н+ → PrSOOH (белковые сульфопроизводные)
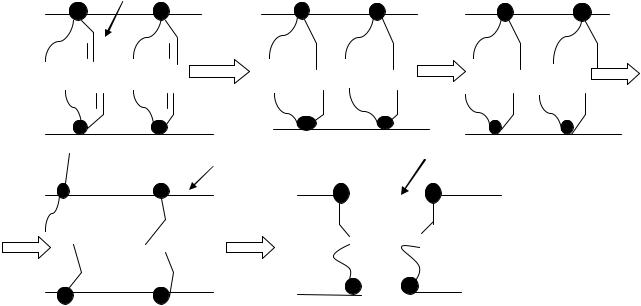
Разрыв гликозидных связей в полисахаридах
Под действием свободных радикалов осуществляется окисление и разрыв гликозидных связей, что приводит к деструкции полисахаридов.
Деструкция и разрушение нуклеопротеинов
Деструкция и разрушение нуклеопротеинов осуществляется: а) по азотистому основанию; б) по углеводному компоненту; в) по белковой части.
В результате деструкции нуклеопротеинов клетка утрачивает генетическую информацию.
II. Вторичный повреждающий механизм ПОЛ
Является следствием первичного свободно-радикального повреждения химической структуры биологически важных молекул.
1.Повышение проницаемости биомембран
Врезультате атаки НО˙ у α-углеродного атома молекулы ненасыщенной жирной кислоты, входящей в состав фосфолипидов биологических мембран, появляется перекисная группировка: сначала - ОО˙, затем - ООН.
Перекисная группа гидрофильна и выталкивается и выталкивается на поверхность мембраны вместе с жирной кислотой, на которой находится. На
поверхности мембраны имеется фермент фосфолипаза А2, которая «выстригает» радикалы ненасыщенных ЖК из фосфолипидов с образованием ОН-групп. Фосфолипиды, утратившие остатки ЖК, превращаются в лизофосфатиды. В результате в мембране появляются ОН-группы, образующие гидрофильные поры. Таким образом, мембрана превращается в «решето» и нарушается её главное свойство – избирательная проницаемость.
OH• атака
ОО• |
ОО• |
ООН |
ООН |
ОО• |
ОО• |
ООН |
ООН |
фосфолипаза А2 |
|
гидрофильная пора |
|
OOH |
ОН ОН |
OOH |
ОН ОН |
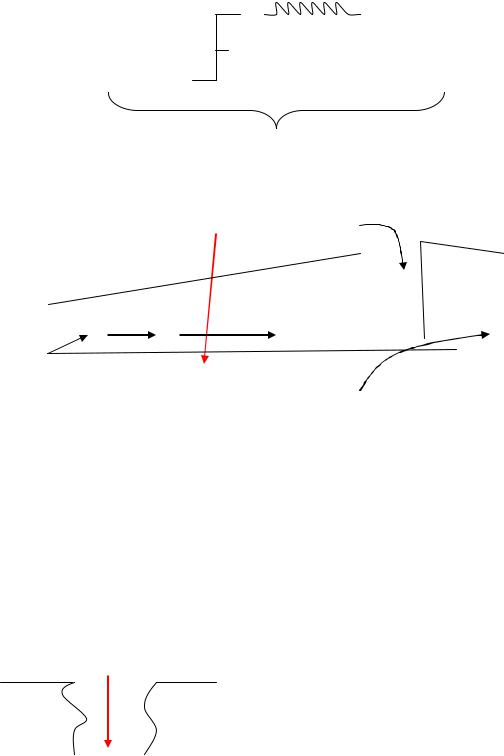
Повышение проницаемости биомембран – образование гидрофильных пор
О |
ЖК |
ОН
R – O
ФЛ
Лизофосфатид
Снижение процессов окислительного фосфорилирования.
за счёт протонов создается ΔμН |
|
|
|
|
|
|
||
|
|
Н● |
Н+ |
|
ΔμН |
|||
|
|
|
||||||
|
|
|
|
|
|
|
|
|
Н+ |
мембрана |
|
|
|
|
|
в норме |
|
|
|
|
|
|
|
|
АТФ-азный канал |
|
|
ē |
ē |
|
|
● |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
SН2 |
через пору |
О2 |
АТФ-аза |
|||||
|
ОН- |
ОН- |
|
|
|
ОН- |
||
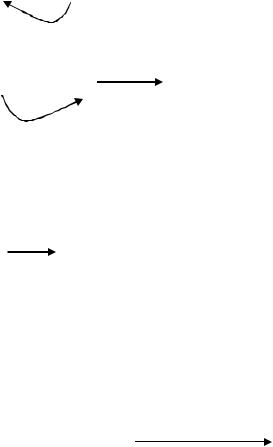
В физиологических условиях митохондриальная мембрана непроницаема для протонов и ΔμН+ = 0,2В, а Н+ проникают во внутреннюю митохондриальную мембрану по каналу АТФ-синтетазы. При повышении интенсивности ПОЛ и появлении в мембране гидрофильных пор, Н+ имеют возможность возвращаться в мембрану через эти поры, минуя канал АТФсинтетазы. В результате меняется величина ΔμН+. Окисление субстратов в дыхательной цепи не прекращается, но идёт в холостую, так как АТФ не синтезируется. Из-за разобщения окислительного фосфорилирования.
Кроме ионов водорода через гидрофильные каналы проходят Na+. Это приводит к нарушению симпорта аминокислот и глюкозы, которые
проникают в клетку с ионами натрия.
Na+, Ca2+
ОН НО
В результате работы Na+/Ca2+- обменника усиливается поступление в клетку ионов Са2+, при этом активируются Са-зависимые гидролазы, разрушающие собственные структуры клетки.
Также меняется активность мембранных ферментов, меняется микровязкость мембран, конформация рецепторов и нарушается их взаимодействие с лигандами.
Система регуляции ПОЛ
Существуют ферментативные и неферментативные системы регуляции ПОЛ.
Ферментативная система регуляции
Ферментативная система регуляции включает три линии защиты:
1)супероксиддисмутаза (СОД) + каталаза;
2)глутатионпероксидаза (ГПО) + глутатионредуктаза (ГР);
3)церулоплазмин + трансферин.
I. линия антиоксидантной защиты (СОД+катазаза)
СОД - содержится в клетках любого происхождения, считается мембранным ферментом. В активном центре содержится ион Сu2+ или Mn2+ (митохондриальная СОД). Существует также Zn2+-содержащая СОД. Фермент обладает высокой активностью – 1 молекула фермента способна обеспечивать дисмутацию (одновременное окисление и восстановление) 4,8 × 106 молекул супероксид-анион-радикала в минуту.
Каталитическую активность фермента обеспечивает Cu2+, выполняющий роль и акцептора, и донора электрона:
1) Е – Сu2+ + О2• |
→ Е – Сu1+ + О2 |
||
фермент |
ē |
принимает |
|
|
|
СОД переносит ē – это окисление. |
|
|
|
|
2Н+ |
2) Е – Сu1+ + О2• |
Е – Сu2+ + Н2О2 |
||
отдает |
ē |
|
в присутствии протонов, которые берутся из среды |
Дисмутация – это окисление и восстановление, происходящие |
|||
одновременно. |
|
|
|
Суммарно СОД обеспечивает образование Н2О2 и О2● |
|||
|
2Н+ |
|
|
О2• + О2• |
|
Н2О2 + О2 |
|
СОД
Каталаза – антиперекисный фермент. Фермент представляет собой олигомерный белок (тетрамер), содержащий атом Fe2+/3+. Каталаза обладает очень высокой активностью и работает при высокой концентрации пероксида водорода. Одна молекула фермента обеспечивает расщепление 5 × 106 молекул Н2О2 в минуту:
2Н2О2 |
каталаза |
2Н2О + О2 |
На основе СОД и каталазы разработаны лекарственные препараты:
1)пероксинорм (препарат СОД из печени крупного рогатого скота);
2)эпурокс (СОД + каталаза);
3)редоксан (препарат СОД из эритроцитов человека).
II. линия антиоксидантной защиты (ГПО + ГР – глутатион-зависимые ферменты)
Глутатион – трипептид (глу – цис – гли). Свои восстановительные свойства глутатион проявляет за счёт SH-групп цистеина.
Глутатионпероксидаза (ГПО) не обладает строгой специфичностью. Фермент содержится во всех клетках: в мембранах и протоплазме. В активном центре содержит Se. ГПО способна разрушать гидроперекиси ЖК за счёт SH-групп глутатиона и образования дисульфидных мостиков:
|
ГПО |
|
|
RO OH + |
2G—SH |
ROH + H2O + G—S—S—G |
|
гидроперекись |
восстановленный |
оксикислота |
окисленный |
|
глутатион |
|
глутатион |
Помимо этого, ГПО обладает псевдокаталазной активностью и может разрушать пероксид водорода подобно каталазе. Необходимо отметить, что каталазную активность фермент проявляет при более низких концентрациях Н2О2, чем каталаза.
Восстановление |
окисленного |
глутатиона |
осуществляет |
глутатионредуктаза (ГР): |
|
|
|
|
ГР |
2G—SH + НАДФ+ |
|
G—S—S—G + НАДФН2 |
|||
окисленный глутатион |
(донор протонов) |
восстановленный |
|
глутатион
Источником НАДФН+Н+ является пентозофосфатный путь окисления глюкозы (печень и эритроциты). Реакцию, в которой генерируется НАДФН+Н+ катализирует фермент глюкозо-6-фосфатдегидрогеназа.
Помимо ГПО инактивацию гидроперекисей ЖК может осуществлять мембранный фермент глутатионтрансфераза, который входит в общую пероксидазную активность клетки.
III. линия антиоксидантной защиты
Церулоплазмин (ЦП) – белок плазмы крови и её основной антиоксидант. Является белком острой фазы при воспалении. В активном
центре содержит Cu2+. Другое название фермента – ферроксидаза, так как он окисляет Fe2+:
ЦП–Cu2+ + Fe2+ |
ЦП–Cu+ + Fe3+ |
Церулоплазмин ингибирует ПОЛ на стадии разветвления цепи, так как окисляет Fe2+ - донор электронов.
В плазме церулоплазмин за счёт Cu2+ может проявлять свойства СОД. Трансферрин – плазменный белок, обеспечивающий связывание и
транспортировку Fe3+ в депо. Образуя координационные связи с атомом Fe3+, трансферрин работает по типу хелатора (комплексообразователя).
Неферментативная система регуляции ПОЛ
Природные антиоксиданты:
1. α-токоферол (витамин Е) – α-ТФ в больших количествах содержится в семенной жидкости и развивающихся клетках. Благодаря своей структуре погружается в мембрану и является мембранным антиокисдантом. В основе действия α-ТФ лежит взаимодействие с радикалами, образующимся в цепи окисления жирных кислот (RO2˙):
|
|
|
радикал вит Е (αТФ•) |
|||||
CH3 |
O |
CH |
3 |
|
О |
|||
|
|
║ |
H3С |
|
|
║ |
||
H3C |
CH3 |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||||
|
|
|
||||||
|
|
R + RO2• |
•О |
|
R |
|||
|
|
|
||||||
|
|
гидроперекисный |
|
|
+ ROOH |
|||
|
|
|
|
|
|
|||
НО |
|
радикал ЖК |
|
|
|
гидроперекись |
||
CH3 |
вит Е |
CH3 |
|
|
|
|
||
Радикалы α-ТФ˙ выталкиваются на поверхность мембраны. Два радикала способны к рекомбинации с образованием димеров нерадикальной природы. В мембранах α-ТФ сохраняется в постоянном количестве, хотя является витамином и в организме человека не синтезируется. Восстановление радикалов α-ТФ˙ осуществляет аскорбиновая кислота.
Подобно α-ТФ проявляют активность стероидные гормоны, убихиноны, витамин К и пуриновые основания.
2. аскорбиновая кислота (витамин С)
Суточная норма витамина-С составляет 70 мг.
|
O |
|
О |
||||||
O= |
|
|
|
CHOH-CH2OH + α-ТФ• |
α-ТФ+ О= |
|
|
|
CHOH-CH2OH |
|
|
|
|
|
|||||
OH |
|
|
OH |
•О |
|
ОН |
|||
|
|
|
|||||||
аскорбиновая кислота |
семидегидроаскорбиновая к-та |
||||||||
При восстановлении α-ТФ˙ аскорбиновая кислота отдаёт один из атомов водорода, переходя в семидегидроаскорбиновую кислоту (радикальная форма аскорбиновой кислоты). Это соединение является прооксидантом, так как может восстанавливать Fe3+ в Fe2+:
Две радикальные формы аскорбиновой кислоты могут взаимодействовать между собой с образованием восстановленной и полностью окисленной формы аскорбиновой кислоты.
Помимо этого, существует НАД-зависимая и глутатион-зависимая системы восстановления аскорбиновой кислоты, но их активность низкая.
3. амины
К природным антиоксидантам относятся различные амины, но они не являются истинными антиоксидантами.
Например, цистамин (SH–CH2–CH2–NH2) взаимодействует с МДА, а не со свободными радикалами, тем самым препятствуя реализации его повреждающего действия на биологически важные молекулы.
4. HS-соединения
Соединения, в состав которых входит SH-группа, являются инактиваторами гидроперекисных радикалов ЖК. К ним относятся глутатион и серосодержащие аминокислоты – метионин и цистеин. Наибольшее количество глутатиона содержится в печени и эритроцитах:
SH + ROO˙ |
ROOH |
+ |
S˙ |
||||
|
|
|
перекисный |
гидроперекись |
|
|
|
|
|
|
|
|
|||
|
|
|
радикал ЖК |
ЖК |
|
|
|
|
|
|
|
|
|
||
|
|
|
СН2 |
|
|
СН2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН |
|
|
СН |
|||
NH2 |
|
|
COOH |
|
NH2 |
|
COOH |
цистеин |
|
|
радикал цистеина |
||||
Например, цистеин обезвреживает перекисный радикал ЖК, образуя менее агрессивное соединение гидроперекиси ЖК и радикал цистеина.
Две радикальные формы цистеина могут взаимодействолвать между собой с образованием нерадикального соединения – цистина:
S˙ |
+ |
S˙ |
|
S |
|
|
S |
|||
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
СН2 |
|
CH2 |
СН2 |
|
|
CH2 |
||||
|
|
|
|
|
|
|
|
|
|
|
СН |
CH |
|
СН |
|
CH |
|||||
NH2 |
COOH |
NH2 COOH |
NH2 COOH |
NH2 COOH |
||||||
|
|
радикалы цистеина |
|
|
цистин |
|||||
5. многоатомные спирты
Ловушками свободных радикалов являются многоатомные спирты (сорбит, ксилит, манит, а также альдегидоспирт – глюкоза). Они связывают свободные радикалы и АФК, включая гидроксильный радикал, за счёт своих ОН-групп. Например, введение 10 мл 40% раствора глюкозы обеспечивает нейтрализацию свободных R˙.
6. комплексообразователи
Комплексообразователи или хелаторы – способны образовывать координационные связи с ионами Fe2+/3+. В результате образуются комплексные соли. Примерами комплексообразователей являются ЭДТА (этилендиаминтетрауксусная кислота), ди- и трикарбоновые кислоты.
7. мембрана сама является структурным антиоксидантом. Структура мембраны такова, что она препятствует вхождению катализатора ПОЛ и контакта интактной мембраны с продуктами ПОЛ. На мембране находятся мембранные глутатион-зависимые ферменты – Глутатион-S-трансфераза; α- токоферол, восстанавливаемый витамином С.
комплексообразователь |
каталаза |
глутатион, глутатионзависимые ферменты |
||||
ē |
|
|
|
|
|
|
О2 |
О2• |
Н2О2 |
НО• |
|
ROO• |
ROOH |
КО |
|
|
|
|
|
|
блокаторы КО |
СОД |
|
многоатомные |
αТФ, |
|
|
(аллопуринол) |
|
|
спирты, |
|
вит.С |
|
|
|
|
HS-соединения |
|
|
|
Синтетические антиоксиданты
1. Существуют синтетические антирадикальные органические вещества, которые выступают в роли конкурента субстратов ПОЛ (ЖК). Обозначим их как InH.
У ингибитора связь с протоном очень лабильна и гораздо слабее, чем у α-углеродного атома в молекуле ненасыщенной ЖК. Энергия, необходимая для разрыва связи In–H равна 40 – 60 ккал/моль. Энергия, необходимая для разрыва связи С–Н в молекуле жирной кислоты равна 70 – 90 ккал/моль. Поэтому реакция InH с RO2˙ идёт легче, чем с RH.
RO2˙ + InH + RH |
ROOH + In˙ + RH |
интактная ЖК |
гидроперекись ЖК |
Образовавшийся радикал ингибитора (In˙) малоактивен и не способен инициировать новые цепи окисления жирных кислот, так как не обладает достаточным запасом энергии для разрыва связи С–Н.
Как правило, радикалы ингибиторов взаимодействуют друг с другом с
образованием нерадикальных димеров: In˙ + In˙ |
In—In |
|
Радикалы ингибиторов также могут взаимодействовать с RO2˙с образованием |
||
перекисных продуктов нерадикального характера: In˙ + RO2˙ |
ROOIn |
|
2. К синтетическим антиоксидантам относятся такие |
органические |
|
вещества, как ионол (дитретбутилфенол) и дибунол (на его основе готовят лекарственный препарат – линимент дибунола).
СН3 |
ОН СН3 |
экранированный гидроксил |
||||||
|
|
|
|
|
|
|
|
|
Н3С–С |
|
׀ |
|
С |
–СН3 |
(связь О-Н очень слабая) |
||
|
||||||||
|
|
|
|
|
|
|
|
|
Н3С |
|
|
СН3 |
|
||||
третбутиловая группировка
ионол
Экранированная НО-группа, которая принимает на себя атаку свободных радикалов, окружённая с двух сторон гидрофобными метильными группами, защищающими мембрану.
В организме человека ионол оказывает меньшую активность чем α- токоферол, так как строение молекулы ионола не позволяет погружаться в мембрану в отличие от α-токоферола и ионол более гидрофобен. Ионол используется для наружного применения, чаще всего при ожогах.
