
Лекции по биохимии РостГМУ / 1.2. Лекция. Обмен углеводов (часть 2)
.pdf
ЗНАЧЕНИЕ КАТАБОЛИЗМА ГЛЮКОЗЫ
Основное физиологическое назначение катаболизма глюкозы заключается в высвобождении энергии для синтеза АТФ.
Энергия, выделяющаяся в процессе полного распада глюкозы до СО2 и Н2О, составляет 2880 кДж/моль. Если эту величину сравнить с энергией гидролиза высокоэнергетических связей – 38 моль АТФ (50 кДж на моль АТФ), то получим: 50×38=1900 кДж, что составляет 65% от всей энергии, выделяющейся при полном распаде глюкозы. Такова эффективность использования энергии распада глюкозы для синтеза АТФ. Необходимо учитывать, что реальная эффективность процесса может быть ниже. Точно оценить выход АТФ можно только при субстратном фосфорилировании, а соотношение между поступлением водорода в дыхательную цепь и синтезом АТФ является приблизительным.
Аэробный распад глюкозы происходит во многих органах и тканях и служит основным, хотя и не единственным, источником энергии для жизнедеятельности. Некоторые ткани находятся в наибольшей зависимости от катаболизма глюкозы как источника энергии. Например, клетки мозга расходуют до 100 г глюкозы в сутки, окисляя еѐ аэробным путѐм. Поэтому недостаточное снабжение мозга глюкозой или гипоксия проявляются симптомами, свидетельствующими о нарушении функций мозга (головокружения, судороги, потеря сознания).
Анаэробный распад глюкозы происходит в мышцах, в первые минуты мышечной работы, в эритроцитах (в которых нет митохондрий), а также в разных органах в условиях ограниченного снабжении их кислородом, в том числе в клетках опухолей. Для метаболизма клеток опухолей характерно ускорение, как аэробного, так и анаэробного гликолиза. Но преимущественный анаэробный гликолиз и увеличение образования лактата служит показателем повышенной скорости деления клеток при недостаточной обеспеченности их системой кровеносных сосудов.
Кроме энергетической функции, катаболизм глюкозы может выполнять и анаболические функции. Метаболиты гликолиза используются для синтеза новых соединений. Так, фруктозо-6-фосфат и глицеральдегид-3-фосфат участвуют в образовании рибозо-5-фосфата – структурного компонента нуклеотидов; 3-фосфоглицерат может включаться в синтез аминокислот, таких как серин, глицин, цистеин. В печени и жировой ткани ацетил-КоА, образующийся из ПВК, используется как субстрат при биосинтезе жирных кислот, холестерина, а ДГАФ как источник глицеринового скелета в глицеролипидах*.
* см. следующий раздел семестра – «Обмен липидов».

Регуляция катаболизма глюкозы
Большинство реакций гликолиза обратимы, за исключением трѐх: гексо(глюко)-, фосфофрукто- и пируваткиназой. Регуляторные факторы, изменяющие скорость гликолиза, а значит и образование АТФ, направлены на необратимые реакции. Показателем потребления АТФ является накопление АДФ и АМФ. Последний образуется в реакции, катализируемой аденилаткиназой: 2 АДФ ↔ АМФ + АТФ Даже небольшой расход АТФ ведѐт к заметному увеличению АМФ. Отношение уровня АТФ к АДФ и АМФ
характеризует энергетический статус клетки, а его составляющие служат аллостерическими регуляторами скорости как общего пути катаболизма, так и гликолиза.
Существенное значение для регуляции гликолиза имеет изменение активности фосфофруктокиназы, потому что этот фермент, как упоминалось ранее, катализирует наиболее медленную реакцию процесса. Фосфофруктокиназа активируется АМФ, но ингибируется АТФ. АМФ, связываясь с аллостерическим центром, увеличивает сродство фермента к фруктозо-6-фосфату и повышает скорость его фосфорилирования. Эффект АТФ на этот фермент – пример гомотропного аллостеризма, поскольку АТФ может взаимодействовать как с аллостерическим, так и с активным.
При физиологических значениях АТФ активный центр фосфофруктокиназы всегда насыщен субстратами (в том числе АТФ). Рост отношения АТФ/АДФ снижает скорость реакции.
Изменение активности фосфофруктокиназы способствует регуляции скорости фосфорилирования глюкозы гексокиназой. Снижение активности фосфофруктокиназы при высоком уровне АТФ ведѐт к накоплению как фруктозо-6-фосфата, так и глюкозо-6-фосфата, а последний ингибирует гексокиназу. Следует напомнить, что гексокиназа во многих тканях ингибируется глюкозо-6-фосфатом.
При высоком уровне АТФ снижается скорость ЦТК и ЦПЭ. В этих условиях процесс гликолиза также замедляется. Следует помнить, что аллостерическая регуляция ферментов ОПК и ЦПЭ также связана с изменением концентрации таких ключевых продуктов, как NADH, АТФ и некоторых метаболитов. Так, NADH, накапливаясь в том случае, если не успевает окислиться в ЦПЭ, ингибирует некоторые аллостерические ферменты ЦТК.
Физиологическая роль гликолиза в печени и жировой ткани несколько иная, чем в других тканях. В печени и жировой ткани гликолиз в период пищеварения функционирует, в основном, как источник субстратов для синтеза жиров. Регуляция гликолиза в печени имеет свои особенности и будет рассмотрена в следующей теме.
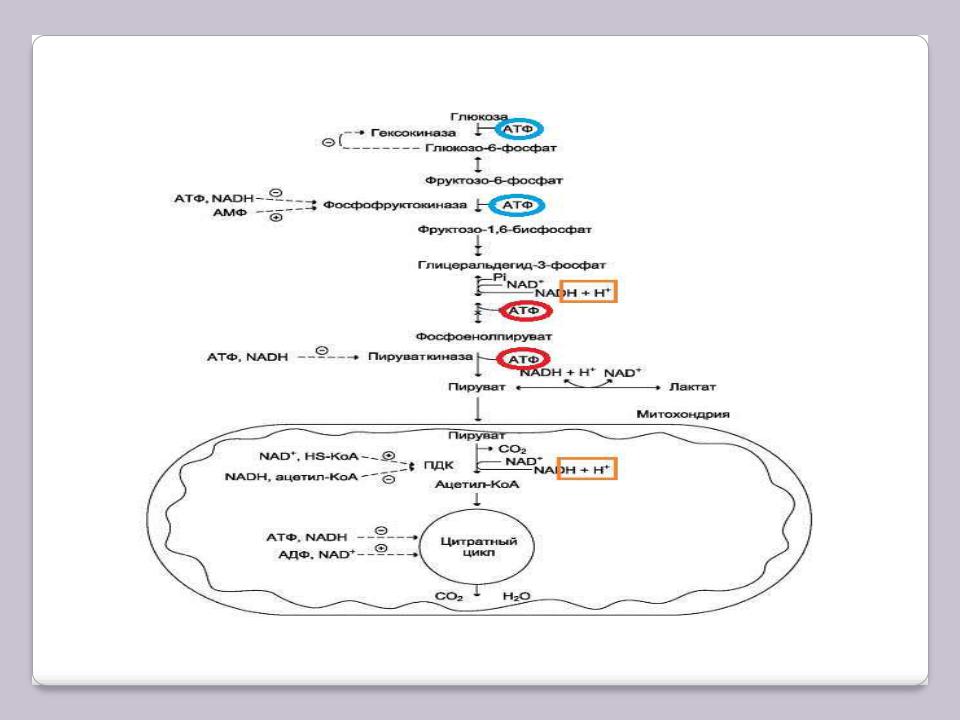
Энергетический эффект и регуляция аэробного гликолиза
Голубым цветом обведены затраты АТФ, красным – получение, оранжевым – водороды в составе восстановленных коферментов.

2,3-ДИФОСФОГЛИЦЕРАТНЫЙ ЦИКЛ
Вгликолизе может протекать дополнительная реакция, катализируемая дифосфоглицератмутазой, превращающей 1,3-дифос-фоглицерат в 2,3- дифосфоглицерат (2,3-ДФГ), который может при участии 2,3-дифосфогли- цератфосфатазы превращаться в 3- фосфоглицерат – метаболит гликолиза.
Вбольшинстве тканей 2,3-ДФГ образуется в небольших количествах.
Вэритроцитах его образуется гораздо больше: он – аллостерический модулятор, понижающий сродство гемоглобина HbA к кислороду*.
* См. тему «Сложные белки» в дисциплине «Химия».

Пентозофосфатный путь превращения глюкозы
Пентозофосфатный путь (ПФП) – альтернативный путь окисления глюкозо-6-фосфата. Состоит из 2 фаз (частей, ветвей): окислительной и неокислительной.
Вокислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу – рибулозо-5-фосфат, и происходит восстановление
NADP+ до NADPH+Н+.
Внеокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза.
ПФП обеспечивает клетки рибозой для синтеза нуклеотидов и NADPH+Н+, который используется в восстановительных процессах.
Ферменты ПФП, так же, как и ферменты гликолиза, локализованы в цитозоле.
Наиболее активно ПФП протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе (в период лактации), семенниках.

ОКИСЛИТЕЛЬНЫЙ ЭТАП ПФП
В окислительной части ПФП глюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап
включает 2 реакции дегидрирования. |
|
|
|
|
Первая реакция дегидрирования |
– превращение глюкозо-6-фосфата в |
|||
глюконолактон-6-фосфат |
катализируется |
NADP+-зависимой |
глюкозо-6- |
|
фосфатдегидрогеназой и сопровождается окислением альдегидной группы у первого атома углерода (образовавшаяся карбоксильная группа сразу вступает в реакцию этерификации, приводящей к внутримолекулярному сложному эфиру – лактону) и образованием одной молекулы восстановленного кофермента NADPH.
Далее глюконолактон-6-фосфат быстро превращается в 6-фосфоглюконат при
участии фермента глюконолактонгидратазы.
Фермент 6-фосфоглюконатдегидрогеназа катализирует вторую реакцию дегидрирования, в ходе которой происходит также и декарбоксилирование. При этом углеродная цепь укорачивается на один атом углерода, образуется рибулозо-
5-фосфат, СО2 и вторая молекула NADPH
Восстановленный NADPH ингибирует первый фермент окислительного этапа ПФП
– глюкозо-6-фосфатдегидрогеназу. Окисление NADPH в NADP+ ослабляет это ингибирование. При этом скорость соответствующей реакции возрастает, и образуется большее количество NADPH.
Суммарное уравнение окислительного этапа ПФП можно представить в виде:
Глюкозо-6-фосфат + 2 NADP++ Н2О→Рибу-лозо-5-фосфат + 2(NADPH+Н+)+СО2.


Реакции окислительного этапа служат основным источником NADPH, необходимого в качестве восстановителя в биосинтетических процессах, антиокисидантной защите, образовании стероидных гормонов, жѐлчных кислот, катаболизме ксенобиотиков, образовании активных форм кислорода (АФК) при фагоцитозе*.
Несмотря на то, что NADPH образуется также при окислении малата до ПВК и диоксида углерода (при участии NADP+-зависимой малат-дегидро- геназы) и дегидрировании изоцитрата (при участии NADP+-зависимой изоцитрат-дегидрогеназы)*, в большинстве случаев потребности клеток в восстановительных эквивалентах удовлетворяются за счѐт ПФП.
Реакции окислительного пути протекают только в том случае, если NADPH возвращается в исходное окисленное состояние NADP+ при участии NADPH-зависимых дегидрогеназ (т.е. при условии использования гидрированного NADPH в восстановительных процессах). Если потребности клетки в NADPH незначительны, рибозо-5-фосфат образуется в результате обратимых реакций неокислительного этапа ПФП, используя в качестве исходных веществ метаболиты гликолиза: глицеральдегид-3-фосфат и фруктозо-6-фосфат.
* См. разделы «Обмен липидов», «Гормоны», «Биохимия печени», «Биохимия крови».

ПЕНТОЗОФОСФАТНЫЙ ЦИКЛ
Окислительный этап образования пентоз и неокислительный этап (путь возвращения пентоз в гексозы) составляют вместе циклический процесс:
6 Глюкозо-6-фосфат+12 NADP+ +2 H2O →
→ 5 Глюкозо-6-фосфат+12 (NADPH+H+) + 6CO2.
Это означает, что из 6 молекул глюкозы образуются 6 молекул рибулозо-5-фосфата (пентозы) и 6 молекул СО2. Ферменты неокислительной фазы превращают 6 молекул рибулозо-5-фосфат в 5 молекул глюкозы. Такой процесс называют пентозофосфатным циклом.
Протекание пентозофосфатного цикла позволяет клеткам продуцировать NADPH, не накапливая пентозы.
Энергия, выделяющаяся при распаде глюкозы, запасется в химических связях NADPH и затем используется в указанных выше процессах.
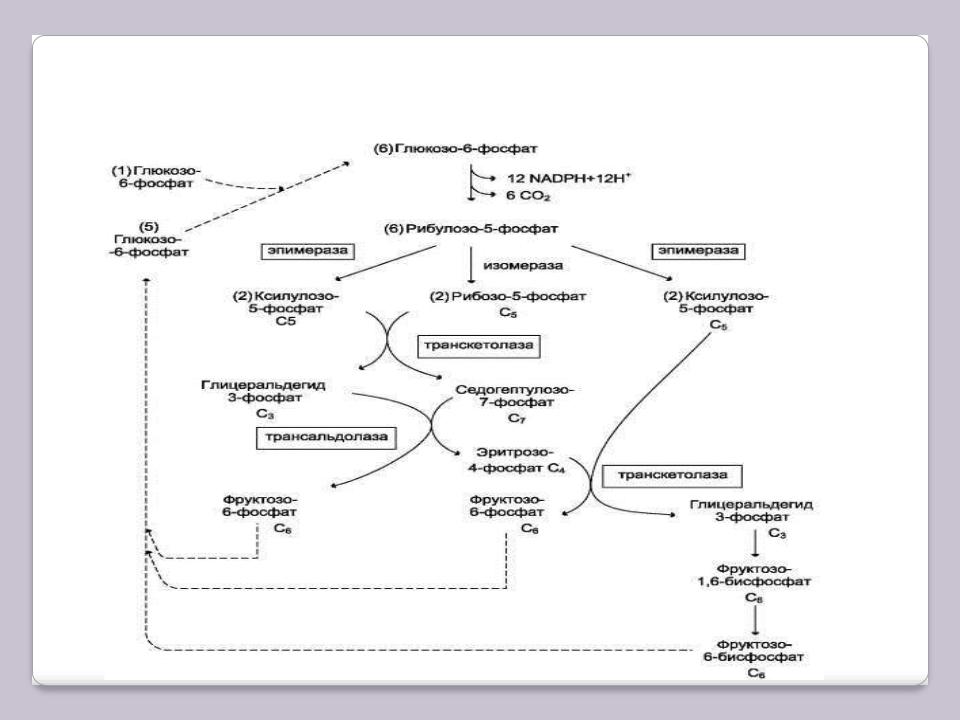
ПЕНТОЗОФОСФАТНЫЙ ЦИКЛ
