
Лекции по биохимии РостГМУ / 1.3. Лекция. Обмен углеводов (часть 3)
.pdf
СИНТЕЗ ГЛЮКОЗЫ ИЗ ГЛИЦЕРОЛА
Глицерол образуется при гидролизе триацилглицеролов (ТАГ), главным образом в жировой ткани*. Использовать его могут только ткани, способные «переодеть» его в рабочую форму (есть глицеролкиназа – АТФзависимый фермент, катализирующий превращение глицерола в α-глицерофосфат (глицерол-3-фосфат)), например, печень, почки. При включении глицерол-3-фосфата в ГНГ происходит его дегидрирование NADзависимой дегидрогеназой с образованием дигидроксиацетон-фосфата (ДГАФ), являющегося метаболитом гликолиза.
*См. «Обмен липидов».

Регуляция гликолиза и глюконеогенеза в печени
По сравнению с другими органами, печень отличается наиболее сложным обменом глюкозы. Кроме пары противоположных процессов (синтез/ распад гликогена), в печени могут происходить ещѐ два противоположно направленных процесса – гликолиз/ГНГ. В большинстве других органов происходит только гликолиз. Переключение печени с гликолиза на ГНГ и обратно происходит по сигналу гормонов инсулина и глюкагона, и реализуется индукцией/репрессией синтеза ключевых ферментов, изменением их активности путѐм:
•аллостерической регуляции;
•ковалентной модификации (фосфорилирование/дефосфорилирование).
Регуляторные воздействия направлены на ферменты, катализирующие необратимые стадии гликолиза и ГНГ, сочетание которых называют «субстратными», или «холостыми» циклами.

РЕГУЛЯЦИЯ СКОРОСТИ РЕАКЦИЙ ГЛИКОЛИЗА И ГНГ, СОСТАВЛЯЮЩИХ СУБСТРАТНЫЕ ЦИКЛЫ
«Субстратные» циклы - парные комбинации процессов синтеза и распада метаболитов. Название «субстратный цикл» означает объединение реакций синтеза и распада субстрата. Название «холостой» отражает результат работы подобного цикла, заключающийся в бесполезном расходовании АТФ. Хотя существование «холостых» циклов нелогично, тем не менее они могут функционировать. Более того, эти циклы могут быть мишенью регуляторных воздействий, так как составляющие их реакции катализируют разные ферменты. Реципрокное изменение активности этих ферментов предотвращает одновременное протекание противоположных процессов.
Переключение в печени гликолиза на ГНГ и обратно при смене абсорбтивного состояния на постабсорбтивное (или при голодании) происходит, главным образом, в результате регуляции активности ферментов, катализирующих реакции субстратных циклов. Эти циклы обозначены цифрами I, II, III на рисунке ниже.
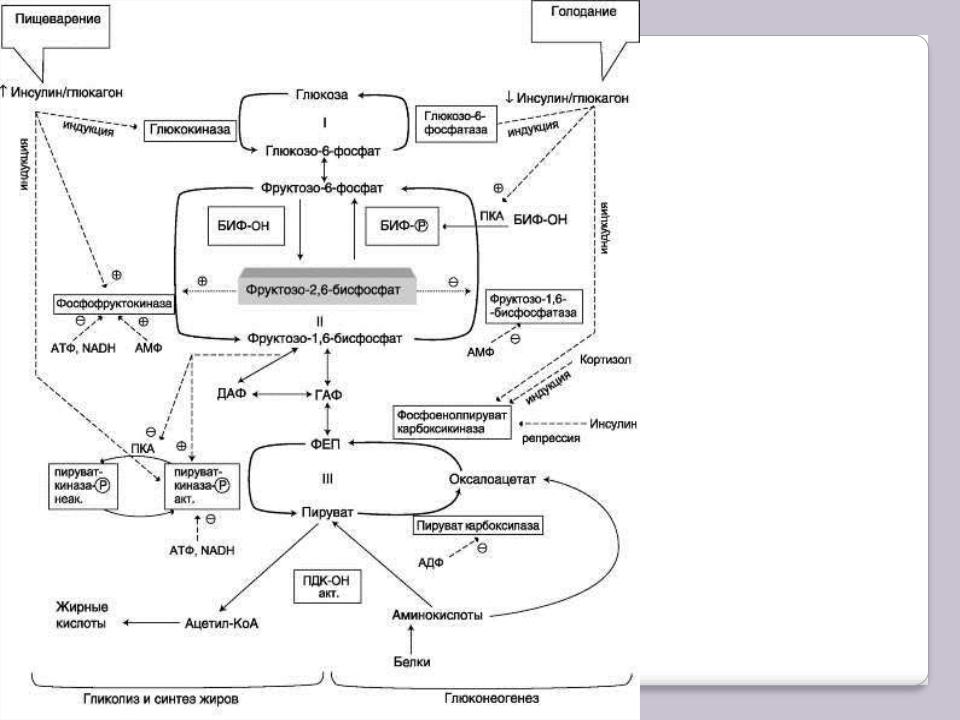
Регуляция метаболизма глюкозы в печени
БИФ – бифункциональный фермент (фруктозо- 2,6-дифосфатаза/ фосфофруктокиназа-2); БИФ-ОН – дефосфорилированный фермент; БИФ-Р – фосфорилированный фермент, ПДК-ОН – дефосфорилированный ПВК-де- гидрогеназный комплекс; ПК-ОН – дефосфорилированная пируваткиназа; ГАФ – глицеральдегидфосфат; ДАФ(ДГАФ) – дигидроксиацетонфосфат.
I-III – субстратные циклы: в рамках – регуляторные
ферменты глиполиза и
ГНГ.

Направление реакций второго субстратного цикла зависит от активности
фосфофруктокиназы и фосфатазы фруктозо-1,6-дифосфата. Активность этих ферментов зависит от концентрации фруктозо-2,6-бисфосфата. Фруктозо-2,6-дифосфат - метаболит, образующийся в незначительных количествах из фруктозо-6-фосфата и выполняющий только регуляторные функции. Образование фруктозо-2,6-дифосфата путѐм фосфорилирования фруктозо-6-фосфата катализирует бифункциональный фермент (БИФ), который катализирует также и обратную реакцию. Однако превращение фруктозо-2,6-бисфосфата в фруктозо-6-фосфат необратимо. В реакции фосфорилирования фруктозо-6-фосфата фермент проявляет киназную активность, а при дефосфорилировании образованного фруктозо-2,6-бисфосфата – фосфатазную (отсюда – название фермента: «бифункциональный» - какой это уровень организации ферментов?).
Киназная активность БИФ проявляется, когда фермент находится в дефосфорилированной форме (БИФ-ОН). Дефосфорилированная форма БИФ характерна для абсорбтивного периода, когда инсулин/глюкагоновый индекс высокий. В этот период количество фруктозо-2,6-дифосфата увеличивается.
При низком инсулин-глюкагоновом индексе, характерном для периода длительного голодания, происходит фосфорилирование БИФ, и он функционирует как фосфатаза. Результат – снижение количества фруктозо-2,6-дифосфата.
Киназную и фосфатазную реакции катализируют разные активные центры БИФ, но в каждом из двух состояний фермента (фосфорилированном и дефосфорилированном) один из активных центров ингибирован. Регуляторное влияние фруктозо-2,6-бисфосфата заключается в том, что он аллостерически активирует фосфофруктокиназу (гликолиз). При этом фруктозо-2,6-дифосфат снижает ингибирующее действие АТФ на этот фермент в абсорбтивном периоде и повышает его сродство к фруктозо-6-фосфату. В то же время фруктозо-2,6-дифосфат ингибирует фруктозо-1,6- дифосфатазу (ГНГ). Итак, в абсорбтивном периоде уровень фруктозо-2,6-дифосфата повышается, что приводит к активации фосфофруктокиназы и ускорению гликолиза.
Результат уменьшения количества фруктозо-2,6-дифосфата в постабсорбтивном периоде – снижение активности фосфофруктокиназы, замедление гликолиза и переключение гликолиза на ГНГ.

Реакции, катализируемые бифункциональным ферментом (БИФ) в печени (А) и его регуляция (Б). ПКА – протеинеиназа-А.
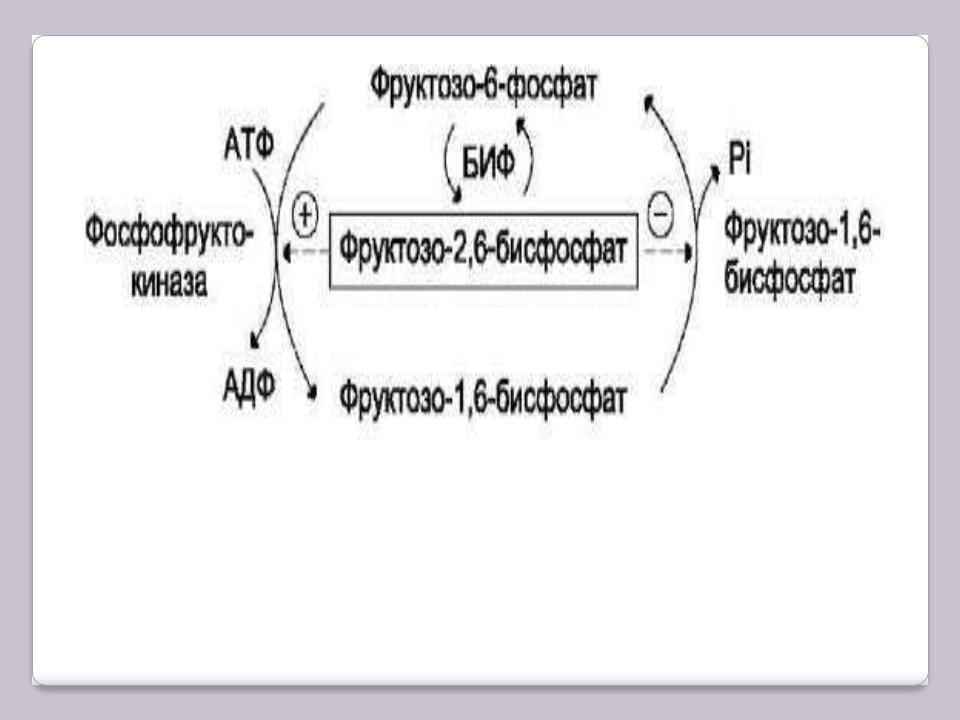
Регуляция реакций II субстратного цикла фруктозо-2,6-дифосфатом.
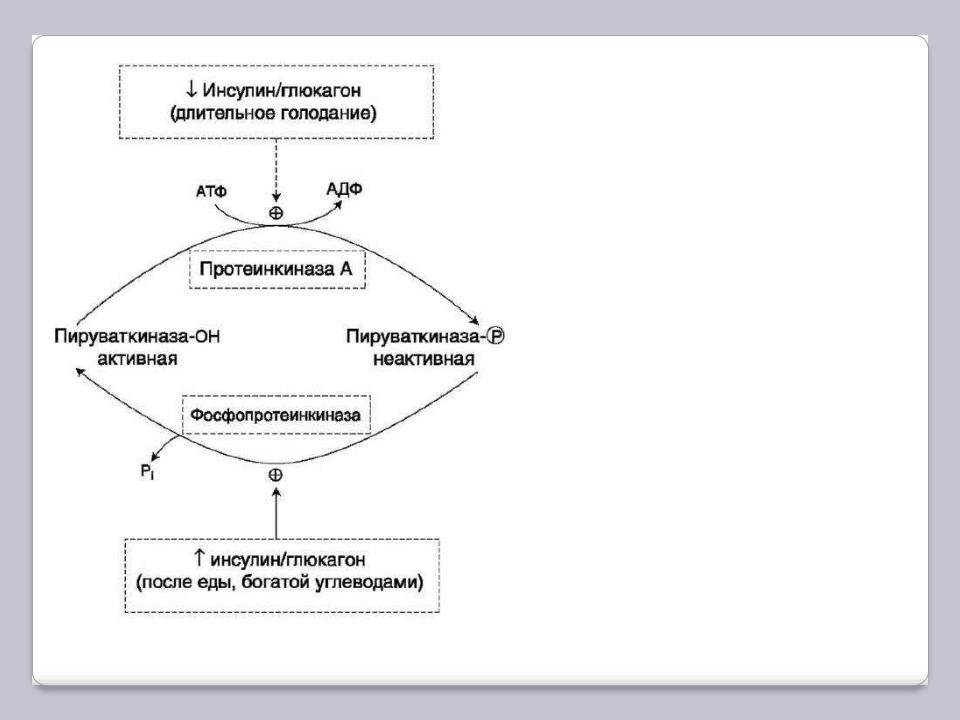
Регуляция пируваткиназы в печени
В период пищеварения инсулин* активирует фосфопротеинфосфатазу, которая дефосфорилирует пируват-киназу, активируя еѐ. Кроме того, инсулин в печени индуцирует синтез пируваткиназы и репрессируя синтез ФЕП-карбоксикиназы. Следовательно, при пищеварении ускоряется гликолиз.
Эта же реакция замедляется в постабсорбтивном состоянии под влиянием глюкагона, который опосредованно через цАМФ-зависимую протеинкиназу-А инактивирует пируват-киназу.
При длительном голодании глюкагон* ускоряет ГНГ. Это достигается не только путѐм фосфорилирования пируват-киназы и снижением скорости гликолиза, но и путѐм индукции синтеза ферментов ГНГ: ФЕПкарбоксикиназы, фруктозо-1,6-дифосфата- зы и глюкозо-6-фосфатазы. Такое же действие при длительном голодании оказывает кортизол.
* См. раздел «Гормональная регуляуия» на II курсе.

РЕГУЛЯЦИЯ СОДЕРЖАНИЯ ГЛЮКОЗЫ В КРОВИ В АБСОРБТИВНОМ И ПОСТАБСОРБТИВНОМ ПЕРИОДАХ
Для предотвращения чрезмерного повышения концентрации глюкозы в крови при пищеварении основное значение имеет потребление глюкозы печенью и мышцами, в меньшей мере – жировой тканью. 60% всей глюкозы, поступающей из кишечника в воротную вену, поглощается печенью. Около ⅔ этого количества откладывается в виде гликогена*, остальная часть превращается в ТАГ и/или окисляется, обеспечивая синтез АТФ. Ускорение этих процессов инициируется повышением инсулин-глюкагонового индекса.
Другая часть глюкозы, поступающей из кишечника, попадает в общий кровоток. Примерно ⅔ этого количества поглощается мышцами и жировой тканью. Это обусловлено увеличением проницаемости мембран мышечных и жировых клеток для глюкозы под влиянием высокой концентрации инсулина. Глюкоза в мышцах откладывается в виде гликогена*, а в жировых клетках превращается в ТАГ. Остальная часть глюкозы общего кровотока поглощается другими клетками (инсулинонезависимыми).
При нормальном ритме питания и сбалансированном рационе концентрация глюкозы в крови и снабжение глюкозой всех органов поддерживается главным образом за счѐт синтеза и распада гликогена. Лишь к концу ночного сна, т.е. к концу самого большого перерыва между приѐмами пищи, может несколько увеличиться роль ГНГ, значение которого будет возрастать, если завтрак не состоится и голодание продолжится.
* В чѐм биологический смысл синтеза гликогена, как он регулируется, какие продукты образуются при его распаде в печени и мышцах?

РЕГУЛЯЦИЯ СОДЕРЖАНИЯ ГЛЮКОЗЫ В КРОВИ В ПЕРИОД ПОКОЯ И ВО ВРЕМЯ ФИЗИЧЕСКОЙ НАГРУЗКИ
Как в период покоя, так и во время продолжительной физической работы сначала источником глюкозы для мышц служит гликоген, запасѐнный в самих мышцах, а затем глюкоза крови. Известно, что 100 г гликогена расходуется на бег примерно в течение 15 мин, а запасы гликогена в мышцах после приѐма углеводной пищи могут составлять 200-300 г .
Координация скоростей гликолиза, ГНГ, синтеза и распада гликогена обеспечивает:
•предотвращение чрезмерного повышения концентрации глюкозы в крови после приѐма пищи;
•запасание гликогена и его использование в промежутках между приѐмами пищи;
•снабжение глюкозой мышц, потребность которых в энергии быстро возрастает при мышечной работе;
•снабжение глюкозой клеток, которые при голодании в качестве источника энергии используют преимущественно глюкозу (нервные клетки, эритроциты, мозговое вещество почек, семенники).
