54. Законы Фарадея. Выход по току.
Химические процессы, протекающие под действием электрического тока на электродах, погруженных в электролиз, называют электролизом.
Количество образовавшегося вещества связано с количеством электричества, пропущенного через электролит.
Законы Фарадея – основные законы электролиза, отражающие общий закон сохранения вещества в условиях протекания электрохимической реакции.
Согласно
первому закону Фарадея
масса вещества т, выделившегося на
каждом из электродов при прохождении
электрического тока I, прямо пропорциональна
количеству электричества, прошедшему
через электролит. Количество электричества
 ,
если I не зависит от t;
,
если I не зависит от t;
в
противном случае
масса т пропорциональна
 ,
где t1 и t2 – моменты включения и выключения
тока.
,
где t1 и t2 – моменты включения и выключения
тока.
Математическая формулировка первого закона Фарадея:

Согласно второму закону Фарадея для определенного количества электричества (электрического заряда) масса химического элемента, который осядет на электроде при электролизе, прямо пропорциональна эквивалентной массе данного элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Или
Одно и то же количество электричества приводит к выделению на электродах при электролизе эквивалентных масс различных веществ. Для выделения одного моля эквивалента любого вещества необходимо затратить одно и то же количество электричества, а именно 96485 Кл. Данная электрохимическая константа называется числом Фарадея.
Математическая формулировка второго закона Фарадея:

Оба эти закона можно записать в виде одного уравнения:
 ,
где
m – масса вещества, выделившаяся на
электроде,
,
где
m – масса вещества, выделившаяся на
электроде,
Q – количество электричества,
μ – молярная масса вещества, участвующего в электролизе,
z – число элементарных зарядов, соответствующее превращению одной молекулы этого вещества,
F
– постоянная Фарадея, равная

Оба закона Фарадея абсолютно точны, если ионами электролита переносится всё прошедшее через него количество электричества. Наблюдаемые в некоторых случаях отклонения от этих законов могут быть связаны с неучтенными побочными электрохимическими реакциями (например, выделение газообразного водорода при электроосаждении некоторых металлов) или с частичной электронной проводимостью (например, при электролизе некоторых расплавов). Системы, в которых полностью исключены указанные причины кажущихся отклонений от закона Фарадея, получили название кулонометров; их использование позволяет по количеству образовавшихся продуктов электролиза точно определить количество пропущенного электричества.
ВЫХОД ПО ТОКУ
Если на электроде протекает несколькопараллельных электрохимических реакций, то I закон Фарадея будет справедлив для каждой из них.
Для практических целей, для того, чтобы учесть, какая доля тока или количества прошедшего через электрохимическую систему электричества расходуется на каждую конкретную реакцию введено понятие выхода вещества по току.
Таким образом, ВЫХОД ПО ТОКУ позволяет определить часть количества прошедшего через электрохимическую систему электричества, которая приходится на долю данной электрохимической реакции.
ВТ на практике чаще всего определяют делением практической массы вещества на теоретическую массу, определенную по закону Фарадея:

mпракт – масса вещества, практически превратившегося в результате прохождения определенного количества электричества;
mтеор - масса вещества, которая должна превратиться теоретически при прохождении того же количества электричества.
55. Коррозия металлов. Химическая и электрохимическая коррозия.
Коррозия – это самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
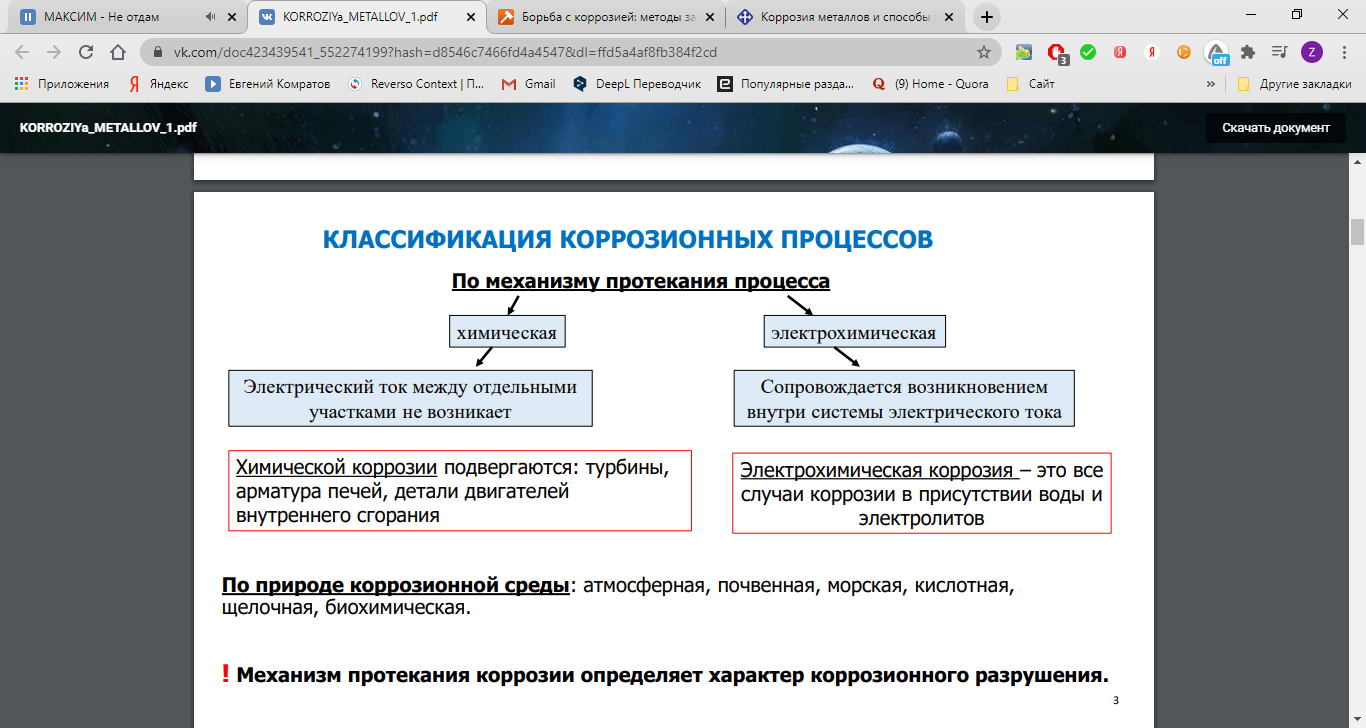
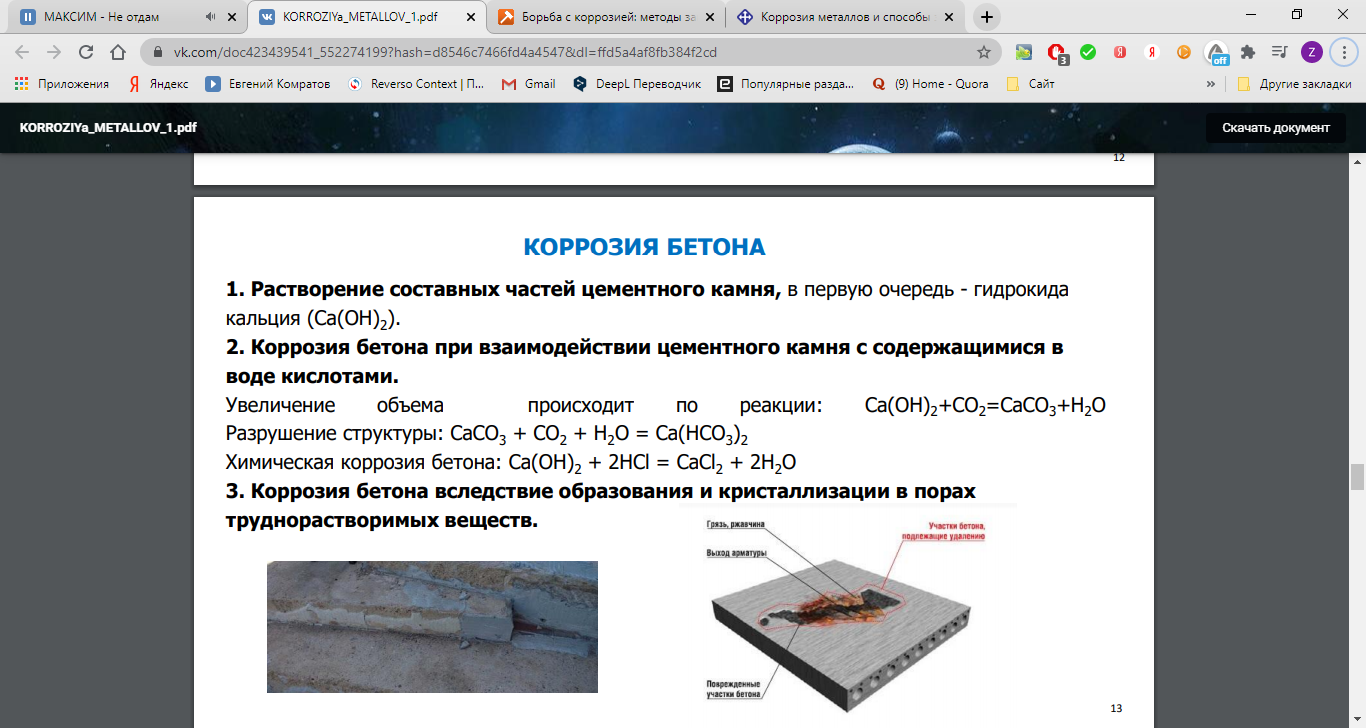
Различают два вида коррозии – химическую и электрохимическую. Химическая коррозия обусловлена взаимодействием металлов с веществами, содержащимися в окружающей среде. В производственных условиях такими веществами, помимо О2, являются SO2, CO2, H2S, NH3 и др.
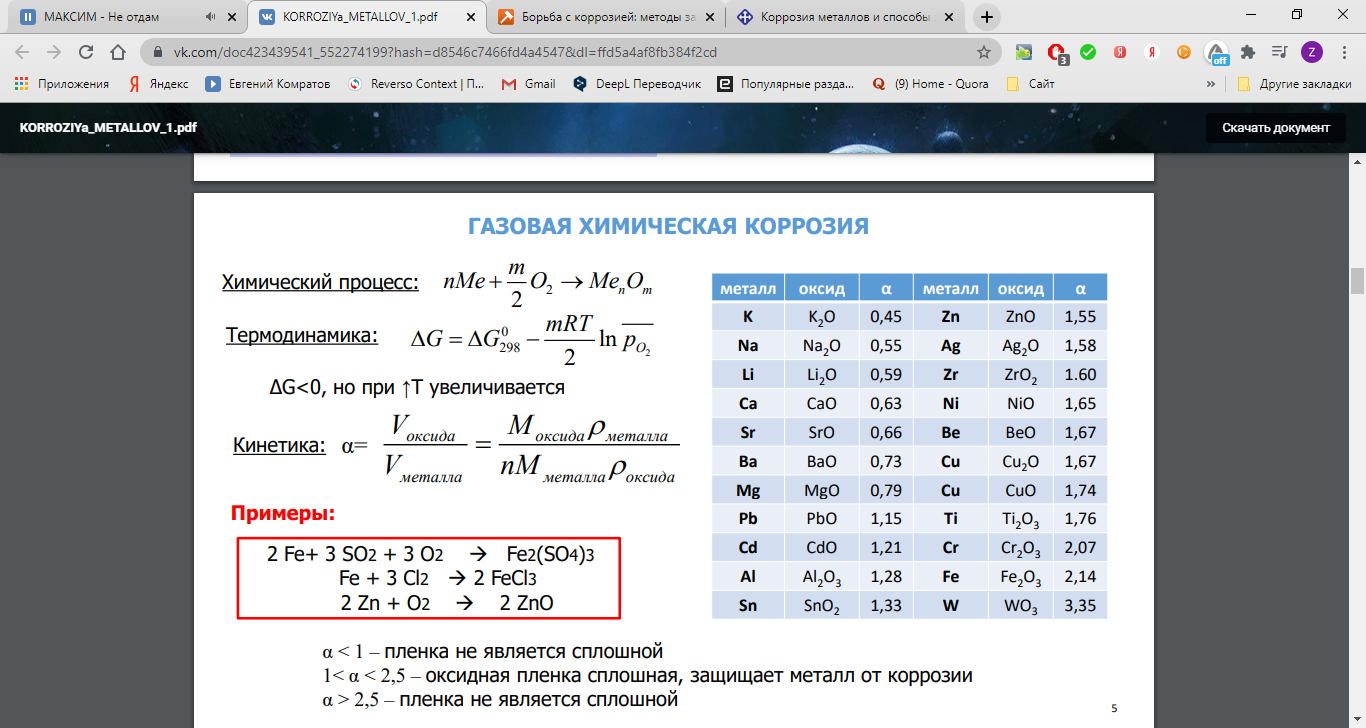
Химическую коррозию, обусловленную взаимодействием металлов с газами, называют газовой. Основной вклад в газовую коррозию металла вносит кислород воздуха. Различные металлы обладают различной устойчивостью по отношению к О2. Некоторые металлы (Al, Cr, Zn, Pb, Sn) образуют на воздухе плотные пленки оксидов, не разрушающиеся при изгибе или нагревании. Такие пленки защищают металл от дальнейшего доступа к нему газов и жидкостей, и процесс коррозии резко замедляется. Оксидные пленки других металлов (например, Fe) представляют собой рыхлые, пористые, механически непрочные образования. Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.
Процесс химической коррозии Fe схематически можно представить следующими уравнениями:
2Fe + O2=2FeO
4Fe + 3O2 = 2Fe2O3
3Fe + 2O2 =FeO · Fe2O3
4Fe + 3O2 +6H2O=4Fe(OH)3
Fe(OH)3=t H2O+FeOOH (ржавчина)
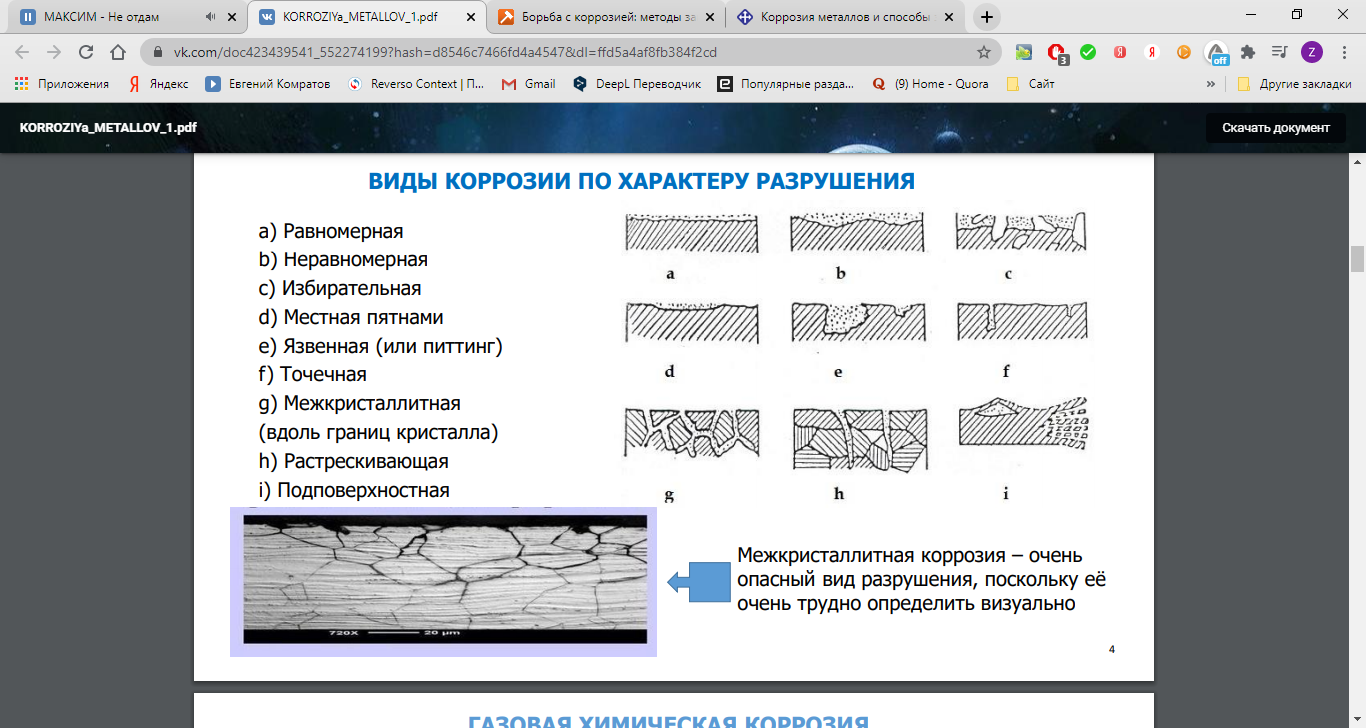
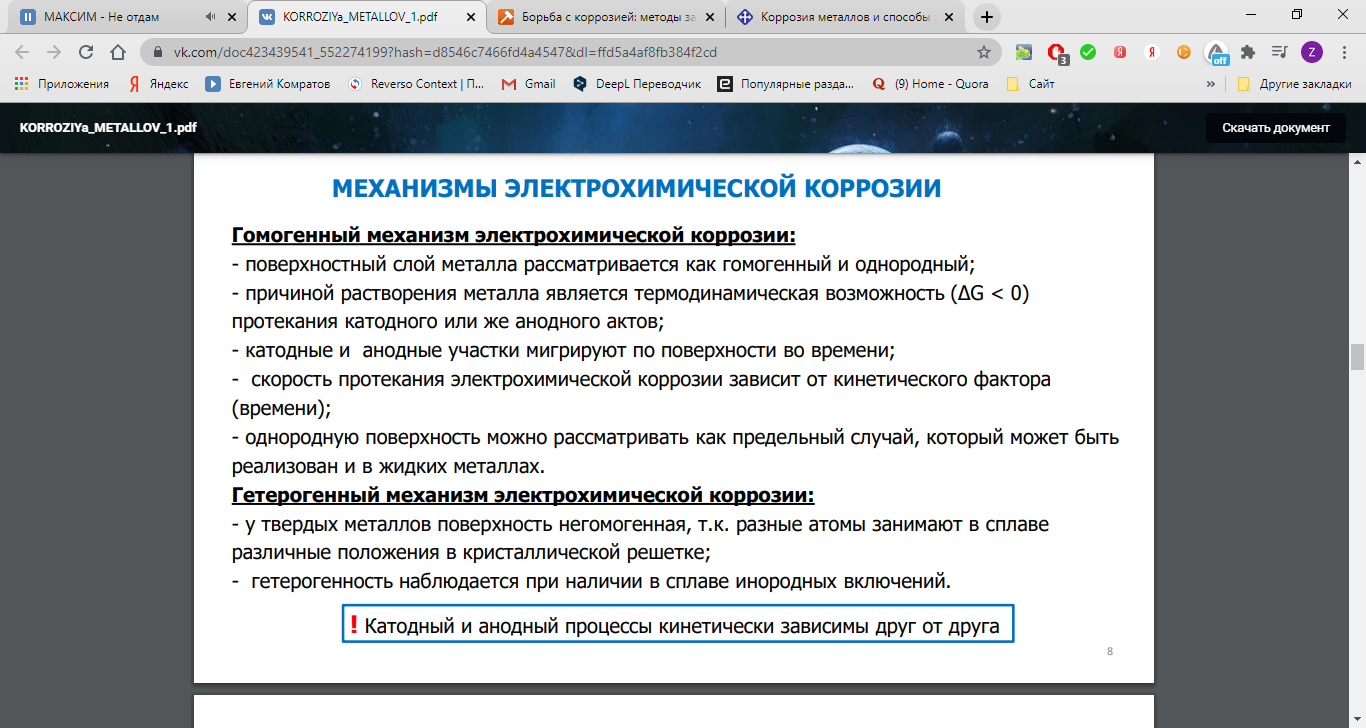
Однако наибольший вред приносит не химическая, а электрохимическая коррозия, связанная с переходом электронов от одних участков металла к другим. Химическая коррозия сопровождает электрохимическую и усиливает ее.
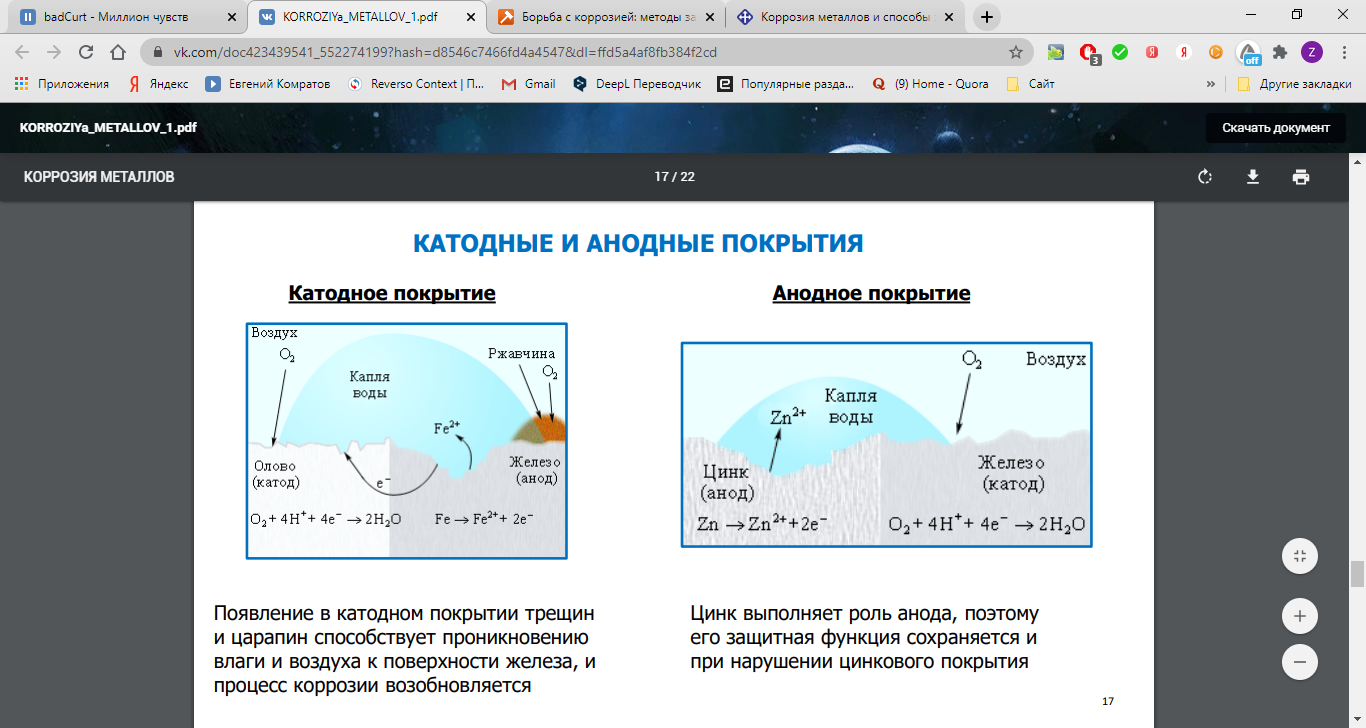
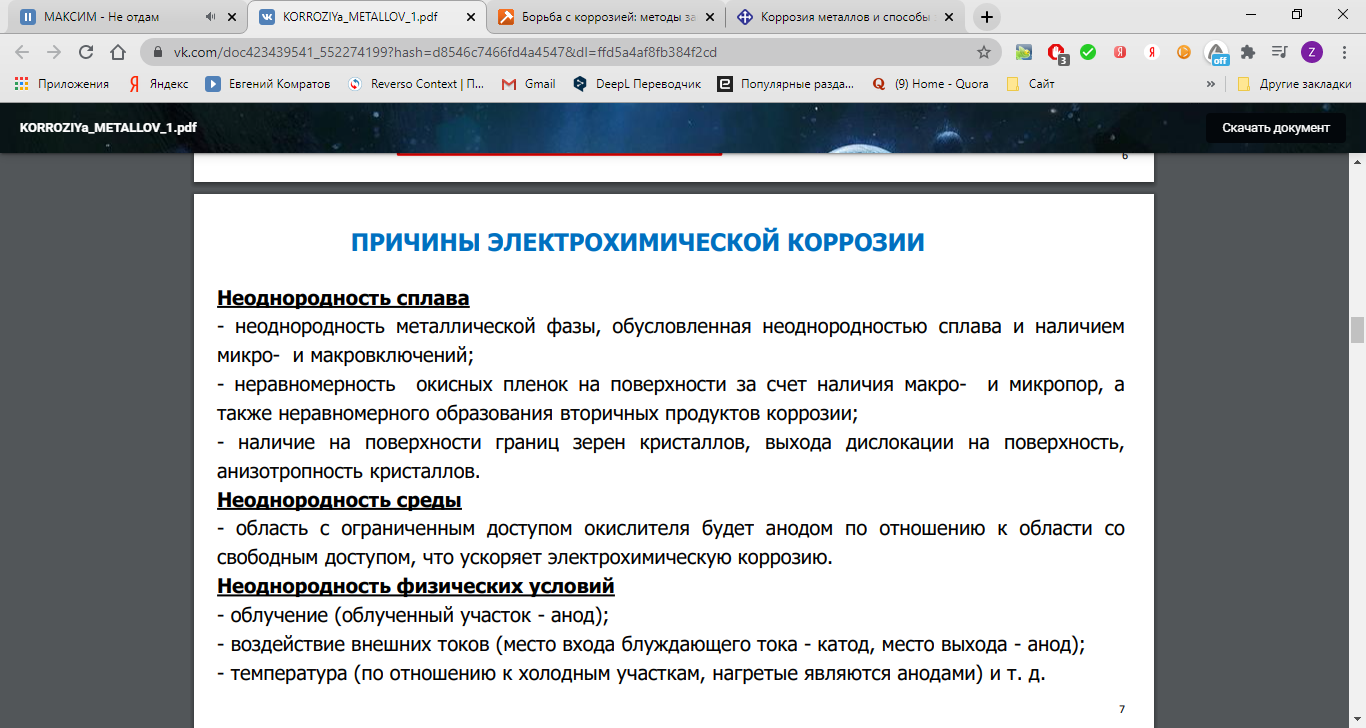
Сущность электрохимической коррозии
Металлы обычно содержат примеси других металлов и неметаллов. При соприкосновении таких металлов с электролитом (которым может служить Н2О, адсорбированная из воздуха, поскольку в ней как правило имеются ионы растворенных веществ) на поверхности металла возникает множество микрогальванических пар. В этих парах атомы более активного металла (обычно Fe) играют роль анода, а атомы менее активного – роль катода.
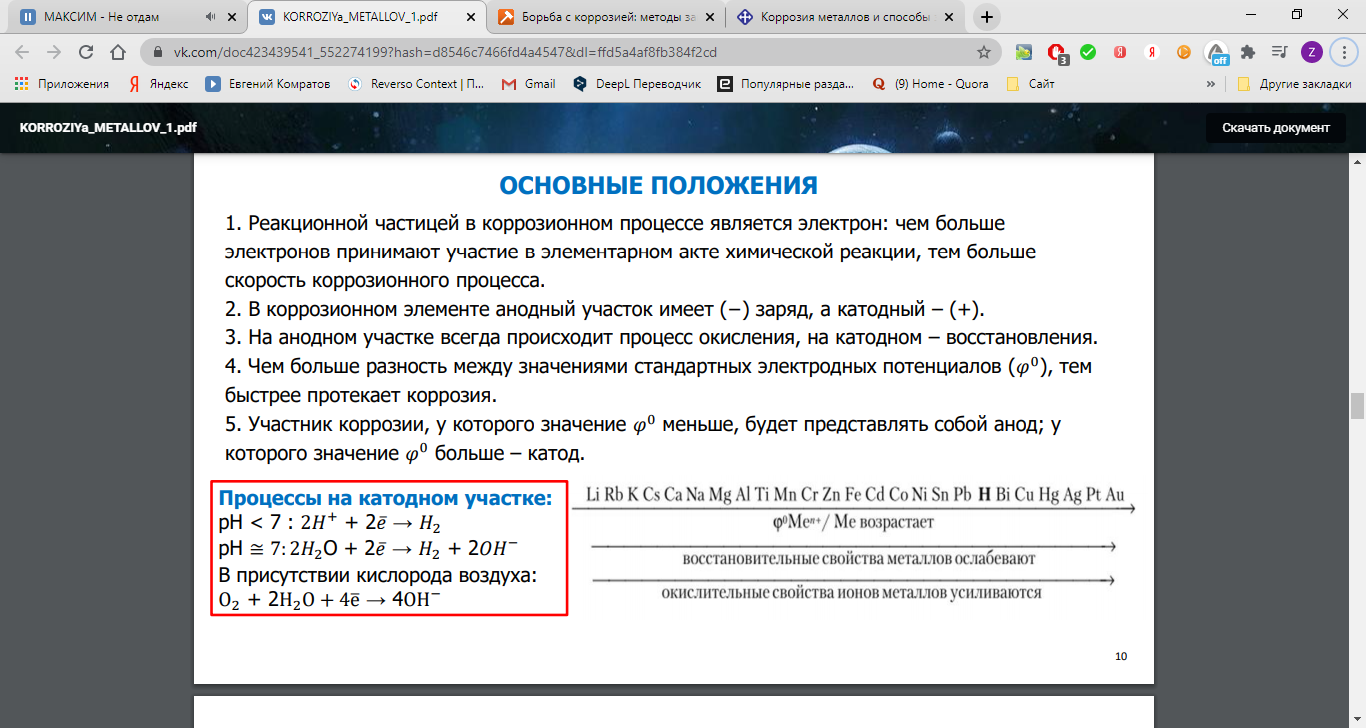
На катоде идет процесс восстановления молекул О2 в нейтральной и щелочной средах, или ионов Н+ – в кислой среде.
На аноде происходит окисление атомов металла, из которых состоит анод, с образованием катионов Meталлn+.
Последние переходят в электролит (растворение анода) и соединяются с ионами ОН–, с образованием гидроксида Meталл(OH)n и других продуктов. Называемых ржавчиной. В результате металл, играющий роль анода, разрушается.
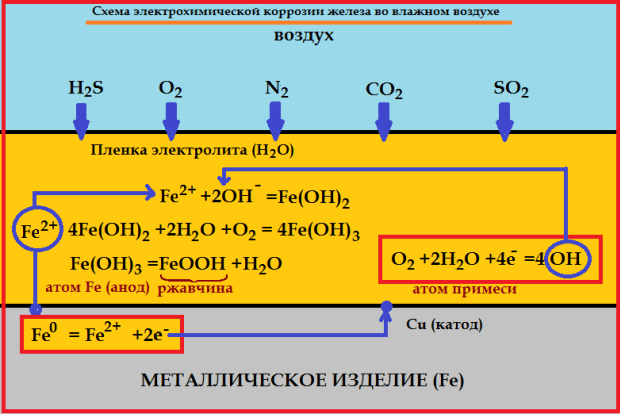
Скорость электрохимической коррозии тем больше, чем дальше друг от друга расположены металлы в ряду напряжений, и чем выше температура окружающей среды.
Чистые металлы устойчивы к коррозии. Однако, так как абсолютно чистымх металлов нет, а также вследствие того, что гальваническая пара может быть образована отдельными участками одного и того же металла, находящимися в различных условиях (под разными электролитами или под одним и тем же электролитом разной концентрации), то электрохимическая коррозия имеет место всегда при соприкосновении металла с электролитом (атмосферной влагой).
Роль катода при электрохимической коррозии могут выполнять не только менее активные металлы, но и примеси неметаллов, способных принимать электроны.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ ИЗ ЛЭТИшной ПРЕЗЕНТАЦИИ





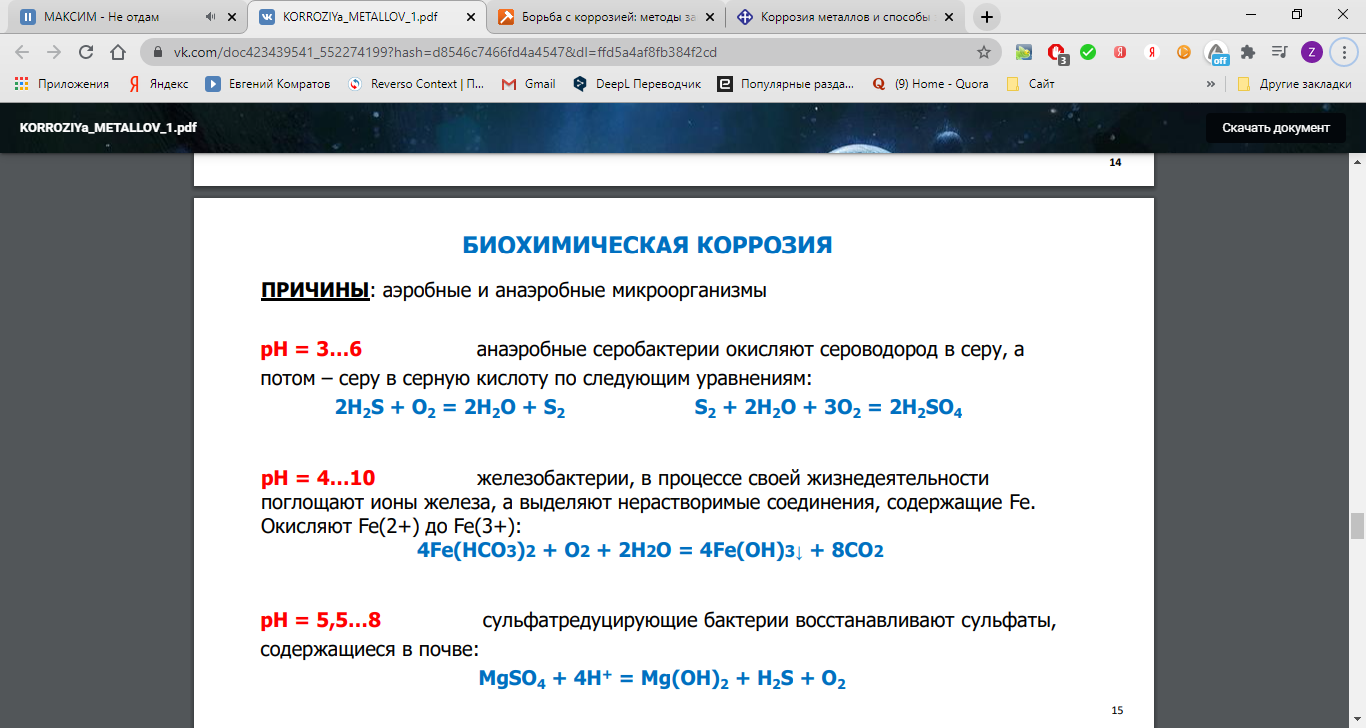
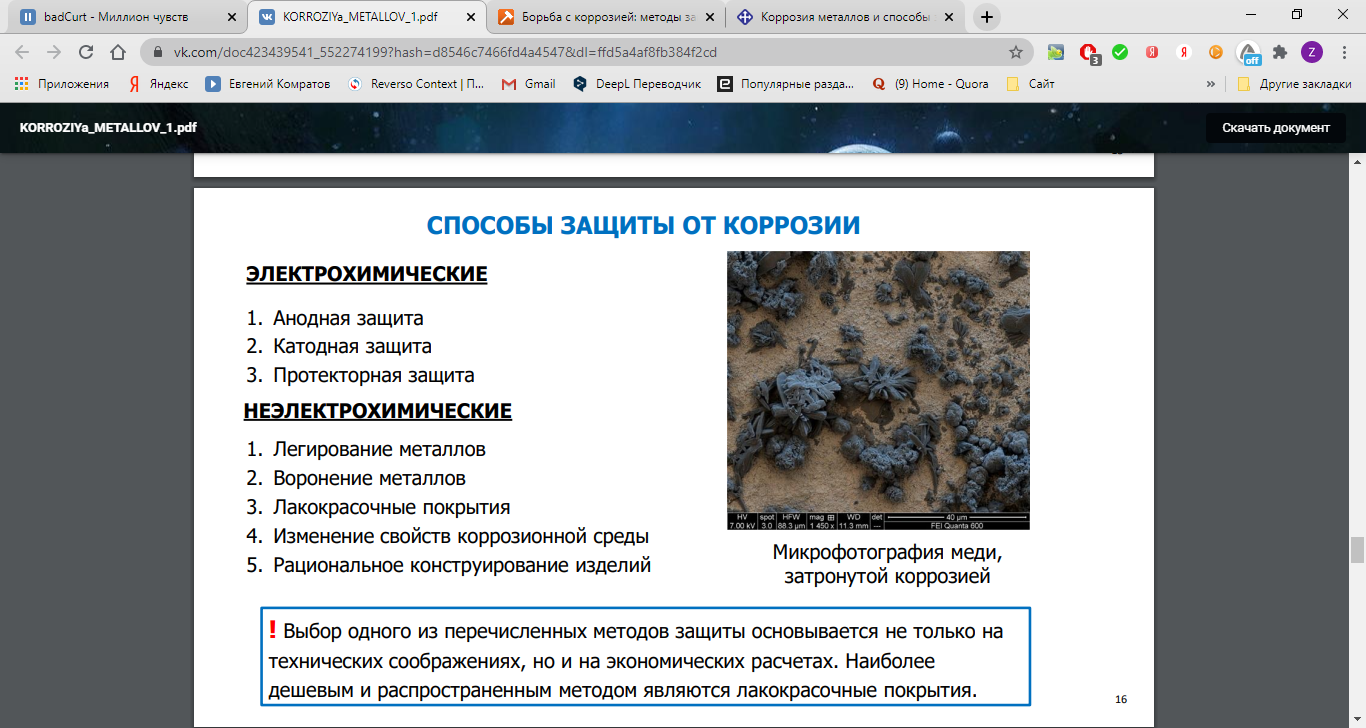
56.Основные методы борьбы с коррозией. Почвенная коррозия.
Защита от коррозии:
1). Металлические покрытия – анодное (покрытие более активным металлом Zn, Cr) – оцинкованное железо; катодное (покрытие менее активным металлом Ni, Sn, Ag, Au) – белая жесть (лужёное железо) – не защищает от разрушения в случае нарушения покрытия.
2). Неметаллические покрытия – органические (лаки, краски, пластмассы, резина - гумирование, битум); неорганические (эмали).
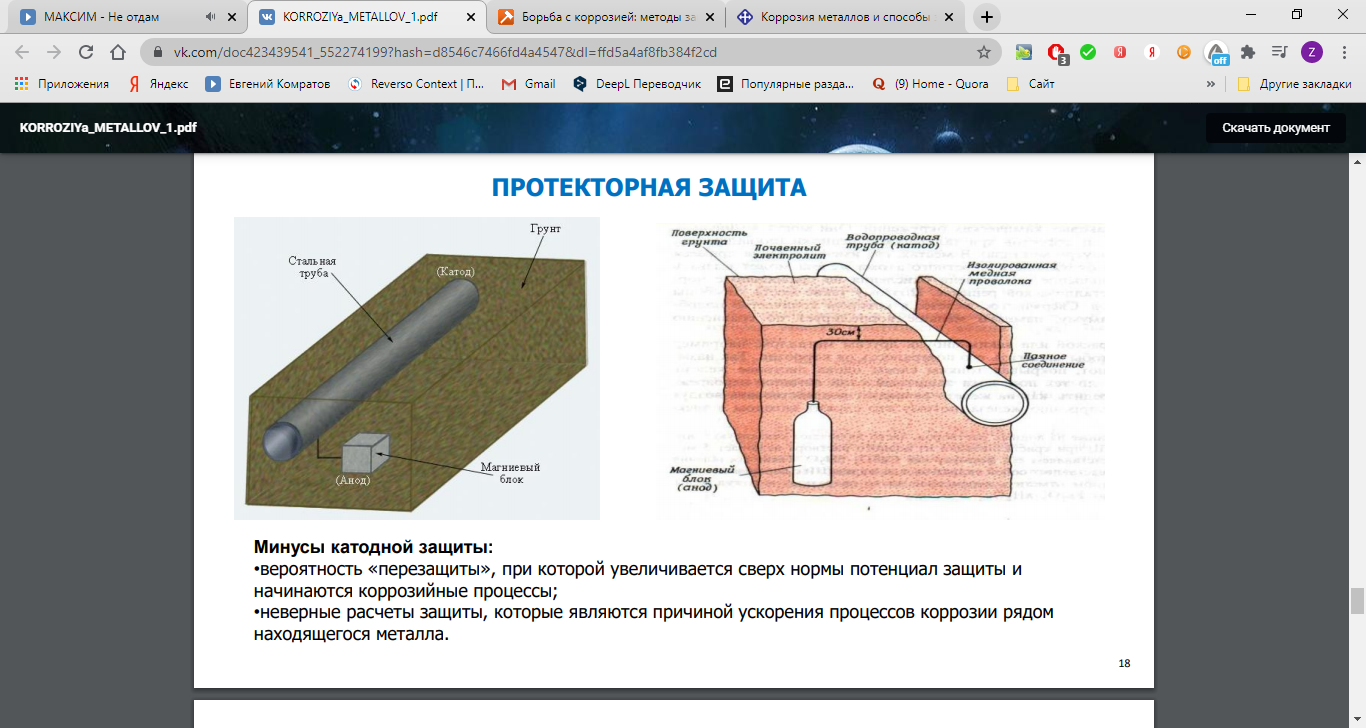
3). Протекторная защита – присоединение пластины из более активного металла (Al, Zn, Mg) – защита морских судов.
4). Электрохимическая (катодная) защита – соединение защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Ток идёт в противоположном направлении.
5). Добавление ингибиторов (в зависимости от природы металла – NaNO2, Na3PO4, хромат и бихромат калия, ВМС органические соединения), адсорбируются на поверхности металла и переводят его в пассивное состояние.