
15 Вопрос
Валентность и степень окисления. Способы определения степени окисления. Основные окислители и восстановители. Уравнять окислительно-восстановительную реакцию ионно-электронным методом.
Валентность – это способность атомов присоединять к себе определенное число других атомов.
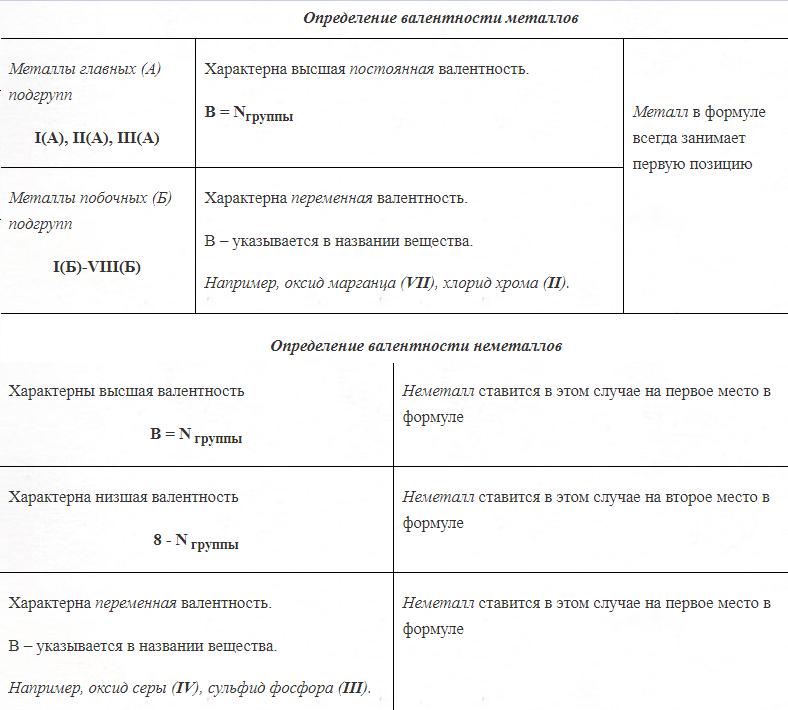
Валентность – определяется номером группы (число химических связей в структурной формуле вещества).
Правила определения валентности элементов в соединениях
1. Валентность водорода принимают за I (единицу).
2. Кислород в своих соединениях проявляет валентность II.
3. Высшая валентность равна номеру группы Nгруппы (исключения, N, O, F - для этих элементов характерна только низшая валентность).
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 - Nгруппы
Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные.
F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион - анион)
Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион - катион)
Правила определения степени окисления атома в периодической системе химических элементов Д.И. Менделеева:
1. Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me+nHn-1)
2. Кислород обычно проявляет СО -2 (исключения: О+2F2, H2O2-1 – перекись водорода)
3. Металлы проявляют только +n положительную СО
4. Фтор проявляет всегда СО равную -1 (F-1)
5. Для элементов главных подгрупп:
Высшая СО (+) = номеру группы Nгруппы
Низшая СО (-) = Nгруппы–8
Правила определения степени окисления атома в соединении:
I. Степень окисления свободных атомов и атомов в молекулах простых веществ равна нулю - Na0, P40, O20
II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0, а в сложном ионе его заряду.
Важнейшие восстановители:
металлы;
водород H2;
уголь C;
оксид углерода(II) CO;
сероводород H2S, сульфиды K2S;
галогеноводороды HI, HBr;
аммиак NH3.
Важнейшие окислители:
галогены F2, Cl2;
кислород O2, озон O3;
соединения марганца KMnO4;
азотная кислота HNO3 и её соли KNO3;
концентрированная серная кислота H2SO4;
ионы металлов.
Метод электронного баланса
В его основе лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители.
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
Сначала необходимо составить схему реакции: записать вещества в начале и конце реакции, учитывая, что в кислой среде MnO4— восстанавливается до Mn2+:
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
Далее определим какие из соединений являются окислителем и восстановителем; найдем их степень окисления в начале и конце реакции:
Na2S+4O3 + KMn+7O4 + H2SO4 = Na2S+6O4 + Mn+2SO4 + K2SO4 + H2O
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6, таким образом, S+4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn+7 принимает 5 электронов и является окислителем.
Составим электронные уравнения и найдем коэффициенты при окислителе и восстановителе.
S+4 – 2e— = S+6 ¦ 5 восстановитель, процесс окисления
Mn+7 +5e— = Mn+2 ¦ 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn+7, ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S+4 коэффициентом перед окислителем:
5Na2S+4O3 + 2KMn+7O4 + H2SO4 = 5Na2S+6O4 + 2Mn+2SO4 + K2SO4 + H2O
Далее надо уравнять количества атомов элементов, не изменяющих степень окисления, в такой последовательности: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO42-, из которых 5 – за счет превращения 5SO32- → 5SO42-, а 3 – за счет молекул серной кислоты 8SO42-— 5SO42- = 3SO42-.
Таким образом, серной кислоты надо взять 3 молекулы:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + H2O
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H+ + 3O-2 = 3H2O
Окончательный вид уравнения следующий:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
