
- •42 Константа диссоциации. Закон разведения Оствальда.
- •43 Сильные электролиты. Понятие активности и коэффициента активности. Ионная сила раствора.
- •44 Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •45 Гидролиз солей. Константа и степень гидролиза.
42 Константа диссоциации. Закон разведения Оствальда.
Количественно электролитическую диссоциацию как равновесный обратимый процесс можно охарактеризовать константой диссоциации (ионизации), определяемой законом действующих масс. Если рассматривать электролитическую диссоциацию как равновесный обратимый процесс, диссоциацию электролита Kt„Anw (Kt+ - катион, Ап" - анион) можно представить в виде
![]()
Согласно закону действующих масс константу равновесия, называемую константой диссоциации, записывают следующим образом:

где [Kt" ] и [Апл ] - молярные равновесные концентрации ионов электролита; [Kt„Anm] - молярная равновесная концентрация недиссоциированных молекул электролита; Ка - константа диссоциации (моль/л).
Например, для диссоциации уксусной кислоты СН3СООН
![]()

константа диссоциации равна
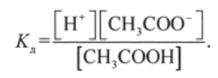
Уравнение (8.3) справедливо лишь для разбавленных растворов слабых электролитов. При использовании его для концентрированных растворов и растворов сильных электролитов уравнение (8.3) нужно видоизменить.
Чем больше константа диссоциации /Гд, тем сильнее диссоциирует электролит. В отличие от степени диссоциации Кя зависит только от природы растворителя, электролита и температуры, но практически не зависит от концентрации раствора (табл. 8.4). Таким образом, и константа Кау и степень электролитической диссоциации аи - количественные характеристики диссоциации. Естественно, что между ними существует связь.
Пусть имеется диссоциирующий на два иона слабый бинарный электролит KtAn, молярная концентрация которого с(Х), а степень диссоциации а„. В растворе этого электролита установится равновесие.
Применив закон действующих масс к ионному равновесию
![]()
получают выражение для Кл:
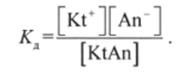
Подставив выражения для концентраций через степень диссоциации а„, получают:

Это соотношение называют законом разведения Оствальда (1888).
Уравнение (8.4) выражает зависимость степени диссоциации от концентрации раствора. Если электролит очень слабый, а„ « 1. Следовательно, величиной а„ в знаменателе можно пренебречь и уравнение (8.4) примет вид

Соответственно закон Оствальда может быть сформулирован следующим образом.
Степень диссоциации слабого электролита возрастает с разбавлением раствора.
Сильные электролиты не подчиняются этому закону. Для них КД не является постоянной величиной и зависит от концентрации раствора (сильные электролиты не подчиняются закону действующих масс).
43 Сильные электролиты. Понятие активности и коэффициента активности. Ионная сила раствора.
В растворах сильных электролитов в результате их практически полной диссоциации создается высокая концентрация ионов.
Между катионами и анионами возникает электростатическое притяжение и эффективная, (то есть экспериментально определенная) концентрация этих ионов оказывается меньше, чем их истинная концентрация.
Для
оценки способности ионов к химическому
взаимодействию в растворах сильных
электролитов используют понятие -
активности ( ![]() ).
).
Активностью иона называют эффективную или условную концентрацию его, соответственно которой он действует в химических реакциях.
Между
активностью иона (
)
и его действительной концентрацией
( ![]() )
существует зависимость
)
существует зависимость
![]() ,
,
где ![]() -
коэффициент активности;
-
коэффициент активности; ![]() таким
образом, коэффициент
активности - это
отношение активности иона к его общей
концентрации. Так как
таким
образом, коэффициент
активности - это
отношение активности иона к его общей
концентрации. Так как ![]() ,
то
,
то ![]() ,
поэтому при точных расчетах в уравнение
закона действующих масс должны входить
активности ионов, а не их концентрации.
Если диссоциацию электролита изобразить
схемой
,
поэтому при точных расчетах в уравнение
закона действующих масс должны входить
активности ионов, а не их концентрации.
Если диссоциацию электролита изобразить
схемой
![]() ,-
,-
то
константа диссоциации ![]() будет
выражаться следующим образом:
будет
выражаться следующим образом:
![]()
В этом случае называют термодинамической константой.
Понятие
активности применимо не только к
отдельным ионам, но и к электролиту в
целом. Для электролита ![]() средняя
активность и средний коэффициент
активности связаны с активностями и
коэффициентами активности катионов
средняя
активность и средний коэффициент
активности связаны с активностями и
коэффициентами активности катионов ![]() и
анионов
и
анионов ![]() следующими
соотношениями:
следующими
соотношениями:
![]()
![]()
Коэффициенты
активности ионов зависят не только от
концентрации сильного электролита, но
и от концентрации всех других ионов,
присутствующих в растворе. Мерой
электростатического взаимодействия
между ионами является ионная
сила раствора- ![]() ,
которая вычисляется по формуле:
,
которая вычисляется по формуле:
![]()
где ![]() концентрации
различных ионов, моль/л;
концентрации
различных ионов, моль/л;
![]() заряды
этих ионов.
заряды
этих ионов.
