53.Сильные
электролиты. Понятие активности и
коэффициента активности. Электролиты
– вещества, которые в растворе или
расплаве состоят полностью или частично
из ионов. Они не подчиняются законам
Рауля: их растворы замерзают при более
низких температурах, а кипят при более
высоких температурах, чем растворы
неэлектролитов той же моляльной
концентрации. По способности диссоциации
электролиты делятся на слабые
и сильные.
Сильные диссоциируют полностью –
процесс необратим. Процесс диссоциации
слабых обратим (в растворах содержатся
как ионы, так и недиссоциированные
молекулы).Сильные
электролиты не только в разбавленных,
но и в концентрированных растворах
диссоциируют практически нацело
.Степень
диссоциации примерно равна 1.Если
условно взять какой-либо ион за центр
и провести вокруг сферу произвольного
радиуса, можно заметить, что каждый
ион окружается как бы роем других
ионов – ионной
атмосферой.
Ионная
атмосфера препятствует передвижению
ионов в растворе, что приводит к
уменьшению электропроводимости
раствора. Разбавление увеличивает
расстояния между ионами, уменьшает
их взаимодействие, что приводит к
увеличению электропроводности за
счет роста скорости ионов, а не за счет
роста степени диссоциации. Для растворов
сильных электролитов введено понятие
активности
(или активной концентрации). Активность
– величина, подстановка которой вместо
концентрации в термодинамические
уравнения, действительные для идеальных
систем, позволяет использовать их для
реальных систем.
|
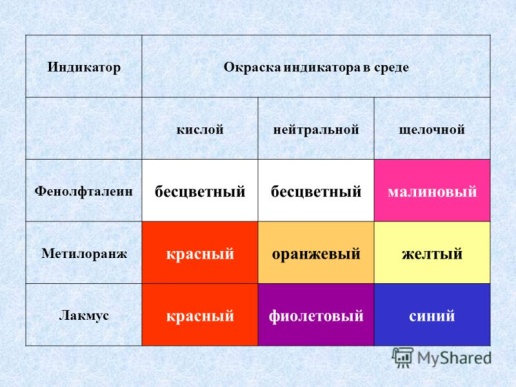
54.Электролитическая
диссоциация воды. Ионное произведение
воды. Водородный показатель. Понятие
об индикаторах. Электролиты
– вещ-ва, которые в растворе или
расплаве состоят полностью или частично
из ионов. Они не подчиняются законам
Рауля: их растворы замерзают при более
низких темп-рах, а кипят при более
высоких темп-рах. Электролитическая
диссоциация. Теорию
ЭД предложил шведский ученый Аррениус.
«Электролиты, растворяясть в воде,
распадаются на ионы (заряженные
частицы). При этом каждый ион ведет
себя как самост. частица. В результате
диссоциации концентрация
увелич-ся).»Академик Каблуков дополнил
теорию ЭД: «основная причина диссоциации
на ионы – взаимодействие с полярными
молекулами воды». Согласно закону
Кулона, сила притяжения между зарядами
|
55.Гидролиз солей. Константа и степень гидролиза. Гидролиз - разложение солей под действием воды. Вторая формулировка. Процесс, обратный нейтрализации, приводящий к образованию кислоты и основания. Нейтрализация – реакция между кислотой и основанием.1. Гидролиза нет -если сильное основание и сильная кислота. -если нерастворимые вещества («н» в таблице).
Пример.
2. Полный гидролиз -если слабая кислота и слабое основание. -если «-» в таблице растворимости.
Пример.
-если сильное основание и слабая кислота. -если слабое основание и сильная кислота.
Пример.
Константа
гидролиза:
Степень гидролиза – применяется для характеристики реакций гидролиза.
Степень возрастает с ростом температуры и с уменьшением концентрации (разбавлением).
|