3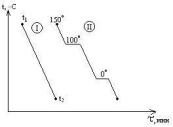
 5.Сущность
термографического анализа. Кривые
нагревания и охлаждения.Термографический
анализ
– кривые нагревания или кривые
охлаждения системы. Диаграммы плавкости
(частный вид диагарамм состояния)
строят исходя из кривых охлаждения,
которые изображаются в координатах:
температура(Оу), время(Ох). Рассмотрим
кривые
охлаждения
двух систем. Система I
в интервале t1-t2
не испытывает никаких фазовых
превращений, температура меняется
монотонно. Кривая II
отвечают охлаждению воды от 150
o
C
(пар при атмосферном давлении) до 0
o
C
и ниже. При 100
o
C
наблюдается горизонтальный участок,
отвечающий фазовому переходу –
процессу конденсации пара, температура
поддерживается низменной, пока не
исчезнет весь пар. Постоянство
температуры обеспечивается за счёт
выделения в процессе конденсации пара
теплоты испарения воды. От 100
o
C
до 0
o
C
наблюдается монотонный ход кривой
охлаждения – остывает жидкая вода.
При 0
o
C
наблюдается второй горизонтальный
участок, отвечающий фазовому переходу
– процессу кристаллизации. Температура
поддерживается постоянной за счет
выделения теплоты плавления.Рассмотрим
кривые
охлаждения
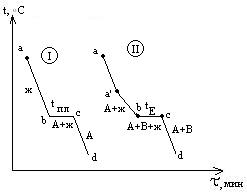
чистого металла (I)
и сплава с так называемой эвтектикой
(II).
На кривой охлаждения (I)
чистого металла А наблюдается одна
площадка bc,
отвечающая процессу кристаллизации
металла. При
tпл
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Образование
твердой фазы сопровождается выделением
теплоты плавления.Кривая II
отвечает охлаждению сплава А-В. От “а”
до “a’
“ температура меняется монотонно,
остывает жидкая фаза. При достижении
точки a’
из жидкой фазы начинают выпадать
кристаллы А – одного из компонентов
сплава, при этом жидкая фаза за счет
этого начнет обогащаться компонентом
В. Таким образом, в интервале a’-b
в равновесии находятся жидкая
и твердая фазы различного состава,
площадки на кривой охлаждения не
наблюдается. За счет выделения при
кристаллизации А теплоты плавления
этого компонента темп охлаждения
сплава замедляется, и на кривой
наблюдается перелом. Выпадение
кристаллов А продолжается до тех пор,
пока жидкая фаза не достигнет так
называемого “эвтектического состава”.
Основной особенностью эвтектического
сплава является то, что он кристаллизуется
подобно чистому компоненту – на кривой
охлаждения наблюдается площадка. Из
жидкой фазы одновременно выпадают
кристаллы А и В и, таким образом при
tЕ
(отрезок bc)
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Отрезок
cd
отвечают охлаждению твердого
сплава.Остановки в падении температуры
могут наблюдаться и на кривой охлаждения
уже твердого металла, указываю на
переходы металла из одной аллотропной
формы в другую.
5.Сущность
термографического анализа. Кривые
нагревания и охлаждения.Термографический
анализ
– кривые нагревания или кривые
охлаждения системы. Диаграммы плавкости
(частный вид диагарамм состояния)
строят исходя из кривых охлаждения,
которые изображаются в координатах:
температура(Оу), время(Ох). Рассмотрим
кривые
охлаждения
двух систем. Система I
в интервале t1-t2
не испытывает никаких фазовых
превращений, температура меняется
монотонно. Кривая II
отвечают охлаждению воды от 150
o
C
(пар при атмосферном давлении) до 0
o
C
и ниже. При 100
o
C
наблюдается горизонтальный участок,
отвечающий фазовому переходу –
процессу конденсации пара, температура
поддерживается низменной, пока не
исчезнет весь пар. Постоянство
температуры обеспечивается за счёт
выделения в процессе конденсации пара
теплоты испарения воды. От 100
o
C
до 0
o
C
наблюдается монотонный ход кривой
охлаждения – остывает жидкая вода.
При 0
o
C
наблюдается второй горизонтальный
участок, отвечающий фазовому переходу
– процессу кристаллизации. Температура
поддерживается постоянной за счет
выделения теплоты плавления.Рассмотрим
кривые
охлаждения
чистого металла (I)
и сплава с так называемой эвтектикой
(II).
На кривой охлаждения (I)
чистого металла А наблюдается одна
площадка bc,
отвечающая процессу кристаллизации
металла. При
tпл
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Образование
твердой фазы сопровождается выделением
теплоты плавления.Кривая II
отвечает охлаждению сплава А-В. От “а”
до “a’
“ температура меняется монотонно,
остывает жидкая фаза. При достижении
точки a’
из жидкой фазы начинают выпадать
кристаллы А – одного из компонентов
сплава, при этом жидкая фаза за счет
этого начнет обогащаться компонентом
В. Таким образом, в интервале a’-b
в равновесии находятся жидкая
и твердая фазы различного состава,
площадки на кривой охлаждения не
наблюдается. За счет выделения при
кристаллизации А теплоты плавления
этого компонента темп охлаждения
сплава замедляется, и на кривой
наблюдается перелом. Выпадение
кристаллов А продолжается до тех пор,
пока жидкая фаза не достигнет так
называемого “эвтектического состава”.
Основной особенностью эвтектического
сплава является то, что он кристаллизуется
подобно чистому компоненту – на кривой
охлаждения наблюдается площадка. Из
жидкой фазы одновременно выпадают
кристаллы А и В и, таким образом при
tЕ
(отрезок bc)
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Отрезок
cd
отвечают охлаждению твердого
сплава.Остановки в падении температуры
могут наблюдаться и на кривой охлаждения
уже твердого металла, указываю на
переходы металла из одной аллотропной
формы в другую.
Диаграмма
состояния системы - диаграмма,
указывающая, в каких фазовых состояниях
находится система в зависимости от
условий: температура, давление и
состав.Диаграммы плавкости – частный
вид диаграмм состояния.Курнаков
сформулировал 2 принципа, устанавливающих
связь геометрических образов диаграммы
с химическим состоянием системы.1.
Принцип непрерывности.При непрерывном
изменении температуры, давления,
концентрации свойства отдельных фаз
системы меняются также непрерывно.
Свойства системы в целом изменяются
непрерывно лишь до тех пор, пока не
изменится число или характер ее фаз.
При появлении новых или исчезновении
имеющихся фаз свойства системы в целом
меняются скачком.2. Принцип
соответствия.Каждой совокупности
фаз, находящихся в равновесии в данной
системе, отвечает на диаграмме
определенный геометрический образ.В
двухкомпонентной системе одной фазе
на диаграмме соответствует участок
плоскости, кристаллизации твердой
фазы- кривая начала кристаллизации,
равновесию между тремя фазами - точка
пересечения кривых, и т.д.
|
|
64(3).Основные
принципы построения диаграммы плавкости
бинарных систем. Диаграмма состояния
системы
- диаграмма, указывающая, в каких
фазовых состояниях находится система
в зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Курнаков
сформулировал 2 принципа, устанавливающих
связь геометрических образов диаграммы
с химическим состоянием системы.1.
Принцип непрерывности.При
непрерывном изменении температуры,
давления, концентрации свойства
отдельных фаз системы меняются также
непрерывно. Свойства системы в целом
изменяются непрерывно лишь до тех
пор, пока не изменится число или
характер ее фаз. При появлении новых
или исчезновении имеющихся фаз свойства
системы в целом меняются скачком.2.
Принцип соответствия.Каждой
совокупности фаз, находящихся в
равновесии в данной системе, отвечает
на диаграмме определенный геометрический
образ.В двухкомпонентной системе
одной фазе на диаграмме соответствует
участок плоскости, кристаллизации
твердой фазы- кривая начала кристаллизации,
равновесию между тремя фазами - точка
пересечения кривых, и т.д.
|
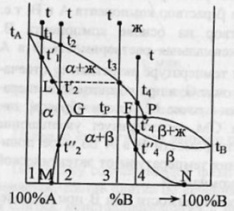
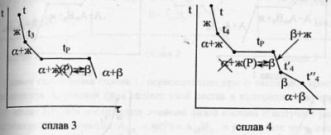 38.
Диаграмма плавкости бинарной системы
с ограниченными твердыми растворами.
Диаграмма состояния системы
- диаграмма, указывающая, в каких
фазовых состояниях находится система
в зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Для
данных систем характерны полная
взаимная растворимость компонентов
в жидком состоянии и ограниченная - в
твердом. Если твердые растворы образуют
эвтектику,
то точка нонвариантного равновесия
Е лежит ниже t
плавления чистых компонентов,если же
перитектику,то
нонвариантная точка P
лежит между t
плавления чистых компонентов.Пример.
Cu-Ag,Pb-Sn;
Hg-Cd.Рассмотрим
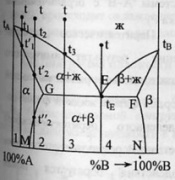
первый случай.Система А-В с
ограничен.тв.р-рами- с эвтектикой.
В системе имеется 2 твердых раствора:
α - р-р компонентов В в А и β- р-р компонента
А в В.Max
растворимость В в А при t
эвтектики tЕ
отвечает точке G,
а при комнат.t
– точке M.
Линия GM
характеризует уменьшение растворимости
В в А по мере понижения t
от эвтектич-й до комнат-й.Линия
FN-снижение
растворимости А в В при понижении t
от tЕ
до
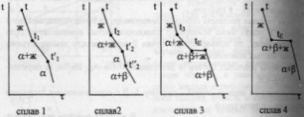
комнат-й.Кривые охлаждения 4
сплавов:1,2,3,4.На кривой охлаждения
сплава
1
имееются 2 перегиба,отвечающих началу
и концу выделения кристаллов тв.р-ра
α.На кривой охлаждения сплава
2
дополнительно наблюдается слабо
выраженный перегиб при t”2,отвечающий
частичному распаду в тв.состоянии
кристаллов α с выделением кристаллов
тв.р-ра β. Кривая охлаждения сплава
3:
при t3
из жид.фазы выделяются кристаллы
тв.р-ра α,жид.фаза при понижении от t3
до
tЕ
меняет свой состав по линии
t3Е,т.е.обогащается
компонентом В.Как только жид.фаза
достигнет состава Е,начинается
кристаллизация эвтектики-мех.смеси
2 тв.фаз-тв.р-ра α состава G
и тв.р-ра β состава F,на
кривой охлаждения наблюдается
площадка.Сплав
4
точно отвечает эвтектич.составу,кривая
охлаждения его подобна кривой охлаждения
чистого компонента. Система А-В с
ограничен.тв.р-рами- с перитектикой(т.Р).
Перитектическое превращение-результат
химического взаимодействия ранее
выпавшей тв.фазы с жид.фазой определенного
(перитектического) состава.В результате
этого взаимодействия образуется новая
тв.фаза.Кривые охлаждения 4 сплавов-1,2,3,4.
Кривые охлаждения 1 и 2 полностью похожи
на эвтектические.Кривая
охлаждения 3:в
интервале t
от t
до t3
идет охлаждение жид.фазы,и t
изменяется монотонно.При t3
из жид.фазы выпадают кристаллы тв.р-ра
α, на кривой охлаждения-перегиб.В
интервале t3-tP
жид.фаза меняет свой состав по линии
t3Е,а
тв.фаза по линии LG.Как
только жид.фаза достигнет состава
P(перитектического),получает
развитие перитектическая реакция.В
результате этой реакции исчезает
жид.фаза и ниже tP
наблюдается смесь 2 тв.фаз-тв.р-ров α
и β.На кривой охлаждения наблюдается
площадка,т.к. имеет место нонвариантное
превращение:С=К-Ф+1=2-3+1=0.Для сплава
4
при tP
в результате перитектической реакции
исчезает тв.р-ра α.В интервале tP
–t’4
из жид.фазы выпадают кристаллы тв.р-ра
β. От t’4
до t”4
происходит охлпждение тв.фазы β, а при
t”4
тв.р-р β частично распадается-с
выделением кристаллов тв.р-ра α.
38.
Диаграмма плавкости бинарной системы
с ограниченными твердыми растворами.
Диаграмма состояния системы
- диаграмма, указывающая, в каких
фазовых состояниях находится система
в зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Для
данных систем характерны полная
взаимная растворимость компонентов
в жидком состоянии и ограниченная - в
твердом. Если твердые растворы образуют
эвтектику,
то точка нонвариантного равновесия
Е лежит ниже t
плавления чистых компонентов,если же
перитектику,то
нонвариантная точка P
лежит между t
плавления чистых компонентов.Пример.
Cu-Ag,Pb-Sn;
Hg-Cd.Рассмотрим
первый случай.Система А-В с
ограничен.тв.р-рами- с эвтектикой.
В системе имеется 2 твердых раствора:
α - р-р компонентов В в А и β- р-р компонента
А в В.Max
растворимость В в А при t
эвтектики tЕ
отвечает точке G,
а при комнат.t
– точке M.
Линия GM
характеризует уменьшение растворимости
В в А по мере понижения t
от эвтектич-й до комнат-й.Линия
FN-снижение
растворимости А в В при понижении t
от tЕ
до
комнат-й.Кривые охлаждения 4
сплавов:1,2,3,4.На кривой охлаждения
сплава
1
имееются 2 перегиба,отвечающих началу
и концу выделения кристаллов тв.р-ра
α.На кривой охлаждения сплава
2
дополнительно наблюдается слабо
выраженный перегиб при t”2,отвечающий
частичному распаду в тв.состоянии
кристаллов α с выделением кристаллов
тв.р-ра β. Кривая охлаждения сплава
3:
при t3
из жид.фазы выделяются кристаллы
тв.р-ра α,жид.фаза при понижении от t3
до
tЕ
меняет свой состав по линии
t3Е,т.е.обогащается
компонентом В.Как только жид.фаза
достигнет состава Е,начинается
кристаллизация эвтектики-мех.смеси
2 тв.фаз-тв.р-ра α состава G
и тв.р-ра β состава F,на
кривой охлаждения наблюдается
площадка.Сплав
4
точно отвечает эвтектич.составу,кривая
охлаждения его подобна кривой охлаждения
чистого компонента. Система А-В с
ограничен.тв.р-рами- с перитектикой(т.Р).
Перитектическое превращение-результат
химического взаимодействия ранее
выпавшей тв.фазы с жид.фазой определенного
(перитектического) состава.В результате
этого взаимодействия образуется новая
тв.фаза.Кривые охлаждения 4 сплавов-1,2,3,4.
Кривые охлаждения 1 и 2 полностью похожи
на эвтектические.Кривая
охлаждения 3:в
интервале t
от t
до t3
идет охлаждение жид.фазы,и t
изменяется монотонно.При t3
из жид.фазы выпадают кристаллы тв.р-ра
α, на кривой охлаждения-перегиб.В
интервале t3-tP
жид.фаза меняет свой состав по линии
t3Е,а
тв.фаза по линии LG.Как
только жид.фаза достигнет состава
P(перитектического),получает
развитие перитектическая реакция.В
результате этой реакции исчезает
жид.фаза и ниже tP
наблюдается смесь 2 тв.фаз-тв.р-ров α
и β.На кривой охлаждения наблюдается
площадка,т.к. имеет место нонвариантное
превращение:С=К-Ф+1=2-3+1=0.Для сплава
4
при tP
в результате перитектической реакции
исчезает тв.р-ра α.В интервале tP
–t’4
из жид.фазы выпадают кристаллы тв.р-ра
β. От t’4
до t”4
происходит охлпждение тв.фазы β, а при
t”4
тв.р-р β частично распадается-с
выделением кристаллов тв.р-ра α.
|
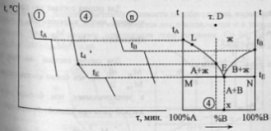
 35(2).Эвтектическая
диаграмма плавкости (без образования
твердых растворов).Диаграмма состояния
системы
- диаграмма, указывающая, в каких
фазовых состояниях находится система
в зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Для
систем, дающих диаграмму плавкости
такого типа, характерна
полная взаимная растворимость
компонентов в жидком состоянии и
нерастворимость – в твердом. Пример.
Системы Pb-Ag,
Cd-Bi,
Tl-Au,
KCl-LiCl
и т.д.Чтобы построить диаграмму
плавкости системы А-В, необходимо
приготовить несколько сплавов – от
100% А, через каждые
35(2).Эвтектическая
диаграмма плавкости (без образования
твердых растворов).Диаграмма состояния
системы
- диаграмма, указывающая, в каких
фазовых состояниях находится система
в зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Для
систем, дающих диаграмму плавкости
такого типа, характерна
полная взаимная растворимость
компонентов в жидком состоянии и
нерастворимость – в твердом. Пример.
Системы Pb-Ag,
Cd-Bi,
Tl-Au,
KCl-LiCl
и т.д.Чтобы построить диаграмму
плавкости системы А-В, необходимо
приготовить несколько сплавов – от
100% А, через каждые
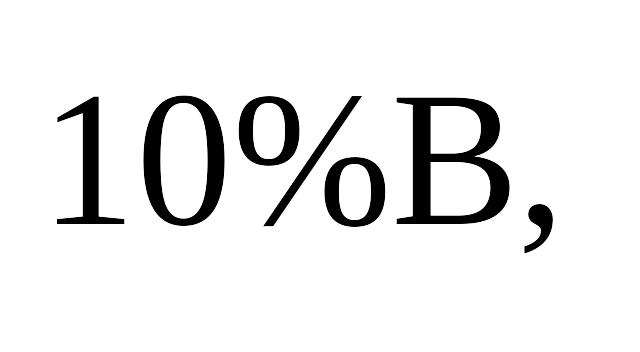 - до 100%В.Далее снимаются кривые
охлаждения и характерные точки
переносятся на диаграмму плавкости
бинарной системы А-В. Температуры
плавления чистых компонентов -tА
и tВ.
Температура
начала первичной кристаллизации
сплава 4 – t4,
окончание – tE.
Подобным же образом переносят
характерные точки для всех сплавов и
соединяют их на диаграмме плавными
линиями, получая в итоге диаграмму
плавкости системы A-B.Ломанная
линия tАЕtВ
- “линия ликвидуса”,
выше нее возможно существование лишь
жидкой фазы.Линия MEN
– “линия солидуса”,
ниже нее – лишь твердая фаза.Между
солидусом и ликвидусом область
сосуществования двух фаз – твердой
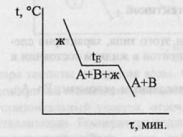
и жидкой.Точка Е – точка
эвтектики,
сплав эвтектического состава
кристаллизуется подобно чистому
компоненту, давая кривую охлаждения
с площадкой: для сплавов, имеющих
состав 100%А до т. х (состава эвтектики)
– так называемых доэвтектических –
под микроскопом после затвердевания
наблюдаются сравнительно крупные
кристаллы компонента А, выпадающие
первоначально, и смесь мелких
кристалликов А и В, выпадающая при
достижении жидкой фазы эвтектического
состава – в конце кристаллизации.В
сплавах после точки х - заэвтектического
состава
– наблюдаются крупные кристаллы В и
эвтектическая смесь кристалликов А
и В. Правило
фаз
в данном случае записывается как
С=К-Ф+1, посколько при снятии диаграмм
плавкости P=const.
Число степеней свободы: в точке D
– C=2-1+1=2,
в точке L
– C=2-2+1=1,
в точке Е – С=2-3+1=0.
- до 100%В.Далее снимаются кривые
охлаждения и характерные точки
переносятся на диаграмму плавкости
бинарной системы А-В. Температуры
плавления чистых компонентов -tА
и tВ.
Температура
начала первичной кристаллизации
сплава 4 – t4,
окончание – tE.
Подобным же образом переносят
характерные точки для всех сплавов и
соединяют их на диаграмме плавными
линиями, получая в итоге диаграмму
плавкости системы A-B.Ломанная
линия tАЕtВ
- “линия ликвидуса”,
выше нее возможно существование лишь
жидкой фазы.Линия MEN
– “линия солидуса”,
ниже нее – лишь твердая фаза.Между
солидусом и ликвидусом область
сосуществования двух фаз – твердой
и жидкой.Точка Е – точка
эвтектики,
сплав эвтектического состава
кристаллизуется подобно чистому
компоненту, давая кривую охлаждения
с площадкой: для сплавов, имеющих
состав 100%А до т. х (состава эвтектики)
– так называемых доэвтектических –
под микроскопом после затвердевания
наблюдаются сравнительно крупные
кристаллы компонента А, выпадающие
первоначально, и смесь мелких
кристалликов А и В, выпадающая при
достижении жидкой фазы эвтектического
состава – в конце кристаллизации.В
сплавах после точки х - заэвтектического
состава
– наблюдаются крупные кристаллы В и
эвтектическая смесь кристалликов А
и В. Правило
фаз
в данном случае записывается как
С=К-Ф+1, посколько при снятии диаграмм
плавкости P=const.
Число степеней свободы: в точке D
– C=2-1+1=2,
в точке L
– C=2-2+1=1,
в точке Е – С=2-3+1=0.
|



 5.Сущность
термографического анализа. Кривые
нагревания и охлаждения.Термографический
анализ
– кривые нагревания или кривые
охлаждения системы. Диаграммы плавкости
(частный вид диагарамм состояния)
строят исходя из кривых охлаждения,
которые изображаются в координатах:
температура(Оу), время(Ох). Рассмотрим
кривые
охлаждения
двух систем. Система I
в интервале t1-t2
не испытывает никаких фазовых
превращений, температура меняется
монотонно. Кривая II
отвечают охлаждению воды от 150
o
C
(пар при атмосферном давлении) до 0
o
C
и ниже. При 100
o
C
наблюдается горизонтальный участок,
отвечающий фазовому переходу –
процессу конденсации пара, температура
поддерживается низменной, пока не
исчезнет весь пар. Постоянство
температуры обеспечивается за счёт
выделения в процессе конденсации пара
теплоты испарения воды. От 100
o
C
до 0
o
C
наблюдается монотонный ход кривой
охлаждения – остывает жидкая вода.
При 0
o
C
наблюдается второй горизонтальный
участок, отвечающий фазовому переходу
– процессу кристаллизации. Температура
поддерживается постоянной за счет
выделения теплоты плавления.Рассмотрим
кривые
охлаждения
чистого металла (I)
и сплава с так называемой эвтектикой
(II).
На кривой охлаждения (I)
чистого металла А наблюдается одна
площадка bc,
отвечающая процессу кристаллизации
металла. При
tпл
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Образование
твердой фазы сопровождается выделением
теплоты плавления.Кривая II
отвечает охлаждению сплава А-В. От “а”
до “a’
“ температура меняется монотонно,
остывает жидкая фаза. При достижении
точки a’
из жидкой фазы начинают выпадать
кристаллы А – одного из компонентов
сплава, при этом жидкая фаза за счет
этого начнет обогащаться компонентом
В. Таким образом, в интервале a’-b
в равновесии находятся жидкая
и твердая фазы различного состава,
площадки на кривой охлаждения не
наблюдается. За счет выделения при
кристаллизации А теплоты плавления
этого компонента темп охлаждения
сплава замедляется, и на кривой
наблюдается перелом. Выпадение
кристаллов А продолжается до тех пор,
пока жидкая фаза не достигнет так
называемого “эвтектического состава”.
Основной особенностью эвтектического
сплава является то, что он кристаллизуется
подобно чистому компоненту – на кривой
охлаждения наблюдается площадка. Из
жидкой фазы одновременно выпадают
кристаллы А и В и, таким образом при
tЕ
(отрезок bc)
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Отрезок
cd
отвечают охлаждению твердого
сплава.Остановки в падении температуры
могут наблюдаться и на кривой охлаждения
уже твердого металла, указываю на
переходы металла из одной аллотропной
формы в другую.
5.Сущность
термографического анализа. Кривые
нагревания и охлаждения.Термографический
анализ
– кривые нагревания или кривые
охлаждения системы. Диаграммы плавкости
(частный вид диагарамм состояния)
строят исходя из кривых охлаждения,
которые изображаются в координатах:
температура(Оу), время(Ох). Рассмотрим
кривые
охлаждения
двух систем. Система I
в интервале t1-t2
не испытывает никаких фазовых
превращений, температура меняется
монотонно. Кривая II
отвечают охлаждению воды от 150
o
C
(пар при атмосферном давлении) до 0
o
C
и ниже. При 100
o
C
наблюдается горизонтальный участок,
отвечающий фазовому переходу –
процессу конденсации пара, температура
поддерживается низменной, пока не
исчезнет весь пар. Постоянство
температуры обеспечивается за счёт
выделения в процессе конденсации пара
теплоты испарения воды. От 100
o
C
до 0
o
C
наблюдается монотонный ход кривой
охлаждения – остывает жидкая вода.
При 0
o
C
наблюдается второй горизонтальный
участок, отвечающий фазовому переходу
– процессу кристаллизации. Температура
поддерживается постоянной за счет
выделения теплоты плавления.Рассмотрим
кривые
охлаждения
чистого металла (I)
и сплава с так называемой эвтектикой
(II).
На кривой охлаждения (I)
чистого металла А наблюдается одна
площадка bc,
отвечающая процессу кристаллизации
металла. При
tпл
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Образование
твердой фазы сопровождается выделением
теплоты плавления.Кривая II
отвечает охлаждению сплава А-В. От “а”
до “a’
“ температура меняется монотонно,
остывает жидкая фаза. При достижении
точки a’
из жидкой фазы начинают выпадать
кристаллы А – одного из компонентов
сплава, при этом жидкая фаза за счет
этого начнет обогащаться компонентом
В. Таким образом, в интервале a’-b
в равновесии находятся жидкая
и твердая фазы различного состава,
площадки на кривой охлаждения не
наблюдается. За счет выделения при
кристаллизации А теплоты плавления
этого компонента темп охлаждения
сплава замедляется, и на кривой
наблюдается перелом. Выпадение
кристаллов А продолжается до тех пор,
пока жидкая фаза не достигнет так
называемого “эвтектического состава”.
Основной особенностью эвтектического
сплава является то, что он кристаллизуется
подобно чистому компоненту – на кривой
охлаждения наблюдается площадка. Из
жидкой фазы одновременно выпадают
кристаллы А и В и, таким образом при
tЕ
(отрезок bc)
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Отрезок
cd
отвечают охлаждению твердого
сплава.Остановки в падении температуры
могут наблюдаться и на кривой охлаждения
уже твердого металла, указываю на
переходы металла из одной аллотропной
формы в другую.


 38.
Диаграмма плавкости бинарной системы
с ограниченными твердыми растворами.
Диаграмма состояния системы
- диаграмма, указывающая, в каких
фазовых состояниях находится система
в зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Для
данных систем характерны полная
взаимная растворимость компонентов
в жидком состоянии и ограниченная - в
твердом. Если твердые растворы образуют
эвтектику,
то точка нонвариантного равновесия
Е лежит ниже t
плавления чистых компонентов,если же
перитектику,то
нонвариантная точка P
лежит между t
плавления чистых компонентов.Пример.
Cu-Ag,Pb-Sn;
Hg-Cd.Рассмотрим
первый случай.Система А-В с
ограничен.тв.р-рами- с эвтектикой.
В системе имеется 2 твердых раствора:
α - р-р компонентов В в А и β- р-р компонента
А в В.Max
растворимость В в А при t
эвтектики tЕ
отвечает точке G,
а при комнат.t
– точке M.
Линия GM
характеризует уменьшение растворимости
В в А по мере понижения t
от эвтектич-й до комнат-й.Линия
FN-снижение
растворимости А в В при понижении t
от tЕ
до
комнат-й.Кривые охлаждения 4
сплавов:1,2,3,4.На кривой охлаждения
сплава
1
имееются 2 перегиба,отвечающих началу
и концу выделения кристаллов тв.р-ра
α.На кривой охлаждения сплава
2
дополнительно наблюдается слабо
выраженный перегиб при t”2,отвечающий
частичному распаду в тв.состоянии
кристаллов α с выделением кристаллов
тв.р-ра β. Кривая охлаждения сплава
3:
при t3
из жид.фазы выделяются кристаллы
тв.р-ра α,жид.фаза при понижении от t3
до
tЕ
меняет свой состав по линии
t3Е,т.е.обогащается
компонентом В.Как только жид.фаза
достигнет состава Е,начинается
кристаллизация эвтектики-мех.смеси
2 тв.фаз-тв.р-ра α состава G
и тв.р-ра β состава F,на
кривой охлаждения наблюдается
площадка.Сплав
4
точно отвечает эвтектич.составу,кривая
охлаждения его подобна кривой охлаждения
чистого компонента. Система А-В с
ограничен.тв.р-рами- с перитектикой(т.Р).
Перитектическое превращение-результат
химического взаимодействия ранее
выпавшей тв.фазы с жид.фазой определенного
(перитектического) состава.В результате
этого взаимодействия образуется новая
тв.фаза.Кривые охлаждения 4 сплавов-1,2,3,4.
Кривые охлаждения 1 и 2 полностью похожи
на эвтектические.Кривая
охлаждения 3:в
интервале t
от t
до t3
идет охлаждение жид.фазы,и t
изменяется монотонно.При t3
из жид.фазы выпадают кристаллы тв.р-ра
α, на кривой охлаждения-перегиб.В
интервале t3-tP
жид.фаза меняет свой состав по линии
t3Е,а
тв.фаза по линии LG.Как
только жид.фаза достигнет состава
P(перитектического),получает
развитие перитектическая реакция.В
результате этой реакции исчезает
жид.фаза и ниже tP
наблюдается смесь 2 тв.фаз-тв.р-ров α
и β.На кривой охлаждения наблюдается
площадка,т.к. имеет место нонвариантное
превращение:С=К-Ф+1=2-3+1=0.Для сплава
4
при tP
в результате перитектической реакции
исчезает тв.р-ра α.В интервале tP
–t’4
из жид.фазы выпадают кристаллы тв.р-ра
β. От t’4
до t”4
происходит охлпждение тв.фазы β, а при
t”4
тв.р-р β частично распадается-с
выделением кристаллов тв.р-ра α.
38.
Диаграмма плавкости бинарной системы
с ограниченными твердыми растворами.
Диаграмма состояния системы
- диаграмма, указывающая, в каких
фазовых состояниях находится система
в зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Для
данных систем характерны полная
взаимная растворимость компонентов
в жидком состоянии и ограниченная - в
твердом. Если твердые растворы образуют
эвтектику,
то точка нонвариантного равновесия
Е лежит ниже t
плавления чистых компонентов,если же
перитектику,то
нонвариантная точка P
лежит между t
плавления чистых компонентов.Пример.
Cu-Ag,Pb-Sn;
Hg-Cd.Рассмотрим
первый случай.Система А-В с
ограничен.тв.р-рами- с эвтектикой.
В системе имеется 2 твердых раствора:
α - р-р компонентов В в А и β- р-р компонента
А в В.Max
растворимость В в А при t
эвтектики tЕ
отвечает точке G,
а при комнат.t
– точке M.
Линия GM
характеризует уменьшение растворимости
В в А по мере понижения t
от эвтектич-й до комнат-й.Линия
FN-снижение
растворимости А в В при понижении t
от tЕ
до
комнат-й.Кривые охлаждения 4
сплавов:1,2,3,4.На кривой охлаждения
сплава
1
имееются 2 перегиба,отвечающих началу
и концу выделения кристаллов тв.р-ра
α.На кривой охлаждения сплава
2
дополнительно наблюдается слабо
выраженный перегиб при t”2,отвечающий
частичному распаду в тв.состоянии
кристаллов α с выделением кристаллов
тв.р-ра β. Кривая охлаждения сплава
3:
при t3
из жид.фазы выделяются кристаллы
тв.р-ра α,жид.фаза при понижении от t3
до
tЕ
меняет свой состав по линии
t3Е,т.е.обогащается
компонентом В.Как только жид.фаза
достигнет состава Е,начинается
кристаллизация эвтектики-мех.смеси
2 тв.фаз-тв.р-ра α состава G
и тв.р-ра β состава F,на
кривой охлаждения наблюдается
площадка.Сплав
4
точно отвечает эвтектич.составу,кривая
охлаждения его подобна кривой охлаждения
чистого компонента. Система А-В с
ограничен.тв.р-рами- с перитектикой(т.Р).
Перитектическое превращение-результат
химического взаимодействия ранее
выпавшей тв.фазы с жид.фазой определенного
(перитектического) состава.В результате
этого взаимодействия образуется новая
тв.фаза.Кривые охлаждения 4 сплавов-1,2,3,4.
Кривые охлаждения 1 и 2 полностью похожи
на эвтектические.Кривая
охлаждения 3:в
интервале t
от t
до t3
идет охлаждение жид.фазы,и t
изменяется монотонно.При t3
из жид.фазы выпадают кристаллы тв.р-ра
α, на кривой охлаждения-перегиб.В
интервале t3-tP
жид.фаза меняет свой состав по линии
t3Е,а
тв.фаза по линии LG.Как
только жид.фаза достигнет состава
P(перитектического),получает
развитие перитектическая реакция.В
результате этой реакции исчезает
жид.фаза и ниже tP
наблюдается смесь 2 тв.фаз-тв.р-ров α
и β.На кривой охлаждения наблюдается
площадка,т.к. имеет место нонвариантное
превращение:С=К-Ф+1=2-3+1=0.Для сплава
4
при tP
в результате перитектической реакции
исчезает тв.р-ра α.В интервале tP
–t’4
из жид.фазы выпадают кристаллы тв.р-ра
β. От t’4
до t”4
происходит охлпждение тв.фазы β, а при
t”4
тв.р-р β частично распадается-с
выделением кристаллов тв.р-ра α.
 35(2).Эвтектическая
диаграмма плавкости (без образования
твердых растворов).Диаграмма состояния
системы
- диаграмма, указывающая, в каких
фазовых состояниях находится система
в зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Для
систем, дающих диаграмму плавкости
такого типа, характерна
полная взаимная растворимость
компонентов в жидком состоянии и
нерастворимость – в твердом. Пример.
Системы Pb-Ag,
Cd-Bi,
Tl-Au,
KCl-LiCl
и т.д.Чтобы построить диаграмму
плавкости системы А-В, необходимо
приготовить несколько сплавов – от
100% А, через каждые
35(2).Эвтектическая
диаграмма плавкости (без образования
твердых растворов).Диаграмма состояния
системы
- диаграмма, указывающая, в каких
фазовых состояниях находится система
в зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Для
систем, дающих диаграмму плавкости
такого типа, характерна
полная взаимная растворимость
компонентов в жидком состоянии и
нерастворимость – в твердом. Пример.
Системы Pb-Ag,
Cd-Bi,
Tl-Au,
KCl-LiCl
и т.д.Чтобы построить диаграмму
плавкости системы А-В, необходимо
приготовить несколько сплавов – от
100% А, через каждые