
|
63.Электролиз.
Последовательность разряда ионов на
катоде и аноде. Электролиз
- это окислительно-восстановительный
процесс, протекающий при прохождении
постоянного тока через раствор или
расплав электролита.Сущность
электролиза:
на катоде(-) идет процесс восстановления,
на аноде(+) – процесс окисления.Пример.
|
64.Законы
Фарадея. Выход по току. Первый закон:
при электролизе данного электролита
количества веществ, выделяющихся на
электродах, прямо пропорционально
количеству электричества, прошедшему
через электролит.
|
69.Составные
части системы и компоненты. Правило
фаз.Составные части системы
– химически индивидуальные вещества,
составляющие данную систему и способные
к самостоятельному существованию.В
равновесной системе
|
||
64(2).Химическая и концентрационная поляризация при электролизе. Понятие перенапряжения.В процессе электролиза всегда возникает некоторая разность потенциалов, направленная противоположно той, которая накладывается извне. Это явление носит название поляризации. Различают химическую и концентрационную.Химическая обусловлена химическими изменениями на поверхности электрода.Концентрационная поляризация: концентрация потенциалопределяющих ионов у анода и катода в процессе электролиза будет различаться, у катода она меньше равновесной, у анода – больше. Возникает концентрационный элемент, ЭДС которого направлена навстречу внешней ЭДС, она может быть уменьшена путем перемешивания раствора. Напряжение разложения – наименьшее значение внешней ЭДС, при достижении которого начинается длительный электролиз (с выделением его продуктов). Перенапряжение – это разность между напряжением разложения, фактически необходимым для протекания электролиза в данной электрохимической системе, и ЭДС гальванического элемента, отвечающего этой системе. Вред перенапряжения: добавочный расход электроэнергии, польза: удается получать электролизом водных растворов металлы, потенциалы которых отрицательны.
|
65.Классификация химических источников тока.Существуют 3 типа ХИТ: первичные - гальванические элементы, вторичные – аккумуляторы и топливные элементы.В гальванических элементах активные вещества, необходимые для работы элемента, закладываются в него при монтаже, после израсходования веществ элемент утилизируется.В основу аккумулятора положена высоко-обратимая хим реакция окисления-восстановления, которую можно проводить в обоих направлениях.Топливный элемент – это ХИТ длительного действия, начинающий и прекращающий работу с началом и прекращением подачи активных веществ в электродам.Достоинства ХИТ: высокий КПД, экологическая чистота, бесшумность, автономность действия.Недостаток – низкие удельные характеристики. Марганцево-цинковый элемент: наиболее широко применяется среди первичных ХИТ. Электрохимическая цепь: (-)Zn|NH4Cl|MnO2(+). Электролит – 20% раствор NH4Cl, загущенный до студнеобразного состояния, для предотвращения высыхания и загнивания вводят специальные добавки. MnO2 спрессован с добавкой сажи – для увеличения электроемкости. ЭДС от 1,48 до 1,8 в зависимости от кристаллической модификации MnO2, начальное напряжение 1,1-1,25В. Процессы при разряде: (-) Zn-2ē+2H2O>Zn(OH)2+2H+, (+)2MnO2+2ē+2H+>2MnO.OH, Zn+2MnO2+2H2O=Zn(OH)2+2MnO.OH. Вторичная реакция: Zn(OH)2+2NH4Cl=[Zn(NH3)2]Cl2+2MnO.OH
|
|
67.Основные методы борьбы с коррозией. Коррозия – самопроизвольно протекающий процесс поверхностного окисления металла в результате его химического или электрохимического взаимодействия с окружающей средой .В результате коррозии металл из свободного состояния переходит в связанное. Потери от коррозии велики: десятки миллиардов долларов в индустриально-развитых странах.Методы борьбы различны: -антикоррозийное легирование металла
– введение
в металл добавок, чтобы повысить
стойкость основного металла. защитные
покрытия
(металлические и неметаллические).металлические
наносятся под давлением сжатого
воздуха. характерно покрытие листового
материала тонким слоем другого
материала. неметаллические – лаки
,краски, битум, солидол.-ингибиторы
коррозии.вещества,
замедляющие процесс разрушения
металла.Пример.
|
68.Кристаллическое состояние вещества. Химическая связь в кристаллах.Твердые вещества могут находиться в аморфном или кристаллическом состояниях.Вещества в аморфном состоянии не имеют четкой структуры, их иногда называют «переохлажденными жидкостями с аномально высокой вязкостью».Кристаллические структуры.Наименьшая структурная единица – элементарная ячейка. В зависимости от решеток и углов между характеристическими осями различают 7 основных видов (кубическая, ромбоэдрическая и пр.).Тип кристаллической системы определяется природой и размерами частиц, видом химических связей между ними, температурой и другими факторами.Многие соединения могут существовать в двух и более кристаллических структурах. Это явление – полиморфизм.Все кристаллы можно разделить по видам химической связи. Стоит отметить, что существуют кристаллы со смешанными связями.1. Молекулярная связь.В узлах кристаллических решеток находятся молекулы, между которыми дейтсвуют вандерваальсовы силы, имеющие невысокую энергию.Для кристаллов с молекулярными связями характерны низкие температуры плавления и высокая сжимаемость.2. Ковалентная связь.В узлах кристаллов располагаются атомы, образующие прочные ковалентные связи.Это обуславливает высокую энергию решетки.Кристаллы с ковалентной связью - диэлектрики или полупроводники. Типичными примеры: алмаз и кремний.3. Ионная связь.Структурные единицы – положительно и отрицательно заряженные ионы, между которыми происходит электростатическое взаимодействие, характеризуемое высокой энергией.Кристаллы с ионной связью при низких температурах являются диэлектриками. При температурах близких к температуре плавления они становятся проводниками электричества.4. Металлическая связь.Специфические свойства металлов (высокая проводимость, теплопроводность, ковкость, пластичность, металлический блеск) можно объяснить особым типом связи – металлическая.Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно движутся валентные электроны, отщепившиеся от атомов при образовании ионов. Эти электроны удерживают вместе положительные ионы, в противном случае решётка распалась бы под действием сил отталкивания между ионами. 5. Смешанная связь.Тот или иной вид связи встречается редко, обычно – наложение двух или более связей. |

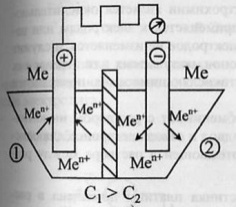
 62.Типы
электродов. Окислительно-восстановительный
электроды. Электрод
– проводник 1 рода, погруженный в
раствор электролита в условиях
прохождения через него тока. Три
типа:
электроды первого, второго и третьего
рода. Электроды
1-го рода. Металлы,
погруженные в растворы своих солей.солей:
62.Типы
электродов. Окислительно-восстановительный
электроды. Электрод
– проводник 1 рода, погруженный в
раствор электролита в условиях
прохождения через него тока. Три
типа:
электроды первого, второго и третьего
рода. Электроды
1-го рода. Металлы,
погруженные в растворы своих солей.солей:
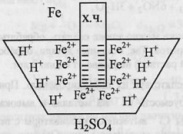
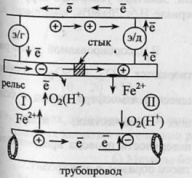 66.Коррозия
металлов. Химическая и электрохимическая
коррозия.Коррозия – самопроизвольно
протекающий процесс поверхностного
окисления металла в результате его
химического или электрохимического
взаимодействия с окружающей средой.В
результате коррозии металл из свободного
состояния переходит в связанное.
Потери от коррозии велики: десятки
миллиардов долларов в индустриально-развитых
странах.Химическая
коррозия (газовая и жидкостная).Газовая
– разрушение происходит в атмосфере
сухого газа – окислителя (кислород,
галогены).
66.Коррозия
металлов. Химическая и электрохимическая
коррозия.Коррозия – самопроизвольно
протекающий процесс поверхностного
окисления металла в результате его
химического или электрохимического
взаимодействия с окружающей средой.В
результате коррозии металл из свободного
состояния переходит в связанное.
Потери от коррозии велики: десятки
миллиардов долларов в индустриально-развитых
странах.Химическая
коррозия (газовая и жидкостная).Газовая
– разрушение происходит в атмосфере
сухого газа – окислителя (кислород,
галогены).