 51.Законы
Рауля. Особенность
растворов: давление пара растворителя
над раствором ниже, чем над чистым
растворителем. Первый
закон. Давление
пара растворителя над раствором
пропорционально мольной доле
растворителя в растворе или относительное
понижение давления пара растворителя
над раствором равно мольной доли
растворенного вещества. Введем
обозначения:
51.Законы
Рауля. Особенность
растворов: давление пара растворителя
над раствором ниже, чем над чистым
растворителем. Первый
закон. Давление
пара растворителя над раствором
пропорционально мольной доле
растворителя в растворе или относительное
понижение давления пара растворителя
над раствором равно мольной доли
растворенного вещества. Введем
обозначения: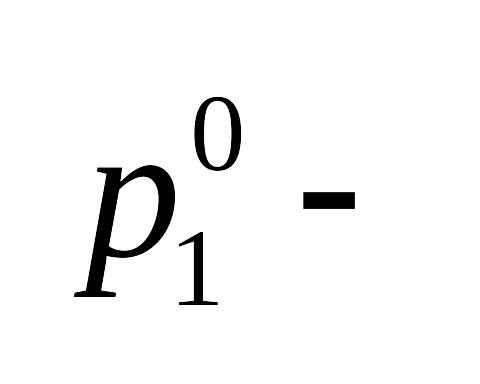 давление пара растворителя над чистым
растворителем;
давление пара растворителя над чистым
растворителем; давление пара растворителя над
раствором;
давление пара растворителя над
раствором; абсолютное понижение давления;
абсолютное понижение давления; относительное понижение давления.
относительное понижение давления.
 Если
система полностью подчиняется закону,
на графике наблюдаются прямолинейные
зависимости. Однако в реальных системах
наблюдаются отклонения. Температура
замерзания раствора ниже температуры
замерзания чистого растворителя, а
температура кипения – выше. Второй
закон. Повышение
температуры кипения раствора и
понижение температуры его замерзания
пропорциональны моляльной концентрации
раствора.
Если
система полностью подчиняется закону,
на графике наблюдаются прямолинейные
зависимости. Однако в реальных системах
наблюдаются отклонения. Температура
замерзания раствора ниже температуры
замерзания чистого растворителя, а
температура кипения – выше. Второй
закон. Повышение
температуры кипения раствора и
понижение температуры его замерзания
пропорциональны моляльной концентрации
раствора.
 К – константа, характеризующая
растворитель.
К – константа, характеризующая
растворитель. не зависит от природы вещества, а
определяется природой растворителя
и моляльностью, т.е. числом растворенных
молекул в определенном количестве
растворителя. С помощью законов Рауля
можно определять неизвестные
молекулярные массы растворенных
веществ.
не зависит от природы вещества, а
определяется природой растворителя
и моляльностью, т.е. числом растворенных
молекул в определенном количестве
растворителя. С помощью законов Рауля
можно определять неизвестные
молекулярные массы растворенных
веществ.
|
52.Электролитическая
диссоциация. Степень диссоциации.
Слабые электролиты. Электролиты
– вещества, которые в растворе или
расплаве состоят полностью или частично
из ионов. Они не подчиняются законам
Рауля: их растворы замерзают при более
низких температурах, а кипят при более
высоких температурах, чем растворы
неэлектролитов той же моляльной
концентрации. Электролитическая
диссоциация. Теорию
ЭД предложил шведский ученый Аррениус.
«Электролиты, растворяясь в воде,
распадаются на ионы (заряженные
частицы). При этом каждый ион ведет
себя как самостоятельная частица. В
результате диссоциации концентрация
увеличивается (число частиц в единице
объема).»Академик Каблуков дополнил
теорию ЭД: «основная причина диссоциации
на ионы – взаимодействие с полярными
молекулами воды». Согласно закону
Кулона, сила притяжения между зарядами

 показывает, во сколько раз сила в
данной среде меньше, чем в вакууме. Об
ионизирующей способности растворителей
судят по их диэлектрической проницаемости:
чем она выше, тем энергичнее протекает
процесс ЭД. Кроме воды, электролиты
диссоциируют в
показывает, во сколько раз сила в
данной среде меньше, чем в вакууме. Об
ионизирующей способности растворителей
судят по их диэлектрической проницаемости:
чем она выше, тем энергичнее протекает
процесс ЭД. Кроме воды, электролиты
диссоциируют в
 По способности диссоциации электролиты
делятся на слабые
и сильные.
Сильные диссоциируют полностью –
процесс необратим. Процесс диссоциации
слабых обратим (в растворах содержатся
как ионы, так и недиссоциированные
молекулы). Степень
диссоциации
- доля растворенного электролита,
распавшегося на ионы. Для сильных -
По способности диссоциации электролиты
делятся на слабые
и сильные.
Сильные диссоциируют полностью –
процесс необратим. Процесс диссоциации
слабых обратим (в растворах содержатся
как ионы, так и недиссоциированные
молекулы). Степень
диссоциации
- доля растворенного электролита,
распавшегося на ионы. Для сильных -
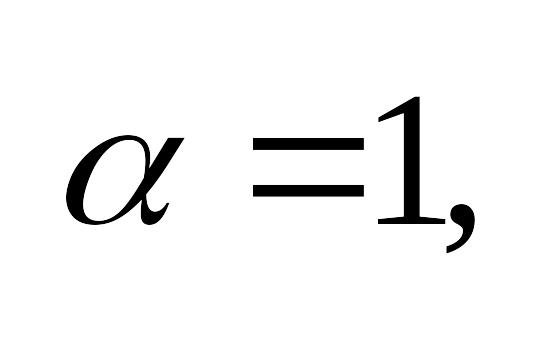 для слабых
для слабых
 На практике СД определяют путем
измерения электропроводимости
раствора. Различают удельную
электропроводимость
На практике СД определяют путем
измерения электропроводимости
раствора. Различают удельную
электропроводимость
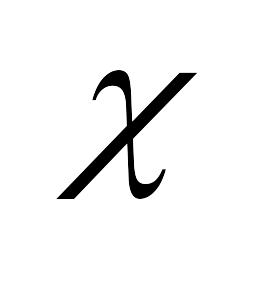 и эквивалентную
и эквивалентную

 повышается с увеличением разбавления
до некоторой предельной величины,
когда все молекулы распадаются на
ионы
повышается с увеличением разбавления
до некоторой предельной величины,
когда все молекулы распадаются на
ионы
 При этом предельное значение
эквивалентной электропроводимости
– электропроводимость
при бесконечном разбавлении
-
При этом предельное значение
эквивалентной электропроводимости
– электропроводимость
при бесконечном разбавлении
-
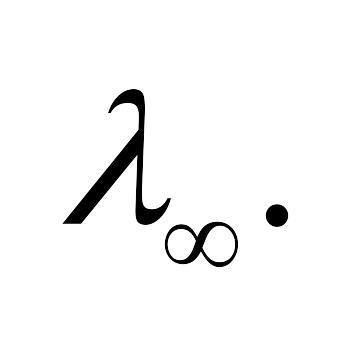 Для слабых электролитов выполняется
Для слабых электролитов выполняется

|
52(2).Константа
диссоциации. Закон разведения Оствальда.
Электролитическая диссоциация. Теорию
ЭД предложил шведский ученый Аррениус.
«Электролиты, растворяясь в воде,
распадаются на ионы (заряженные
частицы). При этом каждый ион ведет
себя как самостоятельная частица. В
результате диссоциации концентрация
увеличивается (число частиц в единице
объема).»Академик Каблуков дополнил
теорию ЭД: «основная причина диссоциации
на ионы – взаимодействие с полярными
молекулами воды». Согласно закону
Кулона, сила притяжения между зарядами
показывает, во сколько раз сила в
данной среде меньше, чем в вакууме. Об
ионизирующей способности растворителей
судят по их диэлектрической проницаемости:
чем она выше, тем энергичнее протекает
процесс ЭД. Кроме воды, электролиты
диссоциируют в
Константа
диссоциации в
случае разбавленного электролита:
A2B=2A+B2
 См – концентрация недиссоциированных
молекул. При стандартных условиях
См – концентрация недиссоциированных
молекул. При стандартных условиях
 Константа
диссоциации
в одном и том же растворителе при
постоянной температуре – величина
постоянная, она свойственна данному
электролиту. Степень
диссоциации
характеризует состояние электролита
в растворе данной концентрации и
меняется с изменением ее. При повышении
концентрации раствора
Константа
диссоциации
в одном и том же растворителе при
постоянной температуре – величина
постоянная, она свойственна данному
электролиту. Степень
диссоциации
характеризует состояние электролита
в растворе данной концентрации и
меняется с изменением ее. При повышении
концентрации раствора
 уменьшается. Закон
разведения Оствальда. С
разбавлением раствора степень
диссоциации его увеличивается. Выражает
зависимость между
уменьшается. Закон
разведения Оствальда. С
разбавлением раствора степень
диссоциации его увеличивается. Выражает
зависимость между
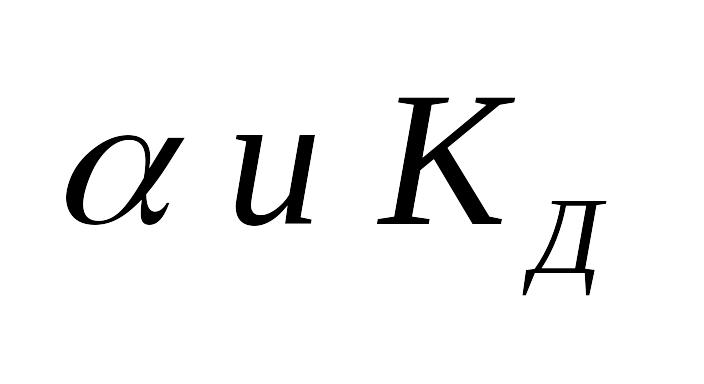
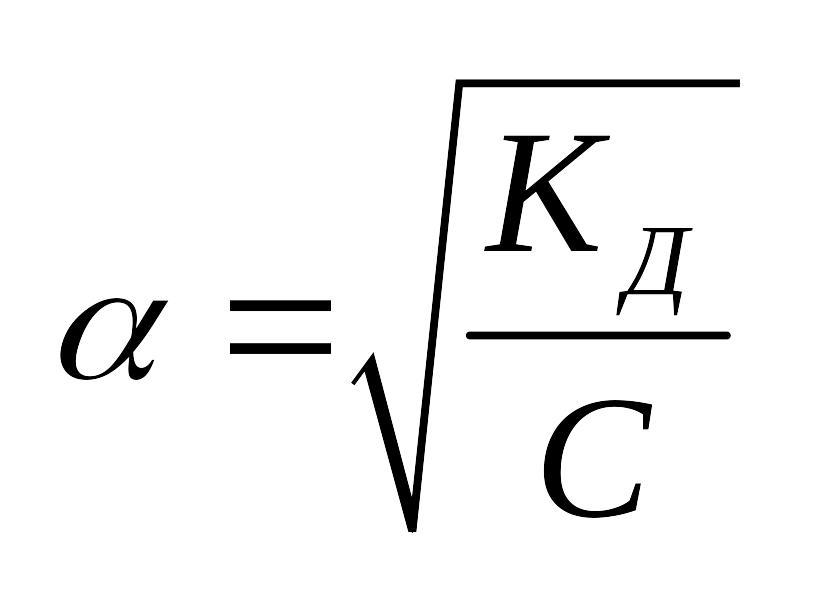 Также
можно установить связь и между
Также
можно установить связь и между
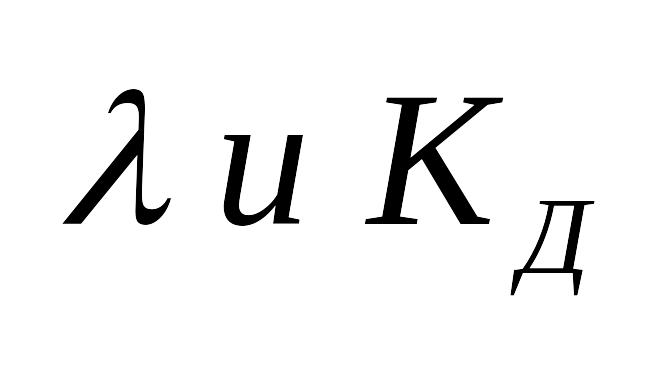
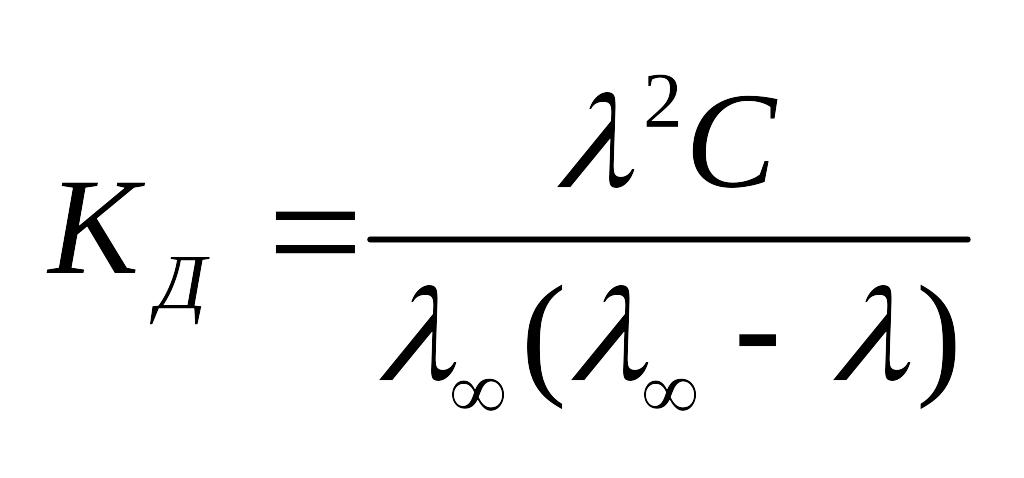 Сильные
электролиты: почти все соли, большинство
кислот и гидроксиды металлов. Электролиты
средней
силы:
Сильные
электролиты: почти все соли, большинство
кислот и гидроксиды металлов. Электролиты
средней
силы:
 Слабые
электролиты: почти все органические
кислоты, вода.
Слабые
электролиты: почти все органические
кислоты, вода.
|


 51.Законы
Рауля. Особенность
растворов: давление пара растворителя
над раствором ниже, чем над чистым
растворителем. Первый
закон. Давление
пара растворителя над раствором
пропорционально мольной доле
растворителя в растворе или относительное
понижение давления пара растворителя
над раствором равно мольной доли
растворенного вещества. Введем
обозначения:
51.Законы
Рауля. Особенность
растворов: давление пара растворителя
над раствором ниже, чем над чистым
растворителем. Первый
закон. Давление
пара растворителя над раствором
пропорционально мольной доле
растворителя в растворе или относительное
понижение давления пара растворителя
над раствором равно мольной доли
растворенного вещества. Введем
обозначения: