
- •1. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •4. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •6. Связь периодического закона со строением электронных оболочек атома. Правило Клечковского. Энергетические ячейки. Правило Хунда.
- •7.Периодический закон д.И.Менделеева и периодическая система: ряды, периоды, группы, подгруппы и порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и пи-связи. Гибридизация атомных орбиталей.
- •12. Ионная связь.
- •13. Полярность связи. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Теплота. Работа. Теплоемкость.
- •18. Первое начало термодинамики. Закон Гесса. Термохимические расчеты.
- •19. Стандартная энтальпия образования. Следствия из закона образования.
- •20. Зависимость теплового эффекта реакции от температуры (закон Кирхгоффа).
- •21. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •23. Условия самопроизвольного протекания химических реакций.
- •24. Константа химического равновесия. Расчет Кр и Кс.
- •25. Принцип Ле-Шателье.
- •27. Молекулярность и порядок реакции.
- •28. Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •29. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •30. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •35. Растворимость газов в жидкостях. Закон Генри. Закон Дальтона. Закон распределения.
- •31. Скорость гетерогенной химической реакции.
- •32. Катализ. Гомогенный и гетерогенный катализ.
- •33. Растворы. Растворимость. Способы выражения концентраций растворов.
- •34. Физические и химические процессы при при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •36. Законы Рауля.
- •39.Сильные электролиты. Понятие активности и коэффициента активности.
- •37. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •40.Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •38. Константа диссоциации. Закон разведения Оствальда.
- •41. Гидролиз солей. Константа и степень гидролиза.
- •42. Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •43.Возникновение скачка потенциала на границе “металл-раствор”. Равновесный электродный потенциал.
- •44. Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
- •46. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений.
- •45.Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •50.Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •47. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •49. Законы Фарадея. Выход по току.
- •48.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •51.Классификация химических источников тока.
- •52. Коррозия металлов. Химическая и электрохимическая коррозия.
- •53. Основные методы борьбы с коррозией.
- •54. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •5. Смешанная связь.
- •55. Составные части системы и компоненты. Правило фаз.
- •57.Диаграмма состояния однокомпонентной системы на примере воды.
- •56.Сущность термографического анализа. Кривые нагревания и охлаждения.
- •58.Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •59. Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •64. Адгезия, когезия, сорбция (адсорбция и абсорбция).
- •60.Диаграмма плавкости непрерывно твердых растворов. Правило рычага.
- •61. Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
- •62. Диаграмма плавкости бинарной системы с образованием химических соединений.
- •65. Физическая адсорбция и хемосорбция.
- •66. Величина и механизм адсорбции.
- •67. Поверхностное натяжение твердых тел. Принцип Гиббса-Кюри.
- •68. Поверхностное натяжение растворов. Изотерма адсорбции Лэнгмюра. Уравнение Фрейндлиха.
- •63. Дальтониды и бертоллиды.
12. Ионная связь.
В случае возникновения ионной связи между атомами или группами атомов преобладает электростатическое взаимодействие. Она возникает между атомами элементов, значительно отличающихся по величине электроотрицательности.

Элементы, входящие в состав ионного соединения, всегда существуют в виде ионов, а не нейтральных атомов. Также нужно отметить, что полного разделения зарядов нет и имеет место частичная ковалентность.
Валентность в ионных соединениях определяется по числу зарядов слагающих их ионов.
Ионы проводят электр. ток в растворах и расплавах и являются проводниками второго рода.
13. Полярность связи. Полярность молекул и их дипольный момент.
Предположим, что
мы имеем соединение АB. Оба элемента с
большими значениями электроотрицательности
( ).
).
=> общая электронная пара в молекуле смещена от атома B к атому А. Электронейтральность нарушается, в молекуле появляются положительный (B) и отрицательный (A) полюса.
Такая система носит название диполь – полярная молекула (система из двух разноименных, одинаковых по величине зарядов, находящихся на малом расстоянии). Ковалентная связь – полярная.
Основная
характеристика диполя – дипольный
момент.

 - напряженность
поля, создаваемого диполем.
- напряженность
поля, создаваемого диполем.
l – плечо диполя.
Примеры полярных
молекул-диполей:
 и др.
и др.
Чем больше плечо, тем полярнее молекула.
 можно представить
как произведение некоторой величины
D
(единицы
Дебая) на
можно представить
как произведение некоторой величины
D
(единицы
Дебая) на

Для ионных соединений D=4-11 единиц, для полярных D=0-4 единиц.
Полярность связи – вектор, направленный от отрицательного полюса к положительному, происходит взаимное уничтожение векторов.
14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
Донорно-акцепторная связь (ДАС) – разновидность ковалентной связи.
Выделяют соединения первого порядка (или валентно-насыщенные соединения) Пример: H2O, AgCl, NH3, HCl, KJ, CuSO4, FeCl3 и т.д. Реагируя друг с другом дают соединения высшего порядка (или комплексные соединения).



В комплексных соединениях проявляются ДАС. Рассмотрим пример:
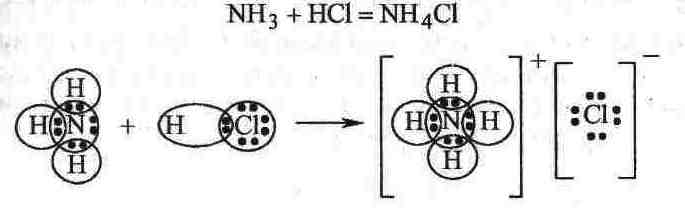
Азот в NH3 – донор, водород в HCl – акцептор.
Комплексное соединение – соединение высшего порядка, возникающее из соединений первого порядка без образования новых электронных пар, а за счет проявления хотя бы одной ДАС.
______________________________________
Рассмотрим пример [Cu(NH3)4]SO4.
Cu-комплексообразователь, 4-координационное число. ( )- внутренняя сфера, [ ]-внешняя сфера, NH3-лиганды.
Координационное число для комплексного соединения имеет тот же смысл, что валентность в обычных соединениях. Принимает значения от 1-12 (кроме 10 и 11).
______________________________________
Предложено 2 теории возникновения комплексных соединений. Первая – Полинг – теория валентных связей.
Вторая – Бете – теория кристаллического поля.
Согласно первой, комлексообразователь, координирующий лиганды вокруг себя, имеет вакантные орбитали. Т.е. образование комплексных соединений – результат проявления ДАС,
Согласно второй, связь в комплексах – электростатическая, т.е. взаимодействие типа «ион-ион» или «ион-диполь».
_______________________________________

Константа равновесия (нестойкости) Кн:

В квадратных и фигурной скобках концентрации ионов. Чем меньше значение Кн, тем более прочен комплексный ион.
