
- •1. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •4. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •6. Связь периодического закона со строением электронных оболочек атома. Правило Клечковского. Энергетические ячейки. Правило Хунда.
- •7.Периодический закон д.И.Менделеева и периодическая система: ряды, периоды, группы, подгруппы и порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и пи-связи. Гибридизация атомных орбиталей.
- •12. Ионная связь.
- •13. Полярность связи. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Теплота. Работа. Теплоемкость.
- •18. Первое начало термодинамики. Закон Гесса. Термохимические расчеты.
- •19. Стандартная энтальпия образования. Следствия из закона образования.
- •20. Зависимость теплового эффекта реакции от температуры (закон Кирхгоффа).
- •21. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •23. Условия самопроизвольного протекания химических реакций.
- •24. Константа химического равновесия. Расчет Кр и Кс.
- •25. Принцип Ле-Шателье.
- •27. Молекулярность и порядок реакции.
- •28. Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •29. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •30. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •35. Растворимость газов в жидкостях. Закон Генри. Закон Дальтона. Закон распределения.
- •31. Скорость гетерогенной химической реакции.
- •32. Катализ. Гомогенный и гетерогенный катализ.
- •33. Растворы. Растворимость. Способы выражения концентраций растворов.
- •34. Физические и химические процессы при при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •36. Законы Рауля.
- •39.Сильные электролиты. Понятие активности и коэффициента активности.
- •37. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •40.Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •38. Константа диссоциации. Закон разведения Оствальда.
- •41. Гидролиз солей. Константа и степень гидролиза.
- •42. Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •43.Возникновение скачка потенциала на границе “металл-раствор”. Равновесный электродный потенциал.
- •44. Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
- •46. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений.
- •45.Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •50.Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •47. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •49. Законы Фарадея. Выход по току.
- •48.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •51.Классификация химических источников тока.
- •52. Коррозия металлов. Химическая и электрохимическая коррозия.
- •53. Основные методы борьбы с коррозией.
- •54. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •5. Смешанная связь.
- •55. Составные части системы и компоненты. Правило фаз.
- •57.Диаграмма состояния однокомпонентной системы на примере воды.
- •56.Сущность термографического анализа. Кривые нагревания и охлаждения.
- •58.Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •59. Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •64. Адгезия, когезия, сорбция (адсорбция и абсорбция).
- •60.Диаграмма плавкости непрерывно твердых растворов. Правило рычага.
- •61. Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
- •62. Диаграмма плавкости бинарной системы с образованием химических соединений.
- •65. Физическая адсорбция и хемосорбция.
- •66. Величина и механизм адсорбции.
- •67. Поверхностное натяжение твердых тел. Принцип Гиббса-Кюри.
- •68. Поверхностное натяжение растворов. Изотерма адсорбции Лэнгмюра. Уравнение Фрейндлиха.
- •63. Дальтониды и бертоллиды.
64. Адгезия, когезия, сорбция (адсорбция и абсорбция).
Адгезия – проявление межмолекулярных сил между разнородными молекулами (А-В).
Когезия – между однородными молекулами, связи типа А-А, В-В.
Адгезионные явления лежат в основе смачивания, прилипания и сорбции.
Сорбция – процесс поглощения одного вещества поверхностью или всем объемом другого вещества. Поглощаемое вещество – сорбат, поглотитель – сорбент (часто твердое тело).
Поглощение может происходить только поверхностью (адсорбция) или всем объемом (абсорбция). Часто эти процессы протекают совместно.
Адсорбция – фактически процесс сгущения (концентрации) вещества в пограничном слое у поверхности раздела фаз. Поглощение может распространиться на весь объем поглотителя (абсорбция).
60.Диаграмма плавкости непрерывно твердых растворов. Правило рычага.
Диаграмма состояния системы - диаграмма, указывающая, в каких фазовых состояниях находится система в зависимости от условий: температура, давление и состав.
Диаграммы плавкости – частный вид диаграмм состояния.
Для систем, дающих такую диаграмму плавкости, характерны полная взаимная растворимость компонентов как в жидком, так и в твердом состоянии. Пример. Cu-Ni, Fe-Ni, Bi-Sb, Ag-Au, FeO-MnO и др.
Примечание автора. Обязательна графическая иллюстрация.

Все кривые охлаждения
сплавов не имеют площадок,а лишь 2
перегиба. Линии
 линия ликвидуса,
линия ликвидуса,
 солидуса. Во всем интервале составов
в твердом состоянии присутствуют
смешанные кристаллы – твердый раствор
α.
солидуса. Во всем интервале составов
в твердом состоянии присутствуют
смешанные кристаллы – твердый раствор
α.
Примечание автора. Обязательна графическая иллюстрация.

Рассмотрим ход кристаллизации сплава состава 5, взятого при t. В интервале t-t’ никаких фазовых превращений не наблюдается,t меняется монотонно. При достижении t’ из жидкого сплава начинают кристаллизоваться кристаллы α состава N, т.е. первые порции тв.фазы обогащены более тугоплавким компонентом. В равновесии находятся твердые и жидкие фазы различного состава, отсюда и отсутствие площадок на кривых охлаждения.
Примечание автора. Обязательна графическая иллюстрация.

При понижении от t’ до t” состав твердой фазы меняется по линии nt”, а состав жидкой фазы- по линии t’m.
Состав твердой фазы в процессе кристаллизации непрерывно меняется, состав слитка по сечению будет неоднородным: периферийные зоны слитка, кристаллизующиеся в первую очередь, будут более тугоплавкими, а центральные - более легкоплавкими. Это явление носит название ликвация. Ликвацию устраняют, проводя так называемый отжиг, при котором слиток нагревают до t, близкой к t солидуса, и выдерживают при этой t длительное время.
Эта система моновариантна (С=К-Ф+1=2-2+1=1), поэтому любой произвольно выбранной t соответствуют вполне определенные составы жидкого расплава и смешанных кристаллов: состав жидкой фазы находят на линии ликвидуса, а состав твердой - на линии солидуса.
При помощи диаграммы плавкости можно определить соотношение между массами сосуществующих при равновесии фаз для сплава данного состава при любой температуре (правило рычага).
Для данного случая
правило рычага можно записать:
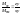 z
– cостав
твердой фазы, х – состав жидкой фазы.
z
– cостав
твердой фазы, х – состав жидкой фазы.
