
- •1. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •4. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •6. Связь периодического закона со строением электронных оболочек атома. Правило Клечковского. Энергетические ячейки. Правило Хунда.
- •7.Периодический закон д.И.Менделеева и периодическая система: ряды, периоды, группы, подгруппы и порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и пи-связи. Гибридизация атомных орбиталей.
- •12. Ионная связь.
- •13. Полярность связи. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Теплота. Работа. Теплоемкость.
- •18. Первое начало термодинамики. Закон Гесса. Термохимические расчеты.
- •19. Стандартная энтальпия образования. Следствия из закона образования.
- •20. Зависимость теплового эффекта реакции от температуры (закон Кирхгоффа).
- •21. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •23. Условия самопроизвольного протекания химических реакций.
- •24. Константа химического равновесия. Расчет Кр и Кс.
- •25. Принцип Ле-Шателье.
- •27. Молекулярность и порядок реакции.
- •28. Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •29. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •30. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •35. Растворимость газов в жидкостях. Закон Генри. Закон Дальтона. Закон распределения.
- •31. Скорость гетерогенной химической реакции.
- •32. Катализ. Гомогенный и гетерогенный катализ.
- •33. Растворы. Растворимость. Способы выражения концентраций растворов.
- •34. Физические и химические процессы при при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •36. Законы Рауля.
- •39.Сильные электролиты. Понятие активности и коэффициента активности.
- •37. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •40.Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •38. Константа диссоциации. Закон разведения Оствальда.
- •41. Гидролиз солей. Константа и степень гидролиза.
- •42. Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •43.Возникновение скачка потенциала на границе “металл-раствор”. Равновесный электродный потенциал.
- •44. Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
- •46. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений.
- •45.Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •50.Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •47. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •49. Законы Фарадея. Выход по току.
- •48.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •51.Классификация химических источников тока.
- •52. Коррозия металлов. Химическая и электрохимическая коррозия.
- •53. Основные методы борьбы с коррозией.
- •54. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •5. Смешанная связь.
- •55. Составные части системы и компоненты. Правило фаз.
- •57.Диаграмма состояния однокомпонентной системы на примере воды.
- •56.Сущность термографического анализа. Кривые нагревания и охлаждения.
- •58.Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •59. Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •64. Адгезия, когезия, сорбция (адсорбция и абсорбция).
- •60.Диаграмма плавкости непрерывно твердых растворов. Правило рычага.
- •61. Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
- •62. Диаграмма плавкости бинарной системы с образованием химических соединений.
- •65. Физическая адсорбция и хемосорбция.
- •66. Величина и механизм адсорбции.
- •67. Поверхностное натяжение твердых тел. Принцип Гиббса-Кюри.
- •68. Поверхностное натяжение растворов. Изотерма адсорбции Лэнгмюра. Уравнение Фрейндлиха.
- •63. Дальтониды и бертоллиды.
43.Возникновение скачка потенциала на границе “металл-раствор”. Равновесный электродный потенциал.
Электрохимия – область физической химии, охватывающая химические процессы, сопровождающиеся возникновением электрического тока, либо вызванные действием электрического тока.
Электрод – проводник 1 рода, погруженный в раствор электролита в условиях прохождения через него тока. В объеме металла устанавливается подвижное равновесие: Ме=Men++ n*ē. При погружении электрода в воду катионы металла гидратируются полярными молекулами воды и переходят в раствор, Men++ mH2O=Meрn+m*H2O.
Поверхность электрода заряжается отрицательно за счет оставшихся электронов, из-за этого перешедшие в раствор катионы не могут отойти от электрода. Катионы и электроны создают двойной электрический слой (его толщина зависит от концентрации раствора, температуры, заряда металла). Пограничный слой жидкости заряжается положительно, поверхность металла отрицательно, возникает скачок электрического потенциала – электродный потенциал.
Потенциал, отвечающий состоянию равновесия, когда скорость перехода ионов в раствор равна скорости их осаждения – равновесный потенциал.
Для всех металлов, погружаемых в чистую воду, качественно наблюдается одинаковая картина: металл заряжается отрицательно, прилегающий слой жидкости – положительно.
Данный скачок
можно охарактеризовать реакцией:

Рассмотрим погружение в раствор активного и неактивного металла.
1. Активный металл посылает большое число ионов в раствор, равновесная концентрация его ионов трудно достижима => металл будет заряжаться отрицательно.
2. Равновесная концентрация очень мала => электроду сообщается положительный заряд, а оставшиеся анионы создают отрицательный заряд у прилегающего слоя.
44. Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
Гальванический элемент – любое устройство, дающее возможность получать электрический ток за счет проведения той или иной химической реакции.
Примечание автора. Обязательна графическая иллюстрация.
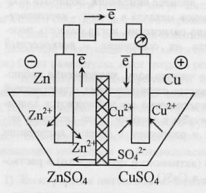
Рассмотрим систему, в которой медь и цинк в виде пластинок помещены в растворы своих солей, разделенных перегородкой – диафрагмой. При разомкнутой цепи электроды приобретают равновесные потенциалы, которые отличаются по знаку и по величине.
При ее замыкании
электроны от цинкового электрода
перемещаются к медному. На электродах
нарушается равновесие:

Получают развитие две реакции: на катоде – окисление Zn=Zn2++2ē, на аноде – восстановление Cu2++2ē=Сu0.
Суммарная реакция:

Гальванический элемент на основе такой реакции был предложен русским ученым Якоби. Создателем является и ученый Даниэль.
В связи с восстановлением катионов у медного электрода накапливается избыток анионов SO22-, а у цинкового электрода их недостаток. Эти анионы начинают перемещаться через полупроницаемую перегородку, замыкая цепь.
Причина возникновения тока – разность потенциалов на электродах. ЭДС элемента – максимальная разность потенциалов, отвечающая обратимым условиям работы гальванического элемента. Она равна алгебраической сумме отдельных скачков потенциалов на границах раздела фаз, образующих элемент. Очевидно, чем больше ЭДС, тем быстрее протекает реакция окисления-восстновления.
Гальваническая
цепь –
последовательная совокупность скачков
потенциалов на поверхностях раздела,
отвечающих данному гальваническому
элементу. В данном случае цепь
записывается:


1 и 3 – скачки на границах «электрод-электролит», 2 – на границе электролита, 4 – на границе двух металлов.
Величиной
 можно пренебречь.
можно пренебречь.
