
- •1. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •4. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •6. Связь периодического закона со строением электронных оболочек атома. Правило Клечковского. Энергетические ячейки. Правило Хунда.
- •7.Периодический закон д.И.Менделеева и периодическая система: ряды, периоды, группы, подгруппы и порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и пи-связи. Гибридизация атомных орбиталей.
- •12. Ионная связь.
- •13. Полярность связи. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Теплота. Работа. Теплоемкость.
- •18. Первое начало термодинамики. Закон Гесса. Термохимические расчеты.
- •19. Стандартная энтальпия образования. Следствия из закона образования.
- •20. Зависимость теплового эффекта реакции от температуры (закон Кирхгоффа).
- •21. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •23. Условия самопроизвольного протекания химических реакций.
- •24. Константа химического равновесия. Расчет Кр и Кс.
- •25. Принцип Ле-Шателье.
- •27. Молекулярность и порядок реакции.
- •28. Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •29. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •30. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •35. Растворимость газов в жидкостях. Закон Генри. Закон Дальтона. Закон распределения.
- •31. Скорость гетерогенной химической реакции.
- •32. Катализ. Гомогенный и гетерогенный катализ.
- •33. Растворы. Растворимость. Способы выражения концентраций растворов.
- •34. Физические и химические процессы при при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •36. Законы Рауля.
- •39.Сильные электролиты. Понятие активности и коэффициента активности.
- •37. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •40.Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •38. Константа диссоциации. Закон разведения Оствальда.
- •41. Гидролиз солей. Константа и степень гидролиза.
- •42. Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •43.Возникновение скачка потенциала на границе “металл-раствор”. Равновесный электродный потенциал.
- •44. Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
- •46. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений.
- •45.Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •50.Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •47. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •49. Законы Фарадея. Выход по току.
- •48.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •51.Классификация химических источников тока.
- •52. Коррозия металлов. Химическая и электрохимическая коррозия.
- •53. Основные методы борьбы с коррозией.
- •54. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •5. Смешанная связь.
- •55. Составные части системы и компоненты. Правило фаз.
- •57.Диаграмма состояния однокомпонентной системы на примере воды.
- •56.Сущность термографического анализа. Кривые нагревания и охлаждения.
- •58.Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •59. Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •64. Адгезия, когезия, сорбция (адсорбция и абсорбция).
- •60.Диаграмма плавкости непрерывно твердых растворов. Правило рычага.
- •61. Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
- •62. Диаграмма плавкости бинарной системы с образованием химических соединений.
- •65. Физическая адсорбция и хемосорбция.
- •66. Величина и механизм адсорбции.
- •67. Поверхностное натяжение твердых тел. Принцип Гиббса-Кюри.
- •68. Поверхностное натяжение растворов. Изотерма адсорбции Лэнгмюра. Уравнение Фрейндлиха.
- •63. Дальтониды и бертоллиды.
37. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
Электролиты – вещества, которые в растворе или расплаве состоят полностью или частично из ионов.
Они не подчиняются законам Рауля: их растворы замерзают при более низких температурах, а кипят при более высоких температурах, чем растворы неэлектролитов той же моляльной концентрации.
Электролитическая диссоциация.
Теорию ЭД предложил шведский ученый Аррениус. «Электролиты, растворяясть в воде, распадаются на ионы (заряженные частицы). При этом каждый ион ведет себя как самостоятельная частица.
В результате диссоциации концентрация увеличивается (число частиц в единице объема).»
Академик Каблуков дополнил теорию ЭД: «основная причина диссоциации на ионы – взаимодействие с полярными молекулами воды».
Согласно закону
Кулона, сила притяжения между зарядами
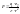
 показывает, во сколько раз сила в данной
среде меньше, чем в вакууме.
показывает, во сколько раз сила в данной
среде меньше, чем в вакууме.
Об ионизирующей способности растворителей судят по их диэлектрической проницаемости: чем она выше, тем энергичнее протекает процесс ЭД.
Кроме воды,
электролиты диссоциируют в

По способности диссоциации электролиты делятся на слабые и сильные. Сильные диссоциируют полностью – процесс необратим. Процесс диссоциации слабых обратим (в растворах содержатся как ионы, так и недиссоциированные молекулы).
Степень диссоциации
- доля растворенного электролита,
распавшегося на ионы. Для сильных -
 для слабых
для слабых

На практике СД
определяют путем измерения
электропроводимости раствора. Различают
удельную электропроводимость
 и эквивалентную
и эквивалентную

 повышается с
увеличением разбавления до некоторой
предельной величины, когда все молекулы
распадаются на ионы
повышается с
увеличением разбавления до некоторой
предельной величины, когда все молекулы
распадаются на ионы
 При этом предельное значение эквивалентной
электропроводимости – электропроводимость
при бесконечном разбавлении
-
При этом предельное значение эквивалентной
электропроводимости – электропроводимость
при бесконечном разбавлении
-
 Для слабых электролитов выполняется
Для слабых электролитов выполняется

40.Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
Электролиты – вещества, которые в растворе или расплаве состоят полностью или частично из ионов.
Они не подчиняются законам Рауля: их растворы замерзают при более низких температурах, а кипят при более высоких температурах, чем растворы неэлектролитов той же моляльной концентрации.
Электролитическая диссоциация.
Теорию ЭД предложил шведский ученый Аррениус. «Электролиты, растворяясть в воде, распадаются на ионы (заряженные частицы). При этом каждый ион ведет себя как самостоятельная частица.
В результате диссоциации концентрация увеличивается (число частиц в единице объема).»
Академик Каблуков дополнил теорию ЭД: «основная причина диссоциации на ионы – взаимодействие с полярными молекулами воды».
Чистая дистиллированная
вода в небольшой степени проводит ток.
Ее удельная электропроводимость:

Вода диссоциирует
по схеме:

Константа диссоциации
– частный случай константы равновесия:

Ионное произведение
воды:

С повышением температуры это произведение возрастает.
Степень кислотности растворов условились оценивать при помощи десятичного логарифма концентрации ионов [H+]. Эта величина – водородный показатель.
нейтральный раствор pH=7, кислый - pH<7, щелочной - pH>7.
Реакцию среды (кислотность или щелочность) часто определяют с помощью индикаторов. Индикаторы - слабые органические кислоты или основания, которые меняют окраску в зависимости от [H+].
Пример. лакмус, фенолфталеин, универсальный индикатор.
